Pancréatectomie distale ouverte pour le cancer du pancréas
Main Text
Table of Contents
La pancréatectomie distale est une intervention pratiquée le plus souvent pour les tumeurs pancréatiques, bénignes et malignes, mais peut également être indiquée dans le traitement de la pancréatite. L’opération peut être réalisée avec une résection en bloc de la rate, ou avec une préservation splénique - la splénectomie est indiquée pour la résection oncologique. L’approche opératoire – laparoscopique, robotique ou ouverte – est dictée par le patient et le scénario clinique en question. Dans ce cas, nous effectuons une pancréatectomie distale ouverte avec splénectomie chez un patient qui a subi un traitement néoadjuvant pour un adénocarcinome pancréatique. Il s’agit d’un cas unique d’un patient subissant une résection chirurgicale après un diagnostic initial de maladie métastatique. La patiente est une femme de 69 ans qui a d’abord présenté des douleurs abdominales et des ballonnements, et on a découvert qu’elle avait une tumeur suspecte de 2 cm dans le corps de son pancréas et des métastases hépatiques uniques prouvées par biopsie. Elle a été traitée par une chimiothérapie néoadjuvante prolongée, et les scintigraphies de rééchelonnement ont montré une réponse significative. La chimioradiothérapie a été terminée et les métastases hépatiques n’étaient plus visibles à l’imagerie. Vingt-sept mois après le diagnostic, elle a été emmenée en salle d’opération pour une pancréatectomie distale et une splénectomie. Aucune métastase hépatique ou péritonéale n’a été observée. Son évolution postopératoire s’est déroulée dans l’ensemble sans incident et elle s’est bien rétablie. La pathologie chirurgicale finale a montré une réponse pathologique complète, sans signe de maladie et 0/11 ganglions lymphatiques positifs pour la malignité. Elle est actuellement suivie par tomodensitométrie et marqueurs tumoraux tous les trois mois par son équipe d’oncologie médicale, et à ce jour, en février 2022, il n’y a aucun signe de récidive.
Malgré son incidence relativement faible, le cancer du pancréas est la quatrième cause de décès par cancer aux États-Unis. 1 L’adénocarcinome canalaire pancréatique (PDAC) est le type le plus fréquent de cancer du pancréas, avec une petite proportion de patients porteurs de tumeurs endocrines malignes à croissance plus lente. Les facteurs de risque comprennent l’âge avancé, le sexe masculin, le diabète, les antécédents de tabagisme, la pancréatite et certains loci de susceptibilité génétique, entre autres. La résection chirurgicale R0 de ces tumeurs offre la seule chance de traitement curatif. Au moment du diagnostic, les cancers du pancréas sont classés comme non résécables/disséminés, localement avancés, à la limite de la résésection ou résécables dès le départ (voir tableau 1), ce qui dépend en grande partie de l’atteinte tumorale du système vasculaire local et de la présence de métastases à distance. 2 La majorité des cancers du pancréas (60 à 70 %) surviennent dans la tête de la glande, le reste dans le corps et la queue. 1 Pertinent dans la pancréatectomie distale, l’atteinte de la vascularisation splénique n’est pas une contre-indication à la résection chirurgicale. Malheureusement, la majorité des patients atteints d’un cancer du pancréas auront une propagation à distance de la maladie au moment du diagnostic ; Ceci est observé à un taux encore plus élevé chez les personnes atteintes de tumeurs du corps et de la queue du pancréas, car les petites masses dans cette partie du pancréas sont généralement asymptomatiques. En fin de compte, seulement 5 à 7 % des personnes atteintes de PDAC dans le corps ou la queue du pancréas subiront une intervention chirurgicale. 3
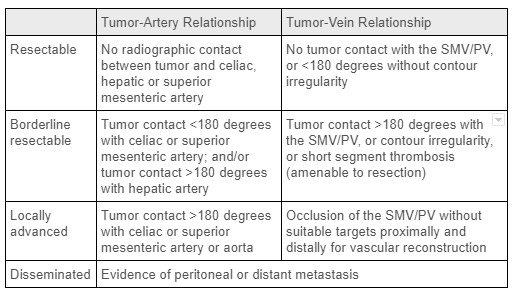
Tableau 1 : Critères de stadification tumorale dans le cancer du pancréas. Source : Traitement chirurgical actuel, néoadjuvant et traitement adjuvant du cancer du pancréas2
Pour les patients atteints d’une maladie résécable à l’avance sans caractéristiques à haut risque, la chirurgie est l’option de traitement de première ligne recommandée, conformément aux directives du NCCN de 2019, et est soutenue par des essais cliniques récents. 4">4 Les options de prise en charge chirurgicale de l’adénocarcinome pancréatique comprennent la pancréaticoduodénectomie (procédure de Whipple) pour les lésions de la tête et la pancréatectomie distale avec splénectomie pour les lésions du corps et de la queue. Le traitement de première intention de la maladie à la limite de la résécabilité et localement avancée est le traitement néoadjuvant (TAN), composé de FOLFIRINOX ou de gemcitabine-nab-paclitaxel.3 De plus en plus de littérature soutient le TAN dans le PDAC, de sorte qu’un certain nombre d’essais cliniques examinent le TAN avant la résection chirurgicale dans les maladies résécables initiales. 5, 6 Les avantages et les inconvénients d’une telle approche sont discutés plus en détail ci-dessous.
Les résultats du traitement varient en fonction du stade de la tumeur lors de la présentation du patient et de l’étendue de la résection chirurgicale. Le taux de survie global à 5 ans pour tous les patients atteints d’un cancer du pancréas est d’environ 10 %. Cela varie entre les patients dont la résection R0 a réussi, ce qui laisse présager un taux de survie à 5 ans d’environ 30 % dans le cas d’une maladie sans envahissement ganglionnaire et de 10 % dans le cas d’une maladie avec envahissement ganglionnaire, et chez les patients atteints d’une maladie disséminée au moment du diagnostic, avec pratiquement aucune possibilité de survie à long terme. 1
Il s’agit d’une patiente de 69 ans ayant d’importants antécédents de tabagisme, de HLD, de HTN et de RGO qui s’est d’abord manifestée par des douleurs abdominales, une perte de poids et des ballonnements. Le bilan comprenait une tomodensitométrie qui a révélé une masse corporelle pancréatique mesurant 2,1 cm et une lésion hépatique. Le marqueur tumoral CA 19-9 était élevé à 69 U/mL. La tomodensitométrie thoracique jusqu’à la stadification complète était négative pour la maladie métastatique. Une biopsie hépatique guidée par échographie a révélé un adénocarcinome. Le patient a ensuite subi 4 cycles de FOLFIRINOX. Les scintigraphies de restadification ont montré une augmentation de la taille des lésions hépatiques et une diminution de la masse pancréatique, et elle a été remplacée par de la gemcitabine/abraxane pendant quatre cycles. Une nouvelle tomodensitométrie a ensuite montré une diminution des masses hépatiques et pancréatiques. Au total, 17 cycles de gem/abraxane ont été administrés, la TDM montrant une maladie stable et le CA 19-9 de 5 U/mL. Elle a ensuite été placée en monothérapie à la gemcitabine. Elle a remarquablement bien toléré la chimiothérapie avec des effets secondaires minimes – souffrant d’insomnie et de neuropathie.
Une chimioradiothérapie de longue durée (5 semaines) a ensuite été proposée compte tenu de la stabilité persistante de la maladie. La capécitabine et la radiothérapie (RT) ont été administrées en même temps. L’imagerie hépatique par IRM n’a révélé aucun signe de maladie à la fin du traitement. La tumeur primitive avait également remarquablement diminué en taille. Le consensus de la discussion multidisciplinaire était que la prise en charge chirurgicale avec pancréatectomie distale et splénectomie était une prochaine étape appropriée, bien que non conventionnelle, chez une patiente initialement diagnostiquée avec un cancer du pancréas de stade IV, compte tenu de sa réponse durable et de l’absence de preuve de maladie métastatique lors de l’imagerie répétée, et du faible niveau de marqueurs tumoraux.
Lors de la consultation, le patient ne présentait aucun signe de jaunisse, de masses abdominales palpables ou de cicatrices chirurgicales abdominales.
La tomodensitométrie au moment du diagnostic a mis en évidence une masse pancréatique hétérogène, irrégulière et à faible atténuation dans le corps du pancréas mesurant 2,1 cm x 2,1 cm, avec dilatation canalaire pancréatique et atrophie du parenchyme du pancréas, suspecte de malignité pancréatique. Une lésion hépatique hétérogène de 9 mm à faible atténuation dans le lobe hépatique droit a été caractérisée par IRM hépatique et, finalement, une biopsie guidée par échographie a confirmé l’adénocarcinome métastatique.
L’AS et le SMV n’étaient pas impliqués par la masse, mais il y avait effacement de la veine splénique.
La tomodensitométrie après la fin du traitement néoadjuvant avant la résection chirurgicale sur une période de deux ans après le diagnostic initial a révélé un foyer hypodense de 1,2 cm x 0,5 cm dans le corps du pancréas, ce qui était inchangé par rapport aux études d’imagerie précédentes, sans dilatation canalaire mais avec une atrophie persistante de la queue pancréatique. L’IRM du foie ne permettait plus de visualiser ce qui était devenu une lésion hépatique subcentimétrique dans le lobe droit.
La technique opératoire de la pancréatectomie distale suit généralement deux modèles. On peut aborder la dissection de manière médiale à latérale, en formant d’abord un tunnel sous le pancréas et en traversant la glande, en étendant la dissection vers la queue pancréatique et le hile splénique. Alternativement, la dissection peut être initiée sur la face latérale de la glande et portée médialement. Notre approche préférée est la dissection médiale à latérale, bien qu’une compréhension et des compétences impliquant les deux offrent au chirurgien des voies alternatives lorsqu’une dissection difficile peut exclure l’une ou l’autre approche.
La pancréatectomie distale peut être pratiquée avec ou sans splénectomie. Les techniques chirurgicales de préservation de la rate comprennent la dissection méticuleuse des vaisseaux spléniques de la partie postérieure du pancréas, ou la préservation des courts vaisseaux gastriques, qui fournissent un apport sanguin à la rate dans le cadre de la ligature des vaisseaux spléniques, décrite pour la première fois par Warshaw et al. en 1988. 7 Dans ce cas, nous avons choisi d’effectuer une splénectomie compte tenu de la nature de la présentation oncologique du patient, bien que la préservation de la rate laisse présager certains avantages cliniques, tels que l’évitement du risque d’infection post-splénectomie écrasante (OPSI). Chez les patients subissant une splénectomie associée à une pancréatectomie distale, des vaccins contre les organismes encapsulés doivent être administrés pour réduire le risque d’OPSI. Cela comprend la vaccination contre Neisseria meningitides, Streptococcus pneumoniae et Haemophilus influenzae. Les patients reçoivent également régulièrement un approvisionnement d’urgence en antibiotiques en cas d’infection.
L’objectif du traitement chirurgical des lésions du corps pancréatique et de la queue avec pancréatectomie distale et splénectomie est la résection R0 avec élimination de toutes les maladies. Cela fournit au patient la seule option de traitement curatif. Bien que les taux de mortalité périopératoire soient faibles dans les centres à fort volume (1 à 2 %), la morbidité reste élevée (20 à 30 %). 8 Cela inclut les complications liées à l’opération, y compris la fistule pancréatique, qui est la plus courante, mais aussi les conséquences, telles que le développement du diabète, qui survient chez environ 15 à 30 % des patients. 9 Ainsi, le risque d’une opération relativement morbide doit également être mis en balance avec les avantages potentiels et la probabilité d’obtenir une résection R0, qui est une discussion individualisée qui doit avoir lieu lors de conférences multidisciplinaires et entre le patient et le chirurgien.
Ce cas présente un patient unique, présentant initialement une maladie métastatique, qui a démontré une réponse durable à la NAT pendant plus de deux ans avant de subir une résection chirurgicale, avec une réponse pathologique complète. Cette évolution remarquable est une valeur aberrante, mais elle offre un espoir important pour l’avenir du traitement de la PDAC et met en évidence la puissance de la NAT dans une maladie potentiellement à un stade inférieur (un paradigme observé dans d’autres cancers du tube digestif, y compris le cancer du rectum, dans lequel une réponse pathologique complète est souvent observée après NAT10). Quelques rapports de cas dans la littérature décrivent des réponses similaires chez les patients. 11
Les faits saillants techniques de ce cas comprennent une dissection rétropéritonéale difficile avec fibrose étendue, comme on l’observe souvent chez les patients après TAN. Une section congelée de tissu fibreux recouvrant l’artère hépatique a été envoyée et s’est révélée négative pour la malignité. La tumeur était molle et souple, ce qui est une caractéristique souvent observée chez les patients présentant une bonne réponse au traitement néoadjuvant. La dissection des principales structures vasculaires autour du corps et de la queue du pancréas, y compris le PV et le SMV, l’artère hépatique, la veine rénale et la veine surrénale, s’est déroulée sans incident. Le pancréas a été coupé à l’aide d’une agrafeuse, à l’aide d’une charge d’agrafe de protection de couture. Un drain a été laissé en place à la marge de transsection pancréatique, comme le veut notre protocole. La perte de sang estimée était < 100 cc et le patient s’est rétabli sans complications postopératoires importantes. Notamment, la pathologie chirurgicale finale n’a révélé aucun signe de maladie avec une réponse pathologique complète.
Le traitement moderne du cancer du pancréas dépend du stade auquel le patient se présente, et les patients sont traités par une thérapie multimodale, y compris la chimiothérapie et la radiothérapie. Le cancer du pancréas résécable dès le départ peut être traité par chirurgie d’abord, dans le but d’obtenir une résection R0 ; cependant, il y a un intérêt croissant pour offrir la NAT avant la chirurgie, même dans les cas de maladie résécable initiale. Comme mentionné ci-dessus, dans les maladies localement avancées et à la limite de la résécabilité, le traitement de première intention est le NAT ; si les patients ne présentent aucune progression de la maladie lors de la TAN, une exploration chirurgicale est généralement proposée, car les résultats radiographiques ne sont souvent pas prédictifs de la résécabilité après TAN.
Les avantages du NAT dans les maladies résécables comprennent la possibilité d’un traitement plus précoce et plus rapide des maladies microscopiques, une meilleure sélection des patients, ainsi qu’une plus grande probabilité d’achèvement du traitement complet. Compte tenu des taux élevés de patients (jusqu’à 25 %) présentant une maladie métastatique au moment de l’opération, l’administration d’un traitement néoadjuvant permet à la biologie tumorale d’évoluer et potentiellement de s’auto-sélectionner pour les patients les plus susceptibles de bénéficier d’une intervention chirurgicale qui expose un patient à un risque de morbidité importante. Un avantage supplémentaire est que le risque de fistule pancréatique diminue considérablement après une TAN.12
Cependant, il y a quelques inconvénients à cette approche. Renoncer à la NAT offre la possibilité d’enlever la tumeur avant qu’elle ne progresse, car l’ablation chirurgicale est la seule chance de guérison à long terme dans le PDAC. Pour les patients présentant une obstruction biliaire subissant une TAN, la pose d’une endoprothèse biliaire doit être effectuée, ce qui comporte ses propres risques qui ont été relatés dans plusieurs études. 13
Les progrès de la pancréatectomie distale comprennent l’utilisation de techniques mini-invasives ; Des procédures laparoscopique et robotique sont pratiquées partout au pays. Récemment, les premiers essais cliniques contrôlés randomisés sur la pancréatectomie distale mini-invasive par rapport à la pancréatectomie distale ouverte ont été publiés. 14 L’essai LEOPARD est un ECR multicentrique à l’insu du patient pour les patients atteints de tumeurs pancréatiques du côté gauche sans atteinte vasculaire. Dans cet essai, la pancréatectomie distale mini-invasive a été associée à une réduction du temps de récupération fonctionnelle ; Cependant, le taux global de complications n’a pas été affecté. 15 L’essai LAPOP est un ECR prospectif en aveugle qui évalue le critère d’évaluation principal de la durée du séjour hospitalier postopératoire. Cet essai a démontré une diminution significative de la durée du séjour à l’hôpital (5 jours contre 6 jours) et un changement global du taux de complications. 16 Ces données suggèrent qu’une pancréatectomie distale mini-invasive peut offrir aux patients une récupération plus rapide. Cependant, les données manquent en ce qui concerne les résultats oncologiques lorsque l’on compare les procédures ouvertes aux procédures mini-invasives, et des travaux supplémentaires sont nécessaires dans ce domaine. Chez les patients atteints de TAN, en particulier si la radiation était un composant, il peut y avoir une fibrose marquée autour des principaux vaisseaux, ce qui rend la dissection, bien que peu invasive, plus difficile.
Lors du suivi, cette patiente a pu reprendre ses activités normales de la vie quotidienne. Elle a signalé une perte de poids significative de > 25 livres et des selles molles continues. Elle a commencé à prendre du Créon pour une insuffisance exocrine pancréatique présumée. L’imagerie la plus récente au moment de la rédaction de cet article en février 2022 n’a montré aucun signe de maladie récurrente. La patiente continuera d’être suivie par son équipe d’oncologie médicale avec des tomodensitogrammes tous les 3 mois et la mesure des marqueurs tumoraux.
Rien à divulguer.
Le patient visé dans cet article vidéo a donné son consentement éclairé pour être filmé et est conscient que des informations et des images seront publiées en ligne.
References
- McGuigan A, Kelly P, Turkington RC, Jones C, Coleman HG, McCain RS. Cancer du pancréas : examen du diagnostic clinique, de l’épidémiologie, du traitement et des résultats. Monde J Gastroenterol. 2018; 24(43):4846-4861. doi :10.3748/wjg.v24.i43.4846.
- Cameron JK, Cameron AM. Traitement chirurgical actuel. 10e éd. Philadelphie : Elsevier Mosby ; 2011.
- Oba A, Ho F, Bao QR, Al-Musawi MH, Schulick RD, Del Chiaro M. Traitement néoadjuvant du cancer du pancréas. Frontières en oncologie. 2020; 10(245). doi :10.3389/fonc.2020.00245.
- Ghaneh P, Palmer DH, Cicconi S, et.al. ESPAC-5F : Essai international randomisé de phase II, prospectif, multicentrique à quatre bras portant sur la chirurgie immédiate par rapport à la gemcitabine néoadjuvante associée à la capécitabine (GEMCAP) ou au FOLFIRINOX ou à la chimioradiothérapie (CRT) chez des patients atteints d’un cancer du pancréas à la limite de la résécabilité. J Clin Oncol. 2020; 38(15)4505. doi :10.1200/JCO.2020.38.15_suppl.4505.
- Muller PC, Frey MC, Ruzza CM, et al. Chimiothérapie néoadjuvante dans le cancer du pancréas : une évaluation des preuves actuelles de haut niveau. Pharmacologie. 2021;106:143-153. doi :10.1159/000510343.
- Versteijne E, Suker M, Groothuis K, et al. Chimioradiothérapie préopératoire par rapport à la chirurgie immédiate pour le cancer du pancréas résécable et à la limite de la résécabilité : résultats de l’essai randomisé néerlandais de phase III PREOPANC. J Clin Oncol. 2020; 38(16):1763-1773. doi :10.1200/JCO.19.02274.
- Warshaw AL. Pancréatectomie distale avec préservation de la rate. J Pancréat hépatobiliaire Sci. 2010;17:818-812. doi :10.1007/s00534-009-0226-z.
- Lillemoe KD, Kaushal S, Cameron JL, Sohn TA, Pitt HA, Yeo CJ. Pancréatectomie distale : indications et résultats chez 235 patients. Ann Surg. 1999; 229(5):693. doi :10.1097/00000658-199905000-00012.
- De Brujin KMJ, van Eijck CHJ. Diabète d’apparition récente après pancréatectomie distale : une revue systématique. Ann Surg. 2015; 216(5):854-61. doi :10.1097/SLA.000000000000819.
- Kong M, Hong SE, Choi WS, Kim SY, Choi J. Chimioradiothérapie concomitante préopératoire pour le cancer du rectum localement avancé : résultats du traitement et analyse des facteurs pronostiques. Traiter le cancer. 2012; 44(2):104-112. doi :10.4143/crt.2012.44.2.104.
- Rios Perez MV, Dai B, Koay EJ, Wolff RA, Fleming JB. Régression du cancer du pancréas de stade IV vers la chirurgie curative et introduction d’un nouveau test de chimiosensibilité ex-vivo. Cureus. 2015; 7(12) :E423. doi :10.7759/cureus.423.
- Hank T, Sandini M, Ferrone CR, et al. Association entre la fistule pancréatique et la survie à long terme à l’ère de la chimiothérapie néoadjuvante. JAMA Surg. 2019; 154(10):943-951. doi :10.1001/jamasurg.2019.2272.
- Kuwatani M, Nakamura T, Hayashi T, et al. Résultats cliniques du drainage biliaire au cours d’un traitement néoadjuvant pour le cancer du pancréas : endoprothèses métalliques ou plastiques. Intestin Foie. 2020; 14(2):269-273. doi :10.5009/gnl18573.
- Riviere D, Gurusamy KS, Kooby DA, Vollmer CM, Besselink MGH, Davidson BR, van Laarhoven CJHM. Pancréatectomie distale laparoscopique ou ouverte pour le cancer du pancréas. Base de données Cochrane des revues systématiques. 2016; 4(CD011391). doi :10.1002/14651858.CD011391.pub2.
- De Rooij T, van Hilst J, van Santvoort H, et.al. Pancréatectomie distale mini-invasive versus ouverte (LEOPARD) : un essai contrôlé randomisé multicentrique en aveugle du patient. Ann Surg. 2019; 269(1):2-9. doi :10.1097/SLA.000000000002979.
- Bjornsson B, Sandstrom P, Larsson AL, Hjalmarsson C, Gasslander T. Pancréatectomie distale laparoscopique versus ouverte (LAPOP) : protocole d’étude pour un essai contrôlé randomisé monocentrique, non aveugle. Essais. 2019; 20(356). doi :10.1186/s13063-019-3460-y.
Cite this article
Hennessy ML, Fernandez-del Castillo C. Pancréatectomie distale ouverte pour le cancer du pancréas. J Med Insight. 2022; 2022(339). doi :10.24296/jomi/339.

