Pancreatectomía distal abierta para el cáncer de páncreas
Main Text
Table of Contents
La pancreatectomía distal es un procedimiento que se realiza con mayor frecuencia para los tumores pancreáticos, tanto benignos como malignos, pero también puede estar indicado en el tratamiento de la pancreatitis. La operación se puede realizar con una resección en bloque del bazo o con preservación esplénica; la esplenectomía está indicada para la resección oncológica. El enfoque quirúrgico (laparoscópico, robótico o abierto) está dictado por el paciente y el escenario clínico en cuestión. En este caso, realizamos una pancreatectomía distal abierta con esplenectomía en un paciente que se ha sometido a tratamiento neoadyuvante por adenocarcinoma pancreático. Este es un caso único de un paciente sometido a resección quirúrgica después del diagnóstico inicial de enfermedad metastásica. La paciente es una mujer de 69 años que inicialmente presentó dolor abdominal e hinchazón, y se encontró que tenía un tumor sospechoso de 2 cm en el cuerpo de su páncreas y metástasis hepáticas únicas probadas por biopsia. Fue tratada con un ciclo prolongado de quimioterapia neoadyuvante, y las exploraciones de reestadificación mostraron una respuesta significativa. Se completó la quimiorradiación y la metástasis hepática ya no era visible en las imágenes. Veintisiete meses después del diagnóstico fue llevada al quirófano para pancreatectomía distal y esplenectomía; No se observaron metástasis hepáticas ni peritoneales. Su curso postoperatorio fue en general sin incidentes, y se recuperó bien. La patología quirúrgica final demostró una respuesta patológica completa sin evidencia de enfermedad observada y 0/11 ganglios linfáticos positivos para neoplasia maligna. Actualmente está siendo seguida con tomografías computarizadas y marcadores tumorales cada tres meses por su equipo de oncología médica, y a partir de ahora, febrero de 2022, no hay evidencia de recurrencia.
A pesar de su incidencia relativamente baja, el cáncer de páncreas es la cuarta causa principal de muerte por cáncer en los Estados Unidos. 1 El adenocarcinoma ductal pancreático (PDAC) es el tipo más frecuente de cáncer de páncreas, con una pequeña proporción de pacientes que albergan tumores endocrinos malignos de crecimiento más lento. Los factores de riesgo incluyen edad avanzada, sexo masculino, diabetes, antecedentes de tabaquismo, pancreatitis y ciertos loci de susceptibilidad genética, entre otros. La resección quirúrgica R0 de estos tumores ofrece la única posibilidad de tratamiento curativo. En el momento del diagnóstico, los cánceres de páncreas se clasifican como irresecables/diseminados, localmente avanzados, resecables limítrofes o resecables por adelantado (consulte el Cuadro 1), lo que depende en gran medida de la afectación tumoral de la vasculatura local y la presencia de metástasis a distancia. 2 La mayoría de los cánceres de páncreas (60-70%) surgen en la cabeza de la glándula, y el resto en el cuerpo y la cola. 1 Relevante en la pancreatectomía distal, la afectación de la vasculatura esplénica no es una contraindicación para la resección quirúrgica. Desafortunadamente, la mayoría de los pacientes con cáncer de páncreas tendrán una propagación distante de la enfermedad en el momento del diagnóstico; Esto se observa a un ritmo aún mayor en aquellos con tumores del cuerpo pancreático y la cola, ya que las masas pequeñas en esta parte del páncreas son típicamente asintomáticas. En última instancia, solo el 5-7% de las personas con PDAC en el cuerpo / cola del páncreas se someterán a cirugía. 3
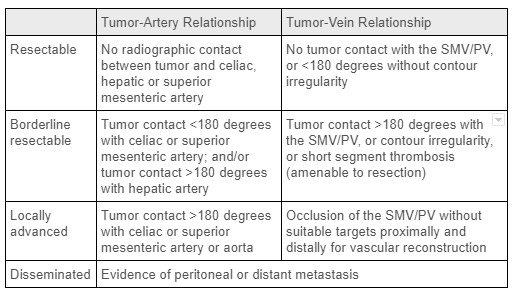
Tabla 1: Criterios para la estadificación tumoral en el cáncer de páncreas. Fuente: Current Surgical Therapy, Neoadjuvant and Adjuvant Therapy for Pancreatic Cancer (Terapia quirúrgica actual, terapia neoadyuvante y adyuvante para el cáncer de páncreas)2
Para los pacientes con enfermedad resecable inicial sin características de alto riesgo, la cirugía es la opción de tratamiento de primera línea recomendada, según las pautas de la NCCN de 2019, y está respaldada por ensayos clínicos recientes. 4">4 Las opciones para el tratamiento quirúrgico del adenocarcinoma pancreático incluyen pancreaticoduodenectomía (procedimiento de Whipple) para las lesiones en la cabeza y pancreatectomía distal con esplenectomía para las lesiones del cuerpo y la cola. El tratamiento de primera línea para la enfermedad resecable limítrofe y localmente avanzada es con tratamiento neoadyuvante (NAT), que consiste en FOLFIRINOX o gemcitabina-nab-paclitaxel.3 Un creciente cuerpo de literatura apoya NAT en PDAC, de modo que varios ensayos clínicos están examinando NAT antes de la resección quirúrgica en la enfermedad resecable inicial. 5, 6 Los pros y los contras de tal enfoque se discuten con más detalle a continuación.
Los resultados del tratamiento varían según el estadio del tumor en el momento de la presentación del paciente y la extensión de la resección quirúrgica. La tasa de supervivencia general a 5 años para todos los pacientes con cáncer de páncreas es de alrededor del 10%. Esto varía desde pacientes con resección R0 exitosa, que augura una tasa de supervivencia a 5 años de aproximadamente 30% en enfermedad ganglionar negativa y 10% de supervivencia a 5 años en enfermedad ganglionar positiva, hasta pacientes con enfermedad diseminada en el momento del diagnóstico, prácticamente sin posibilidad de supervivencia a largo plazo. 1
Se trata de una mujer de 69 años con antecedentes significativos de tabaquismo, HL, HTA y ERGE que presentó inicialmente dolor abdominal, pérdida de peso e hinchazón. El estudio incluyó una tomografía computarizada que reveló una masa corporal pancreática de 2,1 cm y una lesión hepática. El marcador tumoral CA 19-9 se elevó a 69 U/ml. La TC de tórax para completar la estadificación fue negativa para la enfermedad metastásica. La biopsia hepática guiada por USS reveló adenocarcinoma. El paciente luego se sometió a 4 ciclos de FOLFIRINOX. Las exploraciones de reestadificación demostraron un aumento en el tamaño de las lesiones hepáticas y una disminución en la masa pancreática, y se cambió a gemcitabina/abraxano durante cuatro ciclos. La TC repetida mostró una disminución tanto en el hígado como en las masas pancreáticas. Se administraron un total de 17 ciclos de gema/abraxano, con TC mostrando enfermedad estable y CA 19-9 de 5 U/ml. Luego fue trasladada a gemcitabina en monoterapia. Ella toleró la quimioterapia notablemente bien con efectos secundarios mínimos: insomnio y neuropatía.
Luego se ofreció un ciclo largo (5 semanas) de quimiorradiación dada la enfermedad estable en curso. Se administró capecitabina concomitante con radioterapia (RT). Las imágenes hepáticas con resonancia magnética no revelaron evidencia de enfermedad al finalizar el tratamiento. El tumor primario también había disminuido notablemente en tamaño. El consenso de la discusión multidisciplinaria fue que el tratamiento quirúrgico con pancreatectomía distal y esplenectomía fue el siguiente paso apropiado, aunque no convencional, en un paciente diagnosticado inicialmente con cáncer de páncreas en estadio IV, dada su respuesta duradera y la falta de evidencia de enfermedad metastásica en la repetición de imágenes y bajo nivel de marcadores tumorales.
En la presentación, el paciente no mostró evidencia de ictericia, masas abdominales palpables o cicatrices quirúrgicas abdominales.
La tomografía computarizada en el momento del diagnóstico demostró una masa pancreática heterogénea, irregular de baja atenuación en el cuerpo del páncreas que mide 2,1 cm x 2,1 cm con dilatación ductal pancreática y atrofia del parénquima del páncreas, sospechosa de neoplasia maligna pancreática. Una lesión hepática heterogénea de baja atenuación de 9 mm en el lóbulo hepático derecho se caracterizó aún más con resonancia magnética hepática y, en última instancia, adenocarcinoma metastásico confirmado por biopsia guiada por US.
La SMA y el SMV no estaban involucrados por la masa, pero hubo borramiento de la vena esplénica.
La tomografía computarizada después de completar el tratamiento neoadyuvante antes de la resección quirúrgica durante dos años después del diagnóstico inicial demostró un foco hipodenso de 1,2 cm x 0,5 cm en el cuerpo del páncreas, que no se modificó con respecto a estudios de imagen anteriores sin dilatación ductal pero atrofia persistente de la cola pancreática. La resonancia magnética hepática ya no visualizaba lo que se había convertido en una lesión hepática de subcentímetro en el lóbulo derecho.
La técnica quirúrgica en la pancreatectomía distal generalmente sigue dos modelos. Uno puede abordar la disección de una manera medial a lateral, primero formando un túnel debajo del páncreas y transectando la glándula, extendiendo la disección hacia la cola pancreática y el hilio esplénico. Alternativamente, la disección puede iniciarse en la cara lateral de la glándula y llevarse medialmente. Nuestro enfoque preferido es la disección de media a lateral, aunque una comprensión y un conjunto de habilidades que involucran a ambos ofrecen al cirujano vías alternativas cuando una disección difícil puede excluir uno u otro enfoque.
La pancreatectomía distal se puede realizar con o sin esplenectomía. Las técnicas quirúrgicas para la preservación esplénica incluyen la disección meticulosa de los vasos esplénicos de la parte posterior del páncreas, o la preservación de los vasos gástricos cortos, que proporcionan suministro de sangre al bazo en el contexto de la ligadura de los vasos esplénicos, descrita por primera vez por Warshaw et al. en 1988. 7 En este caso, elegimos realizar una esplenectomía dada la naturaleza de la presentación oncológica del paciente, aunque la preservación del bazo presagia algunos beneficios clínicos, como evitar el riesgo de una infección abrumadora posterior a la esplenectomía (OPSI). En pacientes sometidos a esplenectomía junto con pancreatectomía distal, se deben administrar vacunas contra organismos encapsulados para reducir el riesgo de OPSI. Esto incluye la vacunación contra Neisseria meningitides, Streptococcus pneumoniae y Haemophilus influenzae. Los pacientes también reciben rutinariamente un suministro de emergencia de antibióticos en caso de infección.
El objetivo del tratamiento quirúrgico de las lesiones del cuerpo pancreático y la cola con pancreatectomía distal y esplenectomía es la resección R0 con extirpación de toda enfermedad. Esto proporciona al paciente la única opción para el tratamiento curativo. Aunque las tasas de mortalidad perioperatoria son bajas en los centros de alto volumen (1-2%), la morbilidad sigue siendo alta (20-30%). 8 Esto incluye complicaciones relacionadas con la operación, incluida la fístula pancreática, que es la más común, pero también consecuencias, como el desarrollo de diabetes, que ocurre en aproximadamente el 15-30% de los pacientes. 9 Por lo tanto, el riesgo de una operación relativamente mórbida también debe sopesarse contra los beneficios potenciales y la probabilidad de lograr una resección R0, que es una discusión individualizada que se debe tener en conferencias multidisciplinarias y entre el paciente y el cirujano por igual.
Este caso presenta un paciente único, que inicialmente presentó enfermedad metastásica, que demostró una respuesta duradera a NAT durante más de dos años antes de someterse a una resección quirúrgica, con una respuesta patológica completa. Este notable curso es un caso atípico, pero proporciona una esperanza significativa para el futuro del tratamiento en PDAC, y destaca el poder de NAT en la enfermedad potencialmente descendente (un paradigma observado en otros cánceres del tracto digestivo, incluido el cáncer rectal, en el que a menudo se observa una respuesta patológica completa después de NAT10). Algunos informes de casos en la literatura describen respuestas similares de los pacientes. 11
Los aspectos técnicos más destacados de este caso incluyen una disección retroperitoneal difícil con fibrosis extensa, como se ve a menudo en pacientes después de NAT. Se envió una sección congelada de tejido fibrótico que recubre la arteria hepática y fue negativa para malignidad. Se observó que el tumor era blando y flexible, que es una característica que se observa a menudo en pacientes con buena respuesta al tratamiento neoadyuvante. La disección de las principales estructuras vasculares alrededor del cuerpo y la cola del páncreas, incluyendo la PV y SMV, la arteria hepática, la vena renal y la vena suprarrenal, se llevó a cabo sin incidentes. El páncreas se transectó con una grapadora, utilizando una carga de grapas de protección de costura. Se dejó un drenaje en su lugar en el margen de la transección pancreática, como es nuestro protocolo. La pérdida sanguínea estimada fue de < 100 cc y el paciente se recuperó sin complicaciones postoperatorias significativas. En particular, la patología quirúrgica final no reveló evidencia de enfermedad con una respuesta patológica completa.
El tratamiento moderno del cáncer de páncreas depende de la etapa en la que se presenta el paciente, y los pacientes son tratados con terapia multimodal que incluye quimioterapia y radioterapia. El cáncer de páncreas resecable inicial se puede tratar primero con cirugía, con el objetivo de lograr una resección R0; sin embargo, existe un creciente interés en ofrecer NAT antes de la cirugía, incluso en la enfermedad resecable por adelantado. Como se mencionó anteriormente, en la enfermedad localmente avanzada y resecable limítrofe, el tratamiento de primera línea es NAT; si los pacientes no muestran progresión de la enfermedad en NAT, generalmente se ofrece exploración quirúrgica, ya que los hallazgos radiográficos a menudo no son predictivos de resecabilidad después de NAT.
Los beneficios de NAT en la enfermedad resecable incluyen permitir un tratamiento más temprano y más rápido de la enfermedad microscópica, una mejor selección de pacientes, así como una mayor probabilidad de completar el régimen completo de tratamiento. Dadas las altas tasas de pacientes (hasta el 25%) que tienen enfermedad metastásica en el momento de la cirugía, la administración del tratamiento neoadyuvante permite que la biología del tumor evolucione y potencialmente se autoseleccione para los pacientes con mayor probabilidad de beneficiarse de un procedimiento quirúrgico que pone a un paciente en riesgo de morbilidad significativa. Un beneficio adicional es que el riesgo de fístula pancreática disminuye notablemente después de la NAT.12
Sin embargo, hay algunas desventajas de este enfoque. Renunciar a NAT ofrece la oportunidad de extirpar el tumor antes de que ocurra cualquier progresión, ya que la extirpación quirúrgica es la única posibilidad de curación a largo plazo en PDAC. Para los pacientes con obstrucción biliar sometidos a NAT, se debe realizar la colocación de stent biliar, lo que conlleva sus propios riesgos acordes que se han descrito en varios estudios. 13
Los avances en pancreatectomía distal incluyen el uso de técnicas mínimamente invasivas; Tanto los procedimientos laparoscópicos como los robóticos se están realizando en todo el país. Recientemente, se publicaron los primeros ensayos clínicos controlados aleatorios de pancreatectomía distal mínimamente invasiva versus abierta. 14 El ensayo LEOPARD es un ECA multicéntrico ciego al paciente para pacientes con tumores pancreáticos del lado izquierdo sin compromiso vascular. En este ensayo, la pancreatectomía distal mínimamente invasiva se asoció con un tiempo reducido hasta la recuperación funcional; sin embargo, la tasa general de complicaciones no se vio afectada. 15 El ensayo LAPOP es un ECA prospectivo que no fue cegado, evaluando el criterio de valoración primario de la duración de la estancia hospitalaria postoperatoria. Este ensayo demostró una disminución significativa en la duración de la estancia hospitalaria (5 días versus 6 días) y en general ningún cambio en la tasa de complicaciones. 16 Estos datos sugieren que la pancreatectomía distal mínimamente invasiva puede ofrecer a los pacientes una recuperación más conveniente. Sin embargo, faltan datos con respecto a los resultados oncológicos cuando se comparan los procedimientos abiertos a los mínimamente invasivos, y se necesita más trabajo en esta área. En pacientes con NAT, particularmente si la radiación era un componente, puede haber una fibrosis marcada que rodea los vasos principales que hace que la disección, aunque mínimamente invasiva, sea más difícil.
En el seguimiento, esta paciente pudo regresar a sus actividades normales de la vida diaria. Ella reportó una pérdida de peso significativa de > 25 libras y heces sueltas continuas. Ella comenzó en Creon por presunta insuficiencia pancreática exocrina. Las imágenes más recientes al escribir este artículo en febrero de 2022 no demostraron evidencia de enfermedad recurrente. La paciente continuará siendo seguida por su equipo de oncología médica con tomografías computarizadas de cada 3 meses y medición de marcadores tumorales.
Nada que revelar.
El paciente al que se hace referencia en este artículo de video ha dado su consentimiento informado para ser filmado y es consciente de que la información y las imágenes se publicarán en línea.
References
- McGuigan A, Kelly P, Turkington RC, Jones C, Coleman HG, McCain RS. Cáncer de páncreas: una revisión del diagnóstico clínico, la epidemiología, el tratamiento y los resultados. Mundo J Gastroenterol. 2018;24(43):4846-4861. doi:10.3748/wjg.v24.i43.4846.
- Cameron JK, Cameron AM. Terapia quirúrgica actual. 10ª ed. Filadelfia: Elsevier Mosby; 2011.
- Oba A, Ho F, Bao QR, Al-Musawi MH, Schulick RD, Del Chiaro M. Tratamiento neoadyuvante en el cáncer de páncreas. Fronteras en oncología. 2020;10(245). doi:10.3389/fonc.2020.00245.
- Ghaneh P, Palmer DH, Cicconi S, et.al. ESPAC-5F: ensayo aleatorizado internacional de fase II prospectivo, multicéntrico, de cuatro brazos de cirugía inmediata en comparación con gemcitabina neoadyuvante más capecitabina (GEMCAP) o FOLFIRINOX o quimiorradioterapia (TRC) en pacientes con cáncer de páncreas resecable limítrofe. J Clin Oncol. 2020;38(15)4505. doi:10.1200/JCO.2020.38.15_suppl.4505.
- Muller PC, Frey MC, Ruzza CM, et al. Quimioterapia neoadyuvante en el cáncer de páncreas: una evaluación de la evidencia actual de alto nivel. Farmacología. 2021;106:143-153. doi:10.1159/000510343.
- Versteijne E, Suker M, Groothuis K, et. al. Quimiorradioterapia preoperatoria versus cirugía inmediata para el cáncer de páncreas resecable y limítrofe resecable: resultados del ensayo aleatorizado holandés de fase III PREOPANC. J Clin Oncol. 2020;38(16):1763-1773. doi:10.1200/JCO.19.02274.
- Warshaw AL. Pancreatectomía distal con preservación del bazo. J Hepatobiliary Pancreat Sci. 2010;17:818-812. doi:10.1007/s00534-009-0226-z.
- Lillemoe KD, Kaushal S, Cameron JL, Sohn TA, Pitt HA, Yeo CJ. Pancreatectomía distal: indicaciones y resultados en 235 pacientes. Ann Surg. 1999;229(5):693. doi:10.1097/00000658-199905000-00012.
- De Brujin KMJ, van Eijck CHJ. Diabetes de nueva aparición después de la pancreatectomía distal: una revisión sistemática. Ann Surg. 2015;216(5):854-61. doi:10.1097/SLA.0000000000000819.
- Kong M, Hong SE, Choi WS, Kim SY, Choi J. Quimiorradioterapia concurrente preoperatoria para el cáncer rectal localmente avanzado: resultados del tratamiento y análisis de factores pronósticos. Cancer Res Treat. 2012;44(2):104-112. doi:10.4143/crt.2012.44.2.104.
- Ríos Pérez MV, Dai B, Koay EJ, Wolff RA, Fleming JB. Regresión del cáncer de páncreas en estadio IV a cirugía curativa e Iintroducción de un nuevo ensayo de quimiosensibilidad ex vivo. Cureus. 2015;7(12):e423. doi:10.7759/cureus.423.
- Hank T, Sandini M, Ferrone CR, et al. Asociación entre la fístula pancreática y la supervivencia a largo plazo en la era de la quimioterapia neoadyuvante. JAMA Surg. 2019;154(10):943-951. doi:10.1001/jamasurg.2019.2272.
- Kuwatani M, Nakamura T, Hayashi T, et. al. Resultados clínicos del drenaje biliar durante un tratamiento neoadyuvante para el cáncer de páncreas: stents metálicos versus plásticos. Intestino Hígado. 2020;14(2):269-273. doi:10.5009/gnl18573.
- Riviere D, Gurusamy KS, Kooby DA, Vollmer CM, Besselink MGH, Davidson BR, van Laarhoven CJHM. Pancreatectomía distal laparoscópica versus abierta para el cáncer de páncreas. Base de Datos Cochrane de Revisiones Sistemáticas. 2016;4(CD011391). doi:10.1002/14651858.CD011391.pub2.
- De Rooij T, van Hilst J, van Santvoort H, et.al. Pancreatectomía distal mínimamente invasiva versus abierta (LEOPARD): un ensayo controlado aleatorio multicéntrico ciego por paciente. Ann Surg. 2019;269(1):2-9. doi:10.1097/SLA.0000000000002979.
- Bjornsson B, Sandstrom P, Larsson AL, Hjalmarsson C, Gasslander T. Pancreatectomía distal laparoscópica versus abierta (LAPOP): protocolo de estudio para un ensayo controlado aleatorio, no ciego y de un solo centro. Ensayos. 2019;20(356). doi:10.1186/s13063-019-3460-y.
Cite this article
Hennessy ML, Fernandez-del Castillo C. Pancreatectomía distal abierta para el cáncer de páncreas. J Med Insight. 2022;2022(339). doi:10.24296/jomi/339.

