Pharmacologie pour la gestion des voies respiratoires par intubation rapide (IRS) chez les patients traumatisés
Main Text
Table of Contents
L’enquête primaire de chaque patient traumatisé commence par ABC : voies respiratoires, respiration, circulation. Si le patient est jugé nécessaire pour une prise en charge des voies respiratoires, une intubation endotrachéale peut être réalisée à l’aide de l’intubation à séquence rapide (RSI). Dans les TMS, un agent d’induction et un agent neuromusculaire bloquant à action rapide (NMBA ou paralytique) sont administrés et l’intubation est effectuée dès que l’inconscience et la paralysie sont atteintes. 1 Les patients traumatisés peuvent nécessiter une intubation pour un certain nombre de raisons (tableau 1), y compris, mais sans s’y limiter, l’hypoxie, l’hypoventilation, le risque de détérioration de l’état clinique ou l’incapacité à maintenir ou à protéger les voies respiratoires en raison d’un état mental altéré ou d’une blessure à la tête ou au cou. 2 Historiquement, les TMS étaient décrits comme une série de « sept p » : (1) préparation, (2) préoxygénation, (3) prétraitement, (4) paralysie avec induction, (5) protection et positionnement, (6) placement du tube dans la trachée et (7) prise en charge post-intubation. 3 Pour cette revue, nous nous concentrerons sur la pharmacologie, la posologie et d’autres considérations relatives à l’utilisation de médicaments courants pour le prétraitement, la paralysie avec induction et la gestion post-intubation chez les patients traumatisés.
Au cours de l’intubation endotrachéale, il peut y avoir une stimulation des nerfs sympathiques et parasympathiques dans les voies respiratoires. La stimulation sympathique peut entraîner une augmentation de la fréquence cardiaque allant jusqu’à 30 battements par minute et une augmentation de la pression artérielle moyenne (MAP) d’environ 25 à 50 mmHg, ce qui peut contribuer à l’augmentation de la pression intracrânienne (PIC). 4 À l’inverse, les patients pédiatriques peuvent développer une bradycardie à cause d’une stimulation parasympathique due à une hypoxie ou d’une stimulation vagale directe à partir de la manipulation du laryngopharynx pendant l’intubation. 5 De plus, l’acte physique de placer la sonde endotrachéale stimule également les réflexes des voies respiratoires supérieures, entraînant une toux, un laryngospasme et un bronchospasme des voies respiratoires inférieures, ce qui peut également contribuer à l’augmentation de la PIC. 3 L’objectif du prétraitement est d’atténuer ces réponses physiologiques.
Le fentanyl peut être utilisé pour atténuer la réponse sympathique à l’intubation. Envisagez un prétraitement au fentanyl pour les patients qui sont les plus à risque de subir des dommages en raison d’une fréquence cardiaque, d’une pression artérielle ou d’une PIC élevées. Ces patients peuvent inclure des patients présentant une augmentation de la PIC (avec ou sans hémorragie intracrânienne), un anévrisme cérébral ou aortique connu ou suspecté, ou une dissection vasculaire majeure. 3 Évitez le prétraitement au fentanyl chez les patients qui dépendent de la pulsion sympathique pour maintenir leur débit cardiaque, tels que ceux qui sont en choc décompensé ou qui sont hémodynamiquement instables. Le début de l’action du fentanyl est presque instantané et la durée d’action est d’environ 30 à 60 minutes. 6 Le fentanyl doit être administré environ trois minutes avant l’agent d’induction à une dose de 1 à 3 mcg/kg IV. La dose de prétraitement doit être administrée sur une période de 30 à 60 secondes pour éviter une dépression respiratoire précipitée. Des doses plus élevées (5 à 10 mcg/kg) de fentanyl ont été impliquées dans l’hypotension excessive, l’apnée et la rigidité de la paroi thoracique. 4
Le terme « instabilité hémodynamique » est utilisé dans la littérature sans consensus général. Différents auteurs utilisent des critères différents pour définir l’instabilité hémodynamique. Ces critères comprennent le plus souvent des troubles de la fréquence cardiaque, de la pression artérielle systolique et de la fréquence respiratoire. Les seuils varient également, les chiffres moyens étant de >103 bpm, <96 mmHg et <34 respirations par minute. 47
L’atropine peut être utilisée comme prémédication chez les patients qui sont bradycardiques avant l’intubation ou qui risquent de devenir bradycardiques pendant l’intubation en raison d’une stimulation vagale ou de l’utilisation de succinylcholine. La succinylcholine a le potentiel de provoquer ou d’aggraver la bradycardie en raison de son action sur les récepteurs muscariniques. L’incidence et la gravité de cette bradycardie sont plus fréquentes chez les enfants que chez les adultes. 7 Les lignes directrices de l’EPLA de 2020 indiquent qu’il « peut être raisonnable » d’utiliser l’atropine comme prémédication pour l’intubation afin de prévenir la bradycardie chez les patients à haut risque, tels que ceux de moins d’un an ou ceux recevant de la succinylcholine. 8 Envisager l’administration d’atropine chez les patients adultes et adolescents recevant une deuxième dose de succinylcholine. La dose d’atropine pour prévenir la bradycardie est de 0,02 mg/kg (dose maximale de 0,5 mg). 8, 9 Les effets de l’atropine sur la fréquence cardiaque sont presque immédiats lorsqu’elle est administrée par voie intraveineuse et persistent jusqu’à quatre minutes. 10
La lidocaïne a été utilisée pour atténuer la réponse de la toux à l’intubation et son effet sur l’hémodynamique et l’ICU. 3, 4 L’importance de l’effet est inconnue – aucune étude n’a été publiée évaluant les effets de la lidocaïne et de l’intubation sur la PIC ou les résultats centrés sur le patient. 11 Une étude n’a révélé aucune différence dans l’hémodynamique chez les patients atteints de lésions cérébrales traumatiques graves (TCC), qu’ils aient reçu de la lidocaïne par voie intraveineuse ou non avant l’intubation. 12 À l’heure actuelle, le prétraitement à la lidocaïne n’est pas recommandé. 11, 13 Si la lidocaïne est utilisée pour le prétraitement, la dose typique est de 1,5 mg/kg administrée trois minutes avant l’induction. 3 À cette dose, le début d’action de la lidocaïne est inférieur à une minute et la durée d’action est de 10 à 20 minutes. La lidocaïne est métabolisée par le foie et sa durée peut être doublée chez les patients présentant un dysfonctionnement hépatique important.
L’objectif de l’induction est d’endormir rapidement le patient jusqu’à un état d’anesthésie générale, permettant l’administration de paralysants et facilitant les conditions d’une intubation idéale. L’agent d’induction optimal a un début de sédation doux et rapide tout en procurant une amnésie et une analgésie. Cet agent idéal serait hémodynamiquement neutre, immédiatement réversible et aurait des effets indésirables minimes. 1 Bien qu’il n’existe pas à lui seul un agent qui englobe toutes ces qualités, des facteurs spécifiques au patient déterminent le choix de l’agent d’induction le plus approprié au scénario clinique. Un registre de 2016 des intubations dans les services d’urgence universitaires aux États-Unis a révélé que l’étomidate était l’agent d’induction le plus couramment utilisé pour les TMS, suivi de la kétamine puis du propofol. 14
L’étomidate est un agent hypnotique non barbiturique qui fournit une sédation rapide sans analgésie en renforçant les effets du GABA. La popularité de l’étomidate peut être attribuée à son profil hémodynamique stable et à son potentiel de réduction de l’ICP, ainsi qu’à ses effets pharmacocinétiques et pharmacodynamiques fiables. 3, 4 Cependant, des doses uniques d’étomidate sont associées à une suppression surrénalienne.
La signification clinique de cela au-delà de la septicémie a été débattue, mais une étude comparant l’étomidate à la kétamine pour l’induction chez les patients traumatisés n’a pas trouvé de différence dans les taux de mortalité, les jours sans unité de soins intensifs (USI) ou les jours sans ventilateur. 15 Les cliniciens doivent peser les avantages de l’induction rapide et de la stabilité hémodynamique fournies par l’étomidate par rapport aux risques potentiels de suppression surrénalienne. Des agents alternatifs comme la kétamine ou le propofol peuvent être envisagés, en particulier chez les patients présentant un risque plus élevé d’insuffisance surrénale (par exemple, ceux souffrant de septicémie ou de maladie chronique). Bien que l’étomidate reste un agent précieux, son utilisation nécessite une réflexion approfondie. Une approche équilibrée, éclairée par l’état du patient, est cruciale. 46
L’un des avantages distincts de l’étomidate par rapport aux autres agents d’induction est qu’il ne s’agit pas d’une substance contrôlée et qu’il ne nécessite donc pas de documentation supplémentaire lors du stockage ou du gaspillage de médicaments non utilisés. La dose d’étomidate pour les TMS est de 0,3 mg/kg. Le début de l’action est inférieur à une minute et la durée de l’action est de trois à cinq minutes. 16
L’utilisation de la kétamine pour l’induction a gagné en popularité en raison de son profil hémodynamique favorable et en réponse à l’inquiétude concernant la suppression surrénalienne avec l’étomidate. La kétamine est un antagoniste des récepteurs NMDA qui fournit une sédation, une analgésie et une amnésie rapides. Il est intéressant de noter que la kétamine a des effets sympathomimétiques indirects en inhibant la recapture des catécholamines endogènes, ce qui entraîne une augmentation de la fréquence cardiaque et de la pression artérielle. Cependant , la kétamine a également des effets dépresseurs myocardiques directs qui peuvent être plus prononcés chez les patients épuisés en catécholamines. Bien que l’on craigne que la dépression myocardique puisse l’emporter sur les effets sympathomimétiques chez les patients gravement atteints de fosse septique, cette constatation n’a pas persisté lorsqu’on examine spécifiquement l’utilisation de la kétamine pour les TMS chez les patients traumatisés. 15, 17 Historiquement, la kétamine était évitée chez les patients présentant une pression intraoculaire (PIO) ou une PIC. Cependant, les données actuelles suggèrent que la kétamine n’augmente pas la PIC chez les patients atteints d’un traumatisme crânien sévère qui sont sous sédation et ventilés (niveau 2b d’Oxford, GRADE C). En fait, il peut même réduire l’ICP dans certains cas. 46 La dose d’induction de kétamine est de 1 à 2 mg/kg avec un début d’environ 30 secondes et une durée de sédation dose-dépendante de cinq à dix minutes. 18 Il convient de noter que l’administration rapide de kétamine en moins de 60 secondes peut entraîner une apnée, de sorte qu’il est impératif de choisir son moment tout en facilitant l’intubation.
Les agents moins courants pour l’induction des TMS comprennent le propofol et le midazolam. Le propofol est un agoniste du GABA hautement soluble dans les lipides avec un début rapide de sédation. 1 Cependant, les doses bolus de propofol diminuent la PMA via des réductions de la précharge, de la postcharge et une diminution de la contractilité. 3 Ces caractéristiques contribuent à la capacité du propofol à diminuer la PIC, de sorte que le propofol peut être une option raisonnable chez les patients hémodynamiquement stables ou hypertendus avec une IC élevée. Par rapport à l’induction sans propofol (étomidate ou midazolam), une étude a révélé qu’après ajustement pour l’âge, le score de gravité de la blessure et l’hypotension pré-RSI, le propofol était près de quatre fois plus susceptible de provoquer une hypotension post-intubation chez les patients traumatisés. Alors que le propofol est formulé dans une émulsion avec de l’huile de soja et de la lécithine d’œuf, l’American Academy of Allergy Asthma & Immunology déclare que les patients allergiques au soja ou aux œufs peuvent recevoir du propofol sans aucune précaution particulière. 20 La dose de propofol pour l’induction est de 1,5 à 2,5 mg/kg, avec des réductions de dose pour les patients hémodynamiquement instables. 1, 3Le midazolam est rarement utilisé comme seul agent d’induction pour les TMS en raison de son début d’action plus lent (jusqu’à cinq minutes) et de son niveau de sédation peu fiable. 1 Le temps d’action peut être porté à 90 secondes avec l’administration concomitante de fentanyl. La dose d’induction du midazolam est de 0,2 à 0,3 mg/kg. 1, 3 Les prestataires peuvent ne pas être familiers et mal à l’aise avec l’administration de fortes doses de midazolam et peuvent avoir besoin de s’assurer que ces doses sont indiquées pour fournir le niveau de sédation nécessaire pour fournir l’amnésie et optimiser les conditions d’intubation. Le midazolam présente une diminution dose-dépendante de la résistance vasculaire systémique et de la dépression myocardique et doit être utilisé avec prudence chez les patients présentant une instabilité hémodynamique. 1 L’utilisation du midazolam pour l’induction doit être réservée aux patients présentant des indications spécifiques (convulsions) ou lorsque d’autres agents ne sont pas disponibles en raison d’une pénurie de médicaments.
La succinylcholine, un agent de blocage neuromusculaire dépolarisant, a un début rapide et une courte durée d’action. Ces propriétés le rendent idéal pour une utilisation dans les TMS pour les patients traumatisés. Il permet une évaluation précise des niveaux de sédation post-intubation et est particulièrement idéal si l’on craint que les voies respiratoires ne soient difficiles ou si une évaluation neurologique précise est nécessaire peu de temps après l’intubation. À une dose de 1,5 mg/kg, il apparaît en 45 secondes et dure de 6 à 10 minutes. 21
Cependant, il existe plusieurs considérations qui peuvent limiter l’utilisation chez des patients spécifiques. Tout d’abord, la succinylcholine est contre-indiquée chez les patients ayant des antécédents personnels ou familiaux d’hyperthermie maligne. 7 Deuxièmement, la succinylcholine peut provoquer une hyperkaliémie profonde chez certains patients, entraînant des arythmies ventriculaires et un arrêt cardiaque. Chez la plupart des patients, la succinylcholine provoquera une augmentation moyenne de 0,3 à 1 mEq/L de la kaliémie. 1, 22 Cependant, chez les patients prédisposés à l’hyperkaliémie, cette augmentation peut être de 5 à 10 mEq/L, ce qui peut provoquer des arythmies ventriculaires et un arrêt cardiaque. 21, 23 Ainsi, la succinylcholine doit également être évitée chez les patients atteints d’hyperkaliémie symptomatique, d’insuffisance rénale terminale, de rhabdomyolyse ou de toute maladie entraînant une dénervation étendue du muscle squelettique (par exemple, sclérose en plaques, dystrophie musculaire). 1 Le risque d’hyperkaliémie profonde induite par la succinylcholine en cas de blessure par écrasement, de blessure par dénervation ou de brûlure se développe après la phase aiguë (environ 3 à 5 jours après la blessure ou 7 à 10 jours après la brûlure), de sorte qu’il est sûr d’utiliser la succinylcholine chez un patient par ailleurs en bonne santé pendant les 24 à 48 premières heures de blessures aiguës par écrasement ou brûlures. Il existe également une mise en garde encadrée pour une rhabdomyolyse aiguë et un arrêt cardiaque lorsque la succinylcholine est utilisée chez des patients pédiatriques qui présentent par la suite une myopathie des muscles squelettiques (c’est-à-dire la dystrophie musculaire de Duchenne). Certains centres évitent complètement la succinylcholine chez les patients pédiatriques pour éviter ce risque, bien que la plupart envisagent toujours son utilisation pour les intubations urgentes chez des patients par ailleurs en bonne santé. Enfin, une étude rétrospective menée dans un centre de traumatologie a révélé une association entre l’utilisation de la succinylcholine et l’augmentation de la mortalité chez les patients atteints de traumatisme crânien grave, bien que d’autres aient recommandé l’utilisation de la succinylcholine dans les traumatismes crâniens lorsqu’il n’existe pas de contre-indications. 13
Dans le contexte d’un RSI modifié, le rocuronium apparaît comme la seule alternative. Il convient de noter que la dose requise pour cette application est d’environ le double de la dose d’induction standard du rocuronium.
Le rocuronium, un agent de blocage neuromusculaire non dépolarisant aminostéroïde, commence environ 1 à 2 minutes à des doses de 1 mg/kg. 25, 26 Des doses plus élevées de ≥1,4 mg/kg ont été associées à une amélioration du succès de la première tentative avec la laryngoscopie directe chez les patients hypotendus âgés de ≥ 14 ans dans une étude du National Emergency Airway Registry. 27 La durée du rocuronium dépend de la dose et de la fonction hépatique. Aux doses habituelles d’intubation, la durée est d’environ 40 à 90 minutes, mais peut durer jusqu’à 120 minutes ou plus chez certains patients. 25 Contrairement à la succinylcholine, le rocuronium n’a qu’une seule contre-indication : des antécédents d’anaphylaxie au rocuronium ou à d’autres NMBA. Ainsi, il est souvent choisi chez le patient traumatisé lorsque les antécédents médicaux sont inconnus ou que les valeurs de laboratoire n’ont pas encore résulté.
Deux inconvénients principaux du rocuronium existent pour les patients traumatisés, tous deux en raison de sa durée d’action nettement plus longue. Comme nous le verrons dans le cadre de la sédation post-intubation, des doses inadéquates ou un début retardé de l’analgosédation sont plus susceptibles de se produire. 28, 29 La paralysie prolongée inhibe également la capacité d’obtenir un examen neurologique. Il existe des agents d’inversion du rocuronium, mais ceux-ci comportent également des risques. La néostigmine, un inhibiteur de la cholinestérase, peut être administrée une fois que le patient a récupéré une partie de la fonction neuromusculaire (c’est-à-dire un train de quatre d’au moins 2 sur 4). 30 Un agent anticholinergique, tel que l’atropine ou le glycopyrrolate, est administré simultanément pour réduire le risque de bradycardie due à l’activation des récepteurs muscariniques. 21 Le sugammadex est une nouvelle cyclodextrine qui se lie au rocuronium ou au vecuronium dans le plasma, réduisant ainsi la quantité efficace de NMBA disponible pour lier les récepteurs de l’acétylcholine à la jonction neuromusculaire. Le sugammadex a l’avantage de pouvoir inverser n’importe quel degré de blocage neuromusculaire, y compris un bloc profond. L’utilisation du complexe sugammadex-rocuronium est clairance rénale et n’est pas recommandée chez les patients dont la clairance de la créatinine est de < 30 mL/min en raison de l’élimination prolongée et du risque potentiel de paralysie de rebond. 31 Le sugammadex a également été associé à l’anaphylaxie, à la bradycardie et à l’arrêt cardiaque, de sorte que la prudence est de mise. Le sugammadex lie et réduit également l’efficacité de la contraception hormonale orale ou non orale pendant 7 jours après l’utilisation, nécessitant une méthode de contraception de secours. 31
Deux autres agents non dépolarisants ne sont pas couramment utilisés pour les TMS en raison de leurs propriétés pharmacocinétiques. Le vecuronium, un aminostéroïde, a un début de 2 à 3 minutes et une durée de 60 à 80 minutes à une dose standard de 0,08 à 0,1 mg / kg. 32 De plus, le vecuronium est fourni sous forme de poudre nécessitant une reconstitution, ce qui ajoute une autre étape au processus de préparation des médicaments dans le cadre d’une intubation urgente. Le cisatracurium est un NMBA non dépolarisant au benzylisoquinolinium dont l’apparition est de 2 à 3 minutes et d’une durée de 55 à 80 minutes à une dose d’intubation de 0,15 mg/kg, et qui ne peut pas être inversé à l’aide du sugammadex. 33 Il a un métabolisme indépendant de l’organe via l’élimination de Hofmann. Les deux agents pourraient être considérés comme des alternatives en cas de pénurie de rocuronium, en gardant à l’esprit l’apparition plus lente.
Une fois que le patient a été intubé, il est impératif que nous fournissions une analgésie et une sédation adéquates pour la sécurité et le confort de nos patients. En raison de la durée d’action plus courte de la succinylcholine, nous pouvons évaluer avec précision le niveau de douleur et de sédation d’un patient relativement rapidement après l’intubation. Cependant, si l’on utilise le rocuronium pour les TMS, l’inadéquation de la durée de l’agent d’induction par rapport au paralytique a été associée à une sédation retardée ou inadéquate, ce qui expose le patient à un risque de paralysie. 26, 27 Dans une étude récente, il a été déterminé que 2,6 % des patients intubés au service des urgences souffraient de paralysie, et ce risque s’est avéré significativement plus élevé avec le rocuronium qu’avec la succinylcholine. 34
Les directives PADIS 2018 recommandent l’analgosédation basée sur un protocole pour la gestion de la douleur et de l’agitation, où un agent analgésique (généralement un opioïde) est utilisé soit avant un sédatif, soit à la place d’un sédatif. 35 Étant donné que les patients en traumatologie sont susceptibles d’avoir des blessures douloureuses, cette approche est prudente. De plus, le patient peut bénéficier des effets amnésiques d’un agent sédatif.
Il existe de multiples stratégies d’analgosédation, mais les opiacés restent le pilier du traitement. Le fentanyl est souvent choisi en raison de son action rapide, de ses effets hémodynamiques neutres et de sa courte durée lorsqu’il est administré en bolus unique. Avec des doses répétées ou une perfusion continue, le fentanyl présentera une pharmacocinétique modèle à deux compartiments, entraînant une durée d’action prolongée, en particulier chez les patients souffrant d’insuffisance cardiaque, de maladie du foie ou de poids plus important. 36 L’administration d’une dose initiale de bolus suivie d’une perfusion continue permet des titrages plus rapides et donne la possibilité d’administrer d’autres doses de bolus via la pompe à perfusion. C’est idéal à la fois pour des raisons de sécurité et pour réduire la nécessité pour une infirmière ou un pharmacien de retourner à l’armoire de distribution automatisée à plusieurs reprises pendant le reste de l’évaluation du traumatisme et des études d’imagerie. Les perfusions de fentanyl sont généralement disponibles sous forme de perfusions continues prémélangées, et peuvent donc être plus rapidement accessibles au service des urgences par rapport aux autres perfusions d’opiacés.
Si la succinylcholine est utilisée pour les TMS, les évaluations de suivi du niveau de douleur et de sédation à l’aide d’échelles standard peuvent guider la décision d’augmenter la dose de fentanyl ou d’ajouter un agent sédatif. 37, 38 Cependant, si le rocuronium est utilisé et n’est pas inversé, ces échelles ne sont pas des évaluations valides de la douleur et de la sédation. Par conséquent, il est important d’utiliser l’information provenant de la présentation initiale du patient pour déterminer si un agent sédatif doit être commencé empiriquement en plus du fentanyl. Par exemple, chez un patient initialement agité et intoxiqué par de la méthamphétamine ou de l’éthanol, le propofol ou une benzodiazépine procurera un effet pharmacologique désiré pour lutter contre l’intoxication.
Les directives PADIS de 2018 suggèrent l’utilisation du propofol ou de la dexmédétomidine en perfusion continue plutôt que des benzodiazépines pour la sédation des patients sous ventilation mécanique en raison de la diminution de la durée du séjour en soins intensifs, de la durée de la ventilation mécanique et du délire. 35 Lorsqu’il est administré en perfusion continue, le propofol a une sédation rapide et de courte durée, ce qui est idéal lorsque des interruptions sont nécessaires pour évaluer l’état mental d’un patient. Le propofol peut être neuroprotecteur chez les patients sous sédation atteints de TCC en raison de ses propriétés antioxydantes inhérentes ainsi que de son potentiel à réduire la consommation d’oxygène cérébral et la PIC. 39, 40 Bien que l’hypotension soit un effet secondaire connu du propofol, elle peut être profonde. Une étude a révélé qu’une diminution de la TAS d’environ 30 mmHg était plus probable chez les patients traumatisés de plus de 55 ans, obèses et ceux ayant une TAS de base plus faible. 41 Envisagez une dose initiale de perfusion de propofol plus faible et l’utilisation d’un poids corporel idéal pour ces patients. L’hypotension peut être atténuée à l’aide de vasopresseurs à dose poussée ou à perfusion continue, en plus de la réanimation induite par ATLS avec des liquides et des produits sanguins.
La dexmédétomidine est un autre agent sédatif courant, un agoniste alpha-2 avec des propriétés d’épargne des opiacés, et est un agent privilégié pour la sédation en soins intensifs. 35 Cependant, la dexmédétomidine est moins idéale dans la période post-intubation immédiate chez un patient traumatisé, car elle a un début d’action plus long et ne fournit pas un niveau de sédation assez profond pour un patient qui reste sous les effets d’un NMBA à action prolongée.
Le propofol et la dexmédétomidine ont tous deux été impliqués dans l’hypotension et la bradycardie. Une étude comparant le propofol à la dexmédétomidine à dose standard (≤0,7 mcg/kg/h) et à forte dose (>0,7 mcg/kg/h) dans l’unité de soins intensifs de traumatologie a révélé que les perfusions de dexmédétomidine à forte dose étaient associées à une augmentation de la durée de séjour en soins intensifs, à des taux plus élevés d’hypotension et à une utilisation accrue d’analgésiques, de sédatifs et d’antipsychotiques. 42, 43 Plus précisément, chez les patients TCC, Pajoumand et ses collègues ont montré que les patients recevant de la dexmédétomidine en monothérapie avaient une PIC maximale moyenne plus élevée au cours des deux premiers jours de l’admission par rapport à la dexmédétomidine-propofol ou au propofol en monothérapie, malgré un temps plus long au niveau de sédation cible. 42 Cependant, une étude plus récente a révélé qu’avec une utilisation prolongée dans l’unité de soins intensifs, les patients recevant de la dexmédétomidine passaient beaucoup plus de temps à leur niveau cible de sédation par rapport au propofol, bien que les deux groupes aient été à la cible >90 % du temps. 43 Le propofol, en plus d’une analgésie adéquate, peut être un sédatif plus souhaitable au début du traitement du patient traumatisé, en particulier ceux nécessitant une prise en charge de la PIC.
Une alternative pour la sédation immédiate chez le patient souffrant d’un traumatisme hypotensif est le midazolam. Le midazolam est une benzodiazépine à courte durée d’action avec un début IV dans les 3 à 5 minutes et un effet maximal à 30 à 60 minutes chez l’adulte et 15 à 30 minutes en pédiatrie. 44 Il a des effets hémodynamiques relativement neutres. Une stratégie courante consiste à administrer le midazolam sous forme de bolus intermittents pendant l’enquête de traumatologie et les études d’imagerie, et à passer à un agent sédatif par perfusion continue préféré après le transfert à l’unité de soins intensifs. 45
Il existe de nombreuses options médicamenteuses pour le prétraitement des TMS, l’induction, la paralysie et la sédation post-intubation. Le choix des agents pour le patient traumatisé dépendra des lésions présentées, des antécédents médicaux disponibles, du profil hémodynamique et de la stratégie souhaitée. Si un NMBA à action prolongée est choisi pour les TMS et qu’il n’est pas inversé, il est important de commencer l’analgosédation empirique pour éviter la prise de conscience avec paralysie.
Tableau 1. Indications d’intubation trachéale d’urgence2
Niveau 1
-
- Indiqué chez les patients traumatisés présentant les caractéristiques suivantes :
- Obstruction des voies respiratoires
- Hypoventilation
- Hypoxémie persistante (SaO2 </ 90 %) malgré le supplément O2
- Troubles cognitifs sévères (GCS </8)
- Choc hémorragique sévère
- Arrêt cardiaque
- Indiqué pour les patients présentant une inhalation de fumée et l’une des caractéristiques suivantes :
- Obstruction des voies respiratoires
- Troubles cognitifs sévères (GCS </8)
- Brûlure cutanée importante (>/ 40 %)
- Brûlures importantes et/ou inhalation de fumée avec un temps de transport prolongé prévu vers les soins définitifs, et
- Obstruction imminente des voies respiratoires comme suit :
- Brûlure faciale modérée à sévère
- Brûlure de l’oropharynx modérée à grave ;
- Lésion modérée à sévère des voies respiratoires observée à l’endoscopie.
- Indiqué chez les patients traumatisés présentant les caractéristiques suivantes :
Niveau 2 – Aucune recommandation
Niveau 3
-
- L’intubation peut être indiquée chez les patients traumatisés présentant l’une des caractéristiques suivantes :
- Blessure au visage ou au cou avec possibilité d’obstruction des voies respiratoires.
- Troubles cognitifs modérés (score GCS >9-12).
- Combativité persistante réfractaire aux agents pharmacologiques.
- Détresse respiratoire (sans hypoxie ni hypoventilation).
- L’intubation peut être indiquée chez les patients traumatisés présentant l’une des caractéristiques suivantes :
Tableau 2. Propriétés des médicaments utilisés pour le prétraitement, l’induction, la paralysie et la sédation post-intubation
| Nom | Dose | Dose habituelle (adulte) | Début de l’action | Durée de l’action | Perles | Contre-indications/Avertissements |
| Fentanyl (prétraitement) |
1 à 3 mcg/kg |
100 à 200 mcg |
Rapide | 30 à 60 minutes | Envisagé pour les patients incapables de tolérer une poussée sympathique | Administrer > 30 à 60 secondes pour éviter l’apnée |
| Atropine | 0,02 mg/kg | 0,5 millimètre | Rapide | 4 minutes |
Patients pédiatriques âgés de <1 an ou recevant de la succinylcholine ; Patients adolescents/adultes bradycardiques avant TMS ou recevant la 2e dose de succinylcholine |
|
| Lidocaïne |
1 à 1,5 mg/kg | 100 mg | <1 minute | De 10 à 20 minutes | Donner 3 minutes avant l’agent d’induction, si le temps le permet | Durée prolongée de la dysfonction hépatique |
| Étomidate | 0,3 mg/kg | 20 mg | <1 minute | 3 à 5 min | Pas une substance contrôlée | Peut brûler à l’administration |
| Kétamine | 1 à 2 mg/kg | 100 à 200 mg | 30 secondes | 5 à 10 min (en fonction de la dose) | Réduire la dose chez les patients épuisés en catécholamines | Administrer >60 sec pour éviter l’apnée |
| Propofol (induction) | 1,5 à 2,5 mg/kg | 100 à 200 mg | Rapide | Durée : 5 minutes | Envisager pour les patients hémodynamiquement stables avec une PIC élevée | Peut brûler à l’administration |
| Midazolam (induction) | 0,2 à 0,3 mg/kg | 15 à 20 mg | jusqu’à 5 min | <2 heures | Co-administrer avec du fentanyl pour réduire le temps d’action | |
| Succinylcholine | 1,5 mg/kg | 100 mg | 45 secondes | 6 à 10 min | Maladies dénervantes musculaires, hyperthermie maligne, hyperkaliémie symptomatique | |
| Rocuronium | 1,2 mg/kg | 80 à 100 mg | 60 secondes | 40 à 90 minutes | Début et durée d’action dépendants de la dose (dose plus élevée = début plus rapide + durée plus longue) | Durée prolongée de la dysfonction hépatique |
| Vécuronium | 0,08 à 0,1 mg/kg | 8 à 10 mg | 2 à 3 minutes | De 60 à 80 minutes | Nécessite une reconstitution | |
| Perfusion de fentanyl (post-intubation) | 25 à 300 μg/h |
Initial : bolus de 50 à 100 mcg + |
Rapide | Prolongée après une perfusion continue | ||
| Perfusion de propofol (post-intubation) | 5 à 50 mcg/kg/min | Initial : 10 à 20 mcg/kg/min | Rapide | 10 à 15 min après une perfusion continue | Envisagez d’utiliser le poids corporel idéal pour les patients obèses | Hypotension |
| Perfusion de dexmédétomidine (post-intubation) | 0,2 à 1,4 mcg/kg/min | Initial : 0,2 à 0,5 mcg/kg/min | 5 à 10 minutes | 60 à 240 min après une perfusion continue | Bradycardie, hypotension | |
| Midazolam (post-intubation) |
IVP : 1 à 5 mg toutes les 30 minutes PRN Perfusion : 1 à 10 mg/h |
Initial : 1 à 5 mg bolus + |
2 à 5 minutes | Prolongée en cas d’obésité ou après une perfusion continue |
Utiliser IVP PRN lorsque cela est possible ; Perfusion associée à une augmentation de la durée de séjour en soins intensifs |
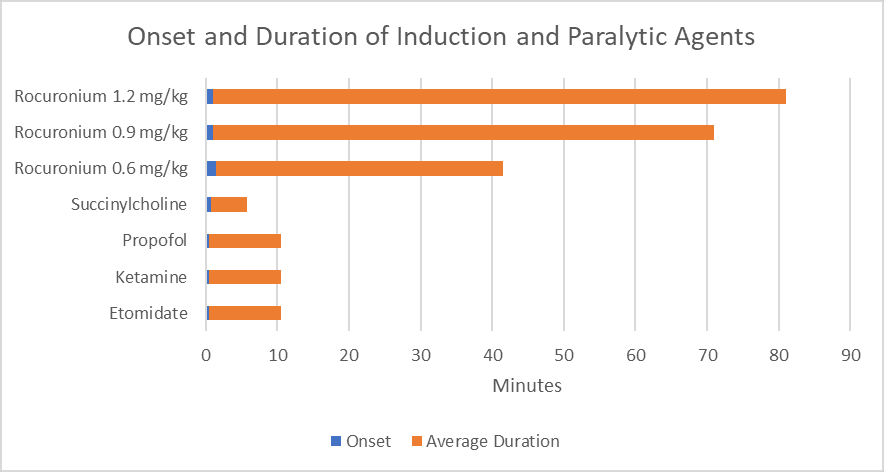 Graphique 1. Début et durée de l’induction et des agents paralysants.
Graphique 1. Début et durée de l’induction et des agents paralysants.
References
- Stollings JL, Diedrich DA, Oyen LJ, Brown DR. Intubation à séquence rapide : un examen du processus et des considérations lors du choix des médicaments. Ann Pharmacother. 2014; 48(1):62-76. doi :10.1177/1060028013510488.
- Shafique MA, Haseeb A, Asghar B, Kumar A, Chaudhry ER, Mustafa MS. Évaluation de l’impact de la gestion préhospitalière des voies respiratoires sur les lésions cérébrales traumatiques graves : une revue systématique et une méta-analyse. Am J Emerg Med. 2024;78:188-195. doi :10.1016/j.ajem.2024.01.030.
- Hampton JP, Hommer K, Musselman M, Bilhimer M. Intubation à séquence rapide et rôle du pharmacien en médecine d’urgence : mise à jour 2022. Am J Health Syst Pharm. 15 février 2023 ; 80(4):182-195. doi :10.1093/ajhp/zxac326.
- Scott JA, Heard SO, Zayaruzny M, Walz JM. Prise en charge des voies respiratoires dans les cas de maladie grave : une mise à jour. Poitrine. 2020; 157(4):877-887. doi :10.1016/j.chest.2019.10.026.
- Kovacich NJ, Nelson AC, McCormick T, Kaucher KA. Incidence de la bradycardie et de l’utilisation de l’atropine dans l’intubation pédiatrique à séquence rapide au service des urgences. Soins pédiatriques Emerg. 2022; 38(2) :E540 à E543. doi :10.1097/PEC.000000000002382.
- Notice d’emballage du citrate de fentanyl. Lake Forest, Illinois : Akorn, Inc. ; 2012.
- Notice d’emballage de chlorure de succinylcholine. Berkeley Heights, NJ : Hikma Pharmaceuticals USA Inc ; 2021.
- Topjian AA, Raymond TT, Atkins D, et al. ; Collaborateurs en réanimation pédiatrique de base et avancée. Partie 4 : Soins de réanimation pédiatriques de base et avancés 2020 Directives de l’American Heart Association pour la réanimation cardio-pulmonaire et les soins cardiovasculaires d’urgence. Pédiatrie. 2021 janv. 147(Suppl 1) :e2020038505D. doi :10.1542/peds.2020-038505D.
- Eisa L, Passi Y, Lerman J, Raczka M, Heard C. De petites doses d’atropine (<0,1 mg) provoquent-elles une bradycardie chez les jeunes enfants ? Arch Dis Enfant. 2015; 100(7):684-688. doi :10.1136/archdischild-2014-307868.
- Huang WC, Yang AS, Tsai DH, Shao SC, Lin SJ, Lai EC. Association entre la charge anticholinergique récemment élevée et le risque d’événements cardiovasculaires aigus : étude cas-cas-temps-contrôle à l’échelle nationale. BMJ. 2023; 382 :e076045. Publié le 27 sept. 2023. doi :10.1136/bmj-2023-076045.
- Engstrom K, Brown CS, Mattson AE, Lyons N, Rech MA. Optimisation de la pharmacothérapie pour l’intubation à séquence rapide dans le service des urgences. Am J Emerg Med. 2023;70:19-29. doi :10.1016/j.ajem.2023.05.004.
- Lin CC, Yu JH, Lin CC, Li WC, Weng YM, Chen SY. Effets hémodynamiques post-intubation de la lidocaïne intraveineuse dans les lésions cérébrales traumatiques graves. Am J Emerg Med. 2012; 30(9):1782-1787. doi :10.1016/j.ajem.2012.02.013.
- Kramer N, Lebowitz D, Walsh M, Ganti L. Intubation à séquence rapide chez les adultes traumatisés crâniens. Cureus. 2018; 10(4) :E2530. Publié le 25 avril 2018. doi :10.7759/cureus.2530.
- April MD, Arana A, Pallin DJ, et al. Succès de l’intubation aux urgences avec la succinylcholine par rapport au rocuronium : une étude du National Emergency Airway Registry. Ann Emerg Med. 2018; 72(6):645-653. doi :10.1016/j.annemergmed.2018.03.042.
- Upchurch CP, Grijalva CG, Russ S, et al. Comparaison de l’étomidate et de la kétamine pour l’induction lors de l’intubation en séquence rapide de patients adultes traumatisés. Ann Emerg Med. 2017; 69(1) :24-33.e2. doi :10.1016/j.annemergmed.2016.08.009.
- Notice d’accompagnement Etomidate. Lake Forest, Illinois : Hospira, Inc. ; 2017.
- Mohr NM, Pape SG, Runde D, Kaji AH, Walls RM, Brown CA III. L’utilisation de l’étomidate est associée à moins d’hypotension que la kétamine pour les intubations de septicémie aux urgences : une étude de cohorte NEAR. Acad Emerg Med. 2020; 27(11):1140-1149. doi :10.1111/acem.14070.
- Notice d’emballage de kétamine. Chestnut Ride, NY : Par Pharmaceutical ; 2017.
- Dietrich SK, Mixon MA, Rogoszewski RJ, et al. Effets hémodynamiques du propofol pour l’induction de l’intubation à séquence rapide chez les patients traumatisés. Am Surg. 2018; 84(9):1504-1508.
- Les patients allergiques au soja et aux œufs peuvent recevoir une anesthésie en toute sécurité. Académie américaine d’allergie, d’asthme et d’immunologie. Mis à jour le 28 septembre 2020. Consulté le 22 avril 2022. Disponible à l’adresse : https://www.aaaai.org/Tools-for-the-Public/Conditions-Library/Allergies/soy-egg-anesthesia.
- Brown, CA et al. (2017) Le manuel Walls de gestion des voies respiratoires d’urgence. Philadelphie : Wolters Kluwer.
- Rogachov A, Kitzerow C, Peterson J, Walker J. Suspicion d’arrêt cardiaque induit par l’hyperkaliémie et récupération après l’utilisation de succinylcholine chez un patient traumatisé. Kans J Med. 2023;16:299-301. Publié le 30 nov. 2023. doi :10.17161/kjm.vol16.21009.
- Strachan J, Frise M. Hyperkaliémie potentiellement mortelle après succinylcholine. Lancet. 2020; 395(10219) :E9. doi :10.1016/S0140-6736(19)32493-6.
- Patanwala AE, Erstad BL, Roe DJ, Sakles JC. La succinylcholine est associée à une mortalité accrue lorsqu’elle est utilisée pour l’intubation en séquence rapide de patients gravement blessés au cerveau dans le service des urgences. Pharmacothérapie. 2016; 36(1):57-63. doi :10.1002/phar.1683.
- Notice d’accompagnement en bromure de rocuronium. Deerfield, Illinois : Baxter Healthcare Corporation ; 2019.
- Vested M, Pape P, Kristensen CM, et al. Rocuronium 0,3 ou 0,9 mg/kg comparant le temps d’apparition, la durée d’action et les conditions d’intubation chez les patients de 80 ans et plus : une étude randomisée. Acta Anaesthesiol Scand. 2022; 66(7):811-817. doi :10.1111/aas.14097.
- Levin NM, Fix ML, April MD, Arana AA, Brown CA 3e ; Enquêteurs de NEAR. L’association entre le dosage du rocuronium et le succès de la première tentative d’intubation chez les patients adultes des services d’urgence. CJEM. 2021; 23(4):518-527. doi :10.1007/s43678-021-00119-6.
- Korinek JD, Thomas RM, Goddard LA, St John AE, Sakles JC, Patanwala AE. Comparaison du rocuronium et de la succinylcholine sur les doses de sédatifs et d’analgésiques post-intubation au service des urgences. Eur J Emerg Med. 2014; 21(3):206-211. doi :10.1097/MEJ.0b013e3283606b89.
- Johnson EG, Meier A, Shirakbari A, Weant K, Baker Justice S. Impact du rocuronium et de la succinylcholine sur l’initiation de la sédation après une intubation en séquence rapide. J Emerg Med. 2015; 49(1):43-49. doi :10.1016/j.jemermed.2014.12.028.
- Notice d’emballage Neostigmine. Princeton, NJ : Dr. Reddy’s Laboratories, Inc. ; 2021.
- Notice d’emballage BRIDION (sugammadex). Whitehouse Station, NJ : Merck Sharp & Dohme Corp ; 2021.
- Notice d’accompagnement au bromure de vecuronium. Lac de Zurich, IL : Fresenius Kabi ; 2019.
- Notice d’accompagnement NIMBEX (bésylate de cisatracurium). North Chicago, Illinois : AbbVie, Inc. ; 2019.
- Pappal RD, Roberts BW, Mohr NM, et al. L’étude ED-AWARENESS : une étude de cohorte observationnelle prospective sur la sensibilisation à la paralysie chez les patients sous ventilation mécanique admis du service d’urgence. Ann Emerg Med. 2021; 77(5):532-544. doi :10.1016/j.annemergmed.2020.10.012.
- Devlin JW, Skrobik Y, Gélinas C, et al. Lignes directrices de pratique clinique pour la prévention et la prise en charge de la douleur, de l’agitation/sédation, du délire, de l’immobilité et des troubles du sommeil chez les patients adultes aux soins intensifs. Crit Care Med. 2018; 46(9) :e825 et e873. doi :10.1097/CCM.000000000003299.
- Choi L, Ferrell BA, Vasilevskis EE, et al. Pharmacocinétique de population du fentanyl chez les personnes gravement malades. Crit Care Med. 2016; 44(1):64-72. doi :10.1097/CCM.000000000001347.
- Mondardini MC, Sperotto F, Daverio M, Amigoni A. Analgésie et sédation chez les patients pédiatriques gravement malades : une mise à jour des directives récentes et du point de vue. Eur J Pediatr. 2023; 182(5):2013-2026. doi :10.1007/s00431-023-04905-5.
- Su JY, Lockwood C, Tsou YC, Mu PF, Liao SC, Chen WC. Mise en œuvre de l’échelle d’agitation-sédation de Richmond dans une unité de soins intensifs respiratoires : un projet de mise en œuvre des meilleures pratiques. JBI Database System Rev Implement Rep. 2019; 17(8):1717-1726. doi :10.11124/JBISRIR-2017-004011.
- Hausburg MA, Banton KL, Roman PE, et al. Effets du propofol sur l’ischémie-reperfusion et les lésions cérébrales traumatiques. J Crit Soins. 2020;56:281-287. doi :10.1016/j.jcrc.2019.12.021.
- Notice d’emballage d’injection de propofol. Lehi, UT : Civica, Inc. ; 2020.
- Shearin AE, Patanwala AE, Tang A, Erstad BL. Prédicteurs de l’hypotension associée au propofol chez les patients traumatisés. J Trauma Nurs. 2014; 21(1):4-8. doi :10.1097/JTN.000000000000022.
- Pajoumand M, Kufera JA, Bonds BW, et al. La dexmédétomidine en tant qu’adjuvant pour la sédation chez les patients atteints de lésions cérébrales traumatiques. J Traumatologie Soins aigus Surg. 2016; 81(2):345-351. doi :10.1097/TA.000000000001069.
- Winings NA, Daley BJ, Bollig RW, et al. La dexmédétomidine par rapport au propofol pour la sédation prolongée chez les patients gravement malades souffrant de traumatismes et de chirurgie. Chirurgien. 2021; 19(3):129-134. doi :10.1016/j.surge.2020.04.003.
- Notice d’emballage pour injection de chlorhydrate de midazolam. Lake Forest, Illinois : Hospira, Inc. ; 2021.
- Acquisto NM, Mosier JM, Bittner EA, et al. Lignes directrices de pratique clinique de la Society of Critical Care Medicine pour l’intubation à séquence rapide chez le patient adulte gravement malade. Crit Care Med. 2023; 51(10):1411-1430. doi :10.1097/CCM.000000000006000.
- Zeiler F.A., Teitelbaum J., West M., Gillman L.M. L’effet de la kétamine sur la PIC dans les lésions cérébrales traumatiques. Soins Neurocrit. 2014; 21(1):163-173. doi :10.1007/s12028-013-9950-y.
- Loggers SAI, Koedam TWA, Giannakopoulos GF, Vandewalle E, Erwteman M, Zuidema WP. Définition de la stabilité hémodynamique chez les patients ayant subi un traumatisme contondant : une revue et une évaluation systématiques parmi les membres de l’équipe néerlandaise de traumatologie. Eur J Trauma Emerg Surg. 2017; 43(6):823-833. doi :10.1007/s00068-016-0744-8.
Cite this article
Ko CL, Celmins L. Pharmacologie pour la gestion des voies respiratoires par intubation séquentielle rapide (RSI) chez les patients traumatisés. J Med Insight. 2024; 2024(299.11). doi :10.24296/jomi/299.11.

