Colectomie gauche ouverte pour le cancer du côlon : résection du côlon gauche et sigmoïde avec formation de colostomie
Main Text
Table of Contents
Une colectomie ouverte est la résection de tout ou partie du côlon, généralement par une incision médiane dans l’abdomen. Cette procédure est souvent indiquée pour le traitement des maladies du côlon telles que l’occlusion intestinale, la diverticulite, les maladies inflammatoires de l’intestin et le cancer du côlon. Dans ce cas, le patient était un homme tétraplégique C6 qui présentait un cancer du côlon près de la flexion splénique. Il souffrait également de dysmotilité colique et de constipation sévère. Il a été traité par une colectomie gauche ouverte par laparotomie médiane supérieure. En ce qui concerne la procédure, une fois l’abdomen pénétré, la cavité péritonéale a été explorée et la tumeur a été identifiée. Le côlon a été mobilisé, en commençant par le côlon transverse, qui a été prolongé latéralement pour réduire la flexion hépatique, suivi d’une mobilisation du côlon droit de manière latérale à médiale. Ensuite, la flexion splénique a été mobilisée, suivie du côlon descendant, encore une fois de manière latérale à médiale. Une fois mobilisé, les marges de transsection ont été identifiées et le mésocôlon intermédiaire a été ligaturé de manière coupée et attachée. Le côlon a ensuite été transecté à l’aide d’une agrafeuse ILA pour inclure le côlon sigmoïde distal transverse, descendant et proximal. Enfin, l’extrémité coupée proximale du côlon transverse a été remontée par une colostomie de l’extrémité gauche. Dans cette vidéo, les étapes clés de la procédure sont démontrées et nous fournissons une analyse de notre prise de décision peropératoire.
Le cancer du côlon est un processus malin impliquant la muqueuse épithéliale du côlon. C’est le troisième cancer le plus fréquent dans le monde, représentant environ 9 % des nouveaux diagnostics de cancer. 1 L’incidence du cancer du côlon est variable géographiquement, ce qui suggère que des facteurs génétiques et liés au mode de vie contribuent au développement de la maladie. L’Afrique de l’Ouest a l’incidence la plus faible, avec un taux de 3 à 4 cas pour 100 000 personnes par an, tandis que l’Amérique du Nord a une incidence annuelle de 26 pour 100 000 personnes. 2 En outre, le cancer du côlon représente la quatrième cause de décès par cancer, avec plus de 700 000 cas par an. 3 Dans l’ensemble, cette affection représente un problème de santé mondial majeur pour les pays développés et en développement.
Les facteurs de risque du cancer du côlon comprennent l’âge, les facteurs environnementaux et la prédisposition génétique. L’âge médian du diagnostic est de 67 ans pour les hommes et de 71 ans pour les femmes. 4 Bien que l’avènement de la coloscopie de dépistage régulière ait contribué à réduire l’incidence des cancers du côlon chez les patients de plus de 50 ans, l’incidence du cancer du côlon a doublé chez les patients plus jeunes, principalement âgés de 40 à 49 ans, au cours des dernières décennies. 5 L’augmentation de l’incidence chez les populations plus jeunes est probablement associée à l’augmentation des taux d’obésité, de mode de vie sédentaire, de régime alimentaire occidental, de syndrome métabolique, ainsi que de consommation d’alcool et de tabac. Ces observations ont été observées de la même manière dans d’autres pays industrialisés. Enfin, des études familiales indiquent que jusqu’à 30 % des cancers du côlon sont liés à une forme héréditaire de maladie, et qu’environ 5 % des cas sont liés à des syndromes de cancer colorectal très pénétrant, notamment la polypose adénomateuse familiale (PAF), le syndrome de Lynch et les affections hamartomateuses. 6
La résection chirurgicale reste le seul traitement curatif du cancer du côlon. Une fois qu’un diagnostic est établi, le plus souvent par coloscopie de dépistage, les patients sont entièrement stadifiés à l’aide du système TNM de l’American Joint Committee on Cancer (AJCC). Pour les patients atteints d’une maladie localisée ou régionale, la colectomie avec un rendement d’au moins 12 ganglions lymphatiques est la norme de soins. La chimiothérapie adjuvante est envisagée chez les patients présentant des caractéristiques à haut risque ou un statut ganglionnaire positif. Enfin, pour les patients présentant une maladie métastatique, la majorité de ces cas sont considérés comme incurables et les patients sont traités par chimiothérapie palliative. La survie au cancer du côlon s’est considérablement améliorée grâce à de meilleures techniques chirurgicales et à de meilleurs régimes de chimiothérapie. Le taux de survie moyen à 5 ans pour la maladie à un stade précoce est supérieur à 90 % ; L’atteinte des ganglions lymphatiques réduit ce chiffre à environ 70 %, et la maladie métastatique est toujours associée à un pronostic sombre, moins de 15 % des patients survivant au-delà de 5 ans. 7
Dans cette vidéo, nous effectuons une colectomie ouverte gauche sur un patient de 65 ans qui présentait une grosse occlusion intestinale secondaire à une tumeur. Dans cette procédure, le côlon est mobilisé bilatéralement, y compris l’élimination des flexions hépatiques et spléniques. Le côlon sigmoïde distal transverse, descendant et proximal est réséqué et une colostomie terminale est créée. Par conséquent, cette procédure réséque de manière adéquate la partie malade du côlon, traitant efficacement cette condition.
Le patient est un homme de 65 ans atteint de tétraplégie après une lésion traumatique de la moelle épinière C6 qui s’est présenté à un hôpital extérieur avec des nausées, des vomissements et une obstipation réapparus. Son bilan comprenait une tomodensitométrie abdominale avec des signes d’obstruction de la masse dans le côlon transverse. Son état clinique était stable et il a été transféré au Massachusetts General Hospital pour des soins supplémentaires. Ses antécédents médicaux sont marqués par une constipation chronique, des ulcères de décubitus récurrents traités par de multiples opérations, y compris une procédure de gaine, et une pyélonéphrite récurrente secondaire à un état de calculs rénaux après une lithotripsie et la mise en place d’une sonde de néphrostomie percutanée du côté gauche. Il a un score de 3 à l’American Society of Anesthesiologist (ASA) et un indice de masse corporelle (IMC) de 25. Étant donné qu’il était obstrué, le patient a été emmené directement au bloc opératoire pour un traitement définitif.
Le patient a subi un examen physique banal. Au bureau, il s’est présenté en fauteuil roulant et n’était pas en détresse apparente avec des signes vitaux normaux. Il avait un habitus normal. Son examen abdominal était significatif pour des cicatrices chirurgicales antérieures, aucun signe de hernie et aucune sensibilité à la palpation. Son abdomen était distendu mais mou.
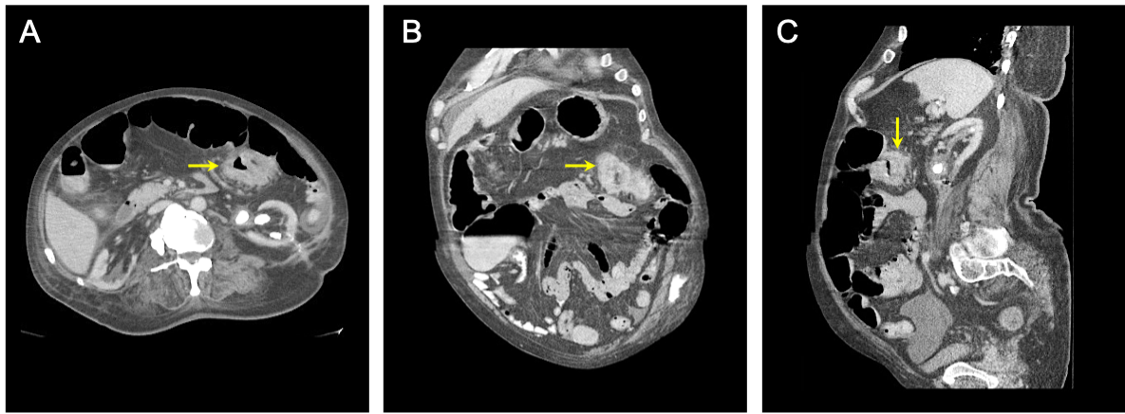
Figure 1 : TDM abdominale et pelvienne. TDM de l’abdomen et du bassin avec contraste intraveineux et oral montrant la présence d’une masse transverse du côlon obstruante. Le tissu malade est représenté en vues axiale A, coronaire et sagittale en A. Des flèches jaunes pointent vers le segment malade du côlon.
De multiples mécanismes pathogènes ont été impliqués dans le développement du cancer du côlon. Pour la majorité des patients, une séquence progressive d’altérations génétiques et épigénétiques de l’épithélium colique conduit au développement de néoplasmes de polypes bénins qui peuvent évoluer vers un carcinome invasif sur une période de plusieurs années, comme initialement décrit par Vogelstein et al.8 Il a été démontré que des altérations génétiques se produisent dans trois mécanismes principaux, notamment l’instabilité chromosomique, l’instabilité des microsatellites et la méthylation de l’îlot CpG. 9 De plus, un sous-ensemble de patients peut développer un cancer du côlon secondaire à une inflammation chronique importante qui peut entraîner des changements dysplasiques sans formation de polypes, généralement chez les personnes atteintes de colite ulcéreuse ou de colite de Crohn. De même, les personnes atteintes du syndrome de Lynch, une maladie germinale entraînant une instabilité des microsatellites, développeront des cancers du côlon sans formation de polypes. Une fois qu’un cancer invasif s’est développé, les cellules malignes envahissent et perturbent les tissus environnants et peuvent se propager à des sites éloignés par invasion lymphatique, périneurale et hématogène.
Pour les patients atteints d’un cancer du côlon localisé, métastatique régional ou certains cas de cancer du côlon oligométastatique, la résection chirurgicale reste le seul traitement curatif potentiel. Néanmoins, le patient doit discuter des risques et des avantages d’une opération avec son chirurgien. La chimiothérapie adjuvante est souvent indiquée pour les maladies présentant des caractéristiques agressives ou une maladie qui s’est propagée aux ganglions lymphatiques ou à des organes distants. Cependant, la chimiothérapie seule ne peut pas guérir cette maladie.
En général, l’objectif de la résection chirurgicale est l’extirpation complète du tissu malin, donc une intention curative.
Il peut y avoir certains cas où le cancer s’est propagé à des sites éloignés bien qu’une complication avec la tumeur primaire se soit produite, y compris un saignement important, une perforation ou une obstruction. Dans ces situations, un chirurgien peut décider d’opérer comme une intervention vitale aiguë sans objectif d’élimination de la maladie. Dans cette vidéo, le patient présentait une complication, une occlusion intestinale, mais heureusement ne présentait aucun signe de maladie métastatique.
Comme nous l’avons montré dans cette vidéo, les principales étapes procédurales de cette opération sont les suivantes : (1) effectuer une laparotomie médiane et examiner la cavité péritonéale, (2) mobiliser le côlon transverse via le retrait du ligament gastrocolique et l’entrée dans le petit sac, (3) démontage de la flexion hépatique et mobilisation latérale à médiale du côlon ascendant, (4) démontage de la flexion splénique et mobilisation latérale à médiale du côlon descendant et sigmoïde, (5) identifier les marges de résection et ligaturer le mésocôlon intermédiaire, (6) transecter le côlon à l’aide d’une agrafeuse ILA 100 et (7) créer une colostomie terminale de manière brooked. Cette approche de la colectomie ouverte entraîne une mobilisation importante de l’ensemble du côlon, ce qui permet une résection importante et une colostomie terminale sans tension sur le côté gauche de l’abdomen. L’artère colique moyenne est préservée, assurant un apport sanguin adéquat au côlon transverse distal restant.
Pour la chirurgie du cancer du côlon, l’étendue de la production ganglionnaire et l’excision mésocolique restent un sujet de débat ouvert. Le Voyer et al. ont précédemment montré que le nombre de ganglions lymphatiques analysés dans les échantillons de cancer du côlon était associé à la survie. 10 Par conséquent, les lignes directrices actuelles recommandent qu’un minimum de 12 ganglions lymphatiques soient réséqués avec l’échantillon de cancer pour une stadification adéquate. La raison pour laquelle un rendement ganglionnaire plus élevé est lié à de meilleurs résultats de survie n’est pas entièrement comprise. On pense que la migration des stades, dans laquelle les cancers sont surclassés avec des rendements ganglionnaires plus élevés à mesure que la probabilité de trouver un ganglion positif augmente, y contribue dans une certaine mesure. 11 Cependant, il a également été proposé qu’une excision mésocolique plus étendue permet une extirpation plus adéquate de la maladie micrométastatique régionale. 12 À l’appui de ce raisonnement, de nombreuses études ont montré que l’excision mésocolique extensive est associée à une amélioration des taux de survie sans maladie et de survie globale chez les patients atteints de cancer du côlon. 13, 14 Dans cette vidéo, le mésocôlon a été prélevé près des décollages vasculaires pour fournir un échantillon mésocolique plus grand.
À l’avenir, il continuera d’y avoir des améliorations dans les traitements non chirurgicaux du cancer du côlon. Avec l’amélioration des taux de coloscopie de dépistage, la détection précoce et la polypectomie endoscopique se sont avérées suffisantes pour le traitement des cancers très précoces, évitant ainsi la nécessité d’une opération chez un sous-ensemble d’individus. 15 Les thérapies systémiques ont également connu une évolution et une amélioration significatives. Des thérapies ciblées nouvellement conçues contre le facteur de croissance de l’endothélium vasculaire (VEGF), le récepteur du facteur de croissance épidermique (EGFR) et les composants de la voie KRAS pourraient avoir apporté des avantages supplémentaires aux schémas de chimiothérapie actuels et font l’objet d’une étude clinique. 16, 17 Enfin, le développement récent de l’immunothérapie pourrait être prometteur pour le sous-ensemble des cancers du côlon définis par l’instabilité des microsatellites. 18
- Temps opératoire : 90 minutes
- Perte de sang estimée : 400 mL
- Fluides : 4600 mL de cristalloïde
- Durée du séjour : sortie de l’hôpital à la maison avec assistance infirmière visiteuse le 9e jour postopératoire
- Morbidité : aucune complication
- Pathologie finale : pT4aN2bM0, 8 ganglions positifs sur 17 ; histologie : peu différenciée avec invasion lymphovasculaire, marges chirurgicales toutes négatives
- Scalpel à 10 lames
- Électrocautérisation
- Pince DeBakey
- Écarteur portatif de la paroi abdominale
- Pince Schnidt
- Attaches en soie 3-0 et 2-0 pour la ligature du mésentère
- Ciseaux Metzenbaum
- Agrafeuse ILA à charge bleue de 100 mm
- 4-0 Vicryl pour la maturation de la colostomie
- 1-0 Suture prolène pour la fermeture fasciale
- Agrafeuse cutanée
Rien à divulguer.
Le patient visé dans cet article vidéo a donné son consentement éclairé pour être filmé et est conscient que des informations et des images seront publiées en ligne.
Nous tenons à remercier Theresa Kim, MD pour son aide dans cette opération.
References
- Mattiuzzi C, Sanchis-Gomar F, Lippi G. Mise à jour concise sur l’épidémiologie du cancer colorectal. Ann Transl Med. 2019;7:609. doi :10.21037/atm.2019.07.91.
- Kuipers EJ, Grady WM, Lieberman D, et al. Cancer colorectal. Nat Rev Dis Amorces. 2015;1:15065. doi :10.1038/nrdp.2015.65.
- Mortalité GBD, causes de décès C. Mortalité mondiale, régionale et nationale toutes causes confondues et par cause pour 240 causes de décès, 1990-2013 : une analyse systématique pour l’étude mondiale sur la charge de morbidité 2013. Lancette. 2015;385:117-71. doi :10.1016/S0140-6736(14)61682-2.
- Siegel R, Desantis C, Jemal A. Statistiques sur le cancer colorectal, 2014. CA Cancer J Clin. 2014;64:104-17. doi :10.3322/caac.21220.
- Épidémiologie et mécanismes de l’incidence croissante des cancers du côlon et du rectum chez les jeunes adultes. Gastro-entérologie. 2020;158:341-53. doi :10.1053/j.gastro.2019.07.055.
- Jasperson KW, Tuohy TM, Neklason DW, Burt RW. Cancer du côlon héréditaire et familial. Gastro-entérologie. 2010;138:2044-58. doi :10.1053/j.gastro.2010.01.054.
- DeSantis CE, Lin CC, Mariotto AB, et al. Statistiques sur le traitement du cancer et la survie, 2014. CA Cancer J Clin. 2014;64:252-71. doi :10.3322/caac.21235.
- Vogelstein B, Fearon ER, Hamilton SR, et al. Altérations génétiques au cours du développement d’une tumeur colorectale. N Engl J Med. 1988;319:525-32. doi :10.1056/NEJM198809013190901.
- Erstad DJ, Tumusiime G, Cusack JC Jr. Biomarqueurs pronostiques et prédictifs dans le cancer colorectal : implications pour le chirurgien clinicien. Ann Surg Oncol. 2015;22:3433-50. doi :10.1245/s10434-015-4706-x.
- Le Voyer TE, Sigurdson ER, Hanlon AL, et al. La survie au cancer du côlon est associée à l’augmentation du nombre de ganglions lymphatiques analysés : une enquête secondaire de l’essai intergroupe INT-0089. J Clin Oncol. 2003;21:2912-9. doi :10.1200/JCO.2003.05.062.
- Kim YW, Kim NK, Min BS, Lee KY, Sohn SK, Cho CH. L’influence du nombre de ganglions lymphatiques récupérés sur la stadification et la survie chez les patients atteints d’un cancer du rectum de stade II et III subissant une excision mésorectale spécifique de la tumeur. Ann Surg. 2009;249:965-72. doi :10.1097/SLA.0b013e3181a6cc25.
- Rahbari NN, Bork U, Motschall E, et al. La détection moléculaire des cellules tumorales dans les ganglions lymphatiques régionaux est associée à la récidive de la maladie et à une faible survie dans le cancer colorectal sans envahissement ganglionnaire : une revue systématique et une méta-analyse. J Clin Oncol. 2012;30:60-70. doi :10.1200/JCO.2011.36.9504.
- Bertelsen CA, Neuenschwander AU, Jansen JE, et al. Danish Colorectal Cancer G. Survie sans maladie après excision mésocolique complète par rapport à la chirurgie conventionnelle du cancer du côlon : une étude rétrospective basée sur la population. Lancet Oncol. 2015;16:161-8. doi :10.1016/s1470-2045(14)71168-4.
- Hohenberger W, Weber K, Matzel K, Papadopoulos T, Merkel S. Chirurgie standardisée pour le cancer du côlon : excision mésocolique complète et ligature centrale - notes techniques et résultat. Dis. colorectal 2009; 11:354-64; Discussion 64-5. doi :10.1111/j.1463-1318.2008.01735.x.
- Gangireddy VGR, Coleman T, Kanneganti P, et al. Polypectomie versus chirurgie dans le cancer du côlon précoce : la taille et l’emplacement du cancer du côlon affectent la survie à long terme. Int J Colorectal Dis. 2018;33:1349-57. doi :10.1007/s10350-007-9175-2.
- Hurwitz H, Fehrenbacher L, Novotny W, et al. Le bévacizumab associé à l’irinotécan, au fluorouracile et à la leucovorine pour le traitement du cancer colorectal métastatique. N Engl J Med. 2004;350:2335-42. doi :10.1056/NEJMoa032691.
- Dienstmann R, Salazar R, Tabernero J. Personnalisation du traitement adjuvant du cancer du côlon : sélection de traitements optimaux pour chaque patient. J Clin Oncol. 2015;33:1787-96. doi :10.1200/JCO.2014.60.0213.
- Dudley JC, Lin MT, Le DT, Eshleman JR. L’instabilité des microsatellites comme biomarqueur du blocage de-1. Clin Cancer Res. 2016;22:813-20. doi :10.1158/1078-0432.CCR-15-1678.
Cite this article
Erstad DJ, Berger DL. Colectomie ouverte gauche pour le cancer du côlon : résection du côlon gauche et résection sigmoïde avec formation d’une colostomie. J Med Insight. 2024; 2024(29). doi :10.24296/jomi/29.

