Offene linke Kolektomie für Darmkrebs: Linke Dickdarm- und Sigmoidresektion mit Kolostomiebildung
Main Text
Table of Contents
Eine offene Kolektomie ist die Resektion des gesamten oder eines Teils des Dickdarms, typischerweise durch einen Mittellinienschnitt im Bauchraum. Dieses Verfahren ist häufig zur Behandlung von Dickdarmerkrankungen wie Darmverschluss, Divertikulitis, entzündlichen Darmerkrankungen und Darmkrebs indiziert. Der Patient in diesem Fall war ein tetraplegiker C6-Mann, der sich mit Dickdarmkrebs in der Nähe der Milzflexur vorstellte. Er litt auch an Dickdarmdysmotilität und schwerer Verstopfung. Er wurde mit einer offenen linken Kolektomie durch eine Laparotomie der oberen Mittellinie behandelt. Was das Verfahren betrifft, so wurde nach dem Eintritt in den Bauch die Bauchhöhle untersucht und der Tumor identifiziert. Der Dickdarm wurde mobilisiert, beginnend mit dem Dickdarm transversal, der lateral gestreckt wurde, um die Leberflexur abzubauen, gefolgt von der Mobilisation des rechten Dickdarms in lateraler bis medialer Weise. Als nächstes wurde die Milzflexur mobilisiert, gefolgt vom Colon descendens, wiederum in lateraler bis medialer Weise. Nach der Mobilisierung wurden die Ränder der Durchtrennung identifiziert, und das dazwischen liegende Mesokolon wurde in einer Schnitt- und Krawattenweise ligiert. Der Dickdarm wurde dann mit einem ILA-Stapler transziert, um das distale transversale, absteigende und proximale Sigma einzuschließen. Schließlich wurde das proximale abgeschnittene Ende des Colon transversum durch eine linksseitige Endkolostomie nach oben gebracht. In diesem Video werden die wichtigsten Schritte des Verfahrens demonstriert und wir bieten Analysen zu unserer intraoperativen Entscheidungsfindung.
Dickdarmkrebs ist ein bösartiger Prozess, an dem die Epithelauskleidung des Dickdarms beteiligt ist. Sie ist die dritthäufigste Krebserkrankung der Welt und macht etwa 9 % der neuen Krebsdiagnosen aus. 1 Die Inzidenz von Darmkrebs ist geografisch variabel, was darauf hindeutet, dass sowohl genetische als auch Lebensstilfaktoren zur Entstehung von Krankheiten beitragen. Westafrika hat mit einer Rate von 3-4 Fällen pro 100.000 Personen und Jahr die niedrigste Inzidenz, während Nordamerika eine jährliche Inzidenz von 26 pro 100.000 Personen aufweist. 2 Darüber hinaus ist Darmkrebs mit über 700.000 Fällen pro Jahr die vierthäufigste krebsbedingte Todesursache. 3 Zusammengenommen stellt diese Erkrankung ein großes globales Gesundheitsproblem sowohl für Industrie- als auch für Entwicklungsländer dar.
Zu den Risikofaktoren für Darmkrebs gehören Alter, Umweltfaktoren und genetische Veranlagung. Das mediane Alter der Diagnose liegt bei 67 Jahren für Männer und 71 Jahren für Frauen. 4 Während das Aufkommen der regelmäßigen Vorsorgeuntersuchung der Koloskopie dazu beigetragen hat, die Inzidenz von Dickdarmkrebs bei Patienten über 50 Jahren zu senken, hat sich die Inzidenz von Dickdarmkrebs bei jüngeren Patienten, hauptsächlich im Alter von 40 bis 49 Jahren, in den letzten Jahrzehnten verdoppelt. 5 Der Anstieg der Inzidenz in jüngeren Bevölkerungsgruppen ist wahrscheinlich mit steigenden Raten von Fettleibigkeit, Bewegungsmangel, westlicher Ernährung, metabolischem Syndrom sowie Alkohol- und Tabakkonsum verbunden. Diese Beobachtungen wurden in anderen Industrieländern in ähnlicher Weise beobachtet. Schließlich deuten familiäre Studien darauf hin, dass bis zu 30 % der Dickdarmkrebserkrankungen mit einer erblichen Form der Krankheit zusammenhängen, und etwa 5 % der Fälle sind mit hochpenetranten Darmkrebssyndromen verbunden, einschließlich familiärer adenomatöser Polyposis (FAP), Lynch-Syndrom und hamartomatöser Erkrankungen. 6
Die chirurgische Resektion ist nach wie vor die einzige kurative Therapie bei Dickdarmkrebs. Sobald eine Diagnose gestellt wurde, in der Regel durch eine Screening-Darmspiegelung, werden die Patienten mit dem TNM-System des American Joint Committee on Cancer (AJCC) vollständig inszeniert. Bei Patienten mit lokalisierter oder regionaler Erkrankung ist die Kolektomie mit einer Ausbeute von mindestens 12 Lymphknoten der Behandlungsstandard. Eine adjuvante Chemotherapie wird bei Patienten mit hohen Risikomerkmalen oder positivem Knotenstatus in Betracht gezogen. Bei Patienten mit metastasierender Erkrankung gelten die meisten dieser Fälle als unheilbar und die Patienten werden mit palliativer Chemotherapie behandelt. Das Überleben bei Dickdarmkrebs hat sich durch bessere Operationstechniken und Chemotherapien deutlich verbessert. Die durchschnittliche 5-Jahres-Überlebensrate für Erkrankungen im Frühstadium liegt bei mehr als 90 %; Die Beteiligung der Lymphknoten reduziert diese auf etwa 70 %, und die metastasierende Erkrankung ist immer noch mit einer düsteren Prognose verbunden, wobei weniger als 15 % der Patienten länger als 5 Jahre überleben. 7
In diesem Video führen wir eine offene linke Kolektomie an einem 65-jährigen Patienten durch, der sich mit einem Dickdarmverschluss infolge eines Tumors vorstellte. Bei diesem Verfahren wird der Dickdarm bilateral mobilisiert, wobei sowohl die Leber- als auch die Milzflexur entfernt werden. Das distale transversale, das absteigende und das proximale Sigma werden reseziert und eine Endkolostomie angelegt. Daher wird bei diesem Verfahren der erkrankte Teil des Dickdarms angemessen reseziert und dieser Zustand effektiv behandelt.
Bei dem Patienten handelt es sich um einen 65-jährigen Mann mit Tetraplegie nach einer traumatischen C6-Nabelschnurverletzung, der sich mit neu auftretender Übelkeit, Erbrechen und Obstipation in einem externen Krankenhaus vorstellte. Seine Abklärung umfasste eine CT-Untersuchung des Abdomens mit dem Nachweis einer obstruktiven Masse im transversalen Dickdarm. Er war klinisch stabil und wurde zur weiteren Behandlung in das Massachusetts General Hospital verlegt. Seine Krankengeschichte ist bemerkenswert durch chronische Verstopfung, wiederkehrende Dekubitusgeschwüre, die mit mehreren Operationen, einschließlich einer Girdlestone-Operation, behandelt wurden, und wiederkehrende Pyelonephritis als Folge des Status von Nierensteinen nach Lithotripsie und linksseitiger perkutaner Nephrostomiekanüle. Er hat einen American Society of Anesthesiologist Score (ASA) von 3 und sein Body-Mass-Index (BMI) liegt bei 25. Da er verstopft war, wurde der Patient zur endgültigen Behandlung direkt in den Operationssaal gebracht.
Der Patient wurde einer unauffälligen körperlichen Untersuchung unterzogen. In der Praxis stellte er sich im Rollstuhl vor und hatte keine offensichtlichen Probleme mit normalen Vitalfunktionen. Er hatte einen normalen Habitus. Seine abdominale Untersuchung war signifikant für frühere Operationsnarben, keine Hinweise auf Hernien und keine Empfindlichkeit beim Abtasten. Sein Bauch war aufgebläht, aber weich.
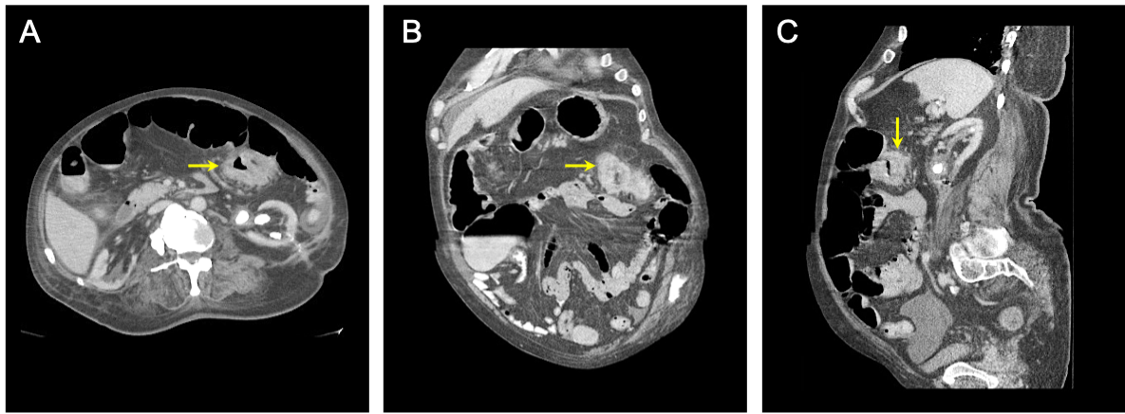
Abbildung 1: CT-Scans des Abdomens und des Beckens. CT-Untersuchung des Abdomens und des Beckens mit intravenösem und oralem Kontrastmittel, die Hinweise auf eine obstruktive transversale Dickdarmmasse zeigt. Das erkrankte Gewebe ist in (A) axialer, (B) koronaler und (C) sagittaler Ansicht dargestellt. Gelbe Pfeile zeigen auf das erkrankte Segment des Dickdarms.
Mehrere pathogene Mechanismen wurden mit der Entstehung von Dickdarmkrebs in Verbindung gebracht. Bei der Mehrzahl der Patienten führt eine schrittweise Abfolge genetischer und epigenetischer Veränderungen in den Dickdarmepithelien zur Entwicklung gutartiger Polypenneoplasien, die sich über einen Zeitraum von Jahren zu einem invasiven Karzinom entwickeln können, wie ursprünglich von Vogelstein et al. beschrieben.8 Es wurde gezeigt, dass genetische Veränderungen in drei Hauptmechanismen auftreten, darunter chromosomale Instabilität, Mikrosatelliteninstabilität und CpG-Inselmethylierung. 9 Darüber hinaus kann eine Untergruppe von Patienten Dickdarmkrebs als Folge einer signifikanten chronischen Entzündung entwickeln, die dysplastische Veränderungen ohne Polypenbildung hervorrufen kann, typischerweise bei Personen mit Colitis ulcerosa oder Morbus Crohn. In ähnlicher Weise entwickeln Personen mit Lynch-Syndrom, einer Keimbahnerkrankung, die zu Mikrosatelliteninstabilität führt, Darmkrebs ohne Polypenbildung. Sobald sich ein invasiver Krebs entwickelt hat, dringen bösartige Zellen in das umgebende Gewebe ein und zerstören es und können sich durch lymphatische, perineurale und hämatogene Invasion auf entfernte Stellen ausbreiten.
Für Patienten mit lokalisiertem, regional metastasiertem oder bestimmten Fällen von oligometastasiertem Dickdarmkrebs bleibt die chirurgische Resektion die einzige mögliche kurative Therapie. Nichtsdestotrotz sollte der Patient die Risiken und Vorteile einer Operation mit seinem Chirurgen besprechen. Eine adjuvante Chemotherapie ist häufig indiziert bei Erkrankungen mit aggressiven Merkmalen oder bei Erkrankungen, die sich auf Lymphknoten oder entfernte Organstellen ausgebreitet haben. Eine Chemotherapie allein kann diesen Zustand jedoch nicht heilen.
Im Allgemeinen ist das Ziel der chirurgischen Resektion die vollständige Exstirpation des bösartigen Gewebes, also eine kurative Absicht.
Es kann bestimmte Fälle geben, in denen sich der Krebs auf entfernte Stellen ausgebreitet hat, obwohl eine Komplikation mit dem Primärtumor aufgetreten ist, einschließlich erheblicher Blutungen, Perforationen oder Obstruktionen. In diesen Situationen kann ein Chirurg entscheiden, als akuter lebensrettender Eingriff zu operieren, ohne das Ziel der Krankheitsheilung. In diesem Video stellte sich der Patient mit einer Komplikation, einem Dickdarmverschluss, vor, hatte aber glücklicherweise keine Hinweise auf eine metastasierende Erkrankung.
Wie wir in diesem Video gezeigt haben, sind die wichtigsten Verfahrensschritte für diese Operation wie folgt: (1) Durchführung einer Mittellinien-Laparotomie und Untersuchung der Peritonealhöhle, (2) Mobilisierung des Dickdarms quer durch Demontage des gastrokolischen Bandes und Eintritt in den kleinen Sack, (3) Demontage der hepatischen Flexur und laterale zu mediale Mobilisierung des Colon ascending, (4) Milzflexurentfernung und laterale zu mediale Mobilisierung des Colon descendens und des Colon sigmoideus, (5) Identifizierung der Resektionsränder und des Ligats zwischen Mesokolon, (6) Durchtrennung des Dickdarms mit einem ILA 100-Stapler und (7) Erstellung einer Endkolostomie in einer verdorbenen Weise. Dieser Ansatz einer offenen Kolektomie führt zu einer weitgehenden Mobilisation des gesamten Dickdarms, was eine große Resektion und eine anschließende spannungsfreie Endkolostomie auf der linken Seite des Bauches ermöglicht. Die mittlere Kolikarterie bleibt erhalten, so dass der verbleibende, distale Dickdarm ausreichend durchblutet wird.
Bei der Dickdarmkrebschirurgie bleibt das Ausmaß der Knotenausbeute und der mesokolischen Exzision ein Bereich offener Debatten. Le Voyer et al. hatten zuvor gezeigt, dass die Anzahl der analysierten Lymphknoten in Darmkrebsproben mit dem Überleben verbunden war. 10 Folglich empfehlen die aktuellen Leitlinien, dass mindestens 12 Lymphknoten mit der Krebsprobe reseziert werden, um ein adäquates Staging zu ermöglichen. Der Grund, warum eine höhere Knotenrendite mit besseren Überlebensergebnissen verbunden ist, ist nicht vollständig geklärt. Es wird angenommen, dass die Stadienmigration, bei der Krebserkrankungen mit höheren Knotenerträgen in den Vordergrund gerückt werden, wenn die Wahrscheinlichkeit, einen positiven Knoten zu finden, steigt, bis zu einem gewissen Grad dazu beiträgt. 11 Es wurde jedoch auch vorgeschlagen, dass eine umfangreichere mesokolische Exzision eine adäquatere Exstirpation der regionalen mikrometastasierenden Erkrankung ermöglicht. 12 Zur Untermauerung dieser Argumentation haben mehrere Studien gezeigt, dass eine ausgedehnte mesokolische Exzision mit einer verbesserten krankheitsfreien und Gesamtüberlebensrate bei Darmkrebspatienten verbunden ist. 13, 14 In diesem Video wurde das Mesokolon in der Nähe der Gefäßabgänge entnommen, um ein größeres mesokolisches Exemplar zu erhalten.
Auch in Zukunft wird es Verbesserungen bei der nicht-chirurgischen Behandlung von Dickdarmkrebs geben. Mit verbesserten Raten der Screening-Koloskopie haben sich frühere Erkennungen und endoskopische Polypektomie als ausreichend für die Behandlung von Krebserkrankungen im Frühstadium erwiesen, so dass bei einer Untergruppe von Personen keine Operation erforderlich ist. 15 Auch systemische Therapien haben eine signifikante Weiterentwicklung und Verbesserung erfahren. Neu entwickelte zielgerichtete Therapien gegen den vaskulären endothelialen Wachstumsfaktor (VEGF), den epidermalen Wachstumsfaktor-Rezeptor (EGFR) und Komponenten des KRAS-Signalwegs könnten einen zusätzlichen Nutzen für die aktuellen Chemotherapien haben und befinden sich in der klinischen Prüfung. 16, 17 Schließlich könnte die jüngste Entwicklung der Immuntherapie vielversprechend für die Untergruppe der Dickdarmkrebsarten sein, die durch Mikrosatelliteninstabilität definiert sind. 18
- Betriebszeit: 90 Minuten
- Geschätzter Blutverlust: 400 ml
- Flüssigkeiten: 4600 mL kristalloid
- Aufenthaltsdauer: Entlassung aus dem Krankenhaus nach Hause mit Besuchspflege am postoperativen Tag 9
- Morbidität: keine Komplikationen
- Endgültige Pathologie: pT4aN2bM0, 8 von 17 positiven Knoten; Histologie: schlecht differenziert mit lymphovaskulärer Invasion, Operationsränder alle negativ
- Skalpell mit 10 Klingen
- Elektrokauter
- DeBakey Zange
- Handretraktor für die Bauchdecke
- Schnidt Klemme
- 3-0 und 2-0 Seidenkrawatten für die Ligatur des Mesenteriums
- Metzenbaum Schere
- ILA-Hefter mit blauer Beladung (100 mm)
- 4-0 Vicryl zur Reifung der Kolostomie
- 1-0 Prolene-Naht für Faszienverschluss
- Hautklammerer
Nichts zu verraten.
Der Patient, auf den in diesem Videoartikel Bezug genommen wird, hat seine Einverständniserklärung gegeben, gefilmt zu werden, und ist sich bewusst, dass Informationen und Bilder online veröffentlicht werden.
Wir danken Dr. Theresa Kim für die Unterstützung bei dieser Operation.
References
- Mattiuzzi C, Sanchis-Gomar F, Lippi G. Kompaktes Update zur Darmkrebsepidemiologie. Ann Transl Med. 2019;7:609. doi:10.21037/atm.2019.07.91.
- Kuipers EJ, Grady WM, Lieberman D, et al. Darmkrebs. Nat Rev Dis Fibeln. 2015;1:15065. doi:10.1038/nrdp.2015.65.
- Mortalität GBD, Todesursachen C. Globale, regionale und nationale alters- und geschlechtsspezifische Gesamt- und ursachenspezifische Mortalität für 240 Todesursachen, 1990-2013: eine systematische Analyse für die Global Burden of Disease Study 2013. Lanzette. 2015;385:117-71. doi:10.1016/S0140-6736(14)61682-2.
- Siegel R, Desantis C, Jemal A. Darmkrebsstatistik, 2014. CA Krebs J Clin. 2014;64:104-17. doi:10.3322/caac.21220.
- Stoffel EM, Murphy CC. Epidemiologie und Mechanismen der zunehmenden Inzidenz von Dickdarm- und Rektumkrebs bei jungen Erwachsenen. Gastroenterologie. 2020;158:341-53. doi:10.1053/j.gastro.2019.07.055.
- Jasperson KW, Tuohy TM, Neklason DW, Burt RW. Erblicher und familiärer Dickdarmkrebs. Gastroenterologie. 2010;138:2044-58. doi:10.1053/j.gastro.2010.01.054.
- DeSantis CE, Lin CC, Mariotto AB, et al. Krebsbehandlungs- und Überlebensstatistiken, 2014. CA Krebs J Clin. 2014;64:252-71. doi:10.3322/caac.21235.
- Vogelstein B, Fearon ER, Hamilton SR et al. Genetische Veränderungen während der Entwicklung von kolorektalen Tumoren. N Engl J Med. 1988;319:525-32. doi:10.1056/NEJM198809013190901.
- Erstad DJ, Tumusiime G, Cusack JC Jr. Prognostische und prädiktive Biomarker bei Darmkrebs: Implikationen für den klinischen Chirurgen. Ann Surg Oncol. 2015;22:3433-50. doi:10.1245/s10434-015-4706-x.
- Le Voyer TE, Sigurdson ER, Hanlon AL, et al. Das Überleben von Dickdarmkrebs ist mit einer zunehmenden Anzahl der analysierten Lymphknoten verbunden: eine Sekundärstudie der Intergruppenstudie INT-0089. J Clin Oncol. 2003;21:2912-9. doi:10.1200/JCO.2003.05.062.
- Kim YW, Kim NK, Min BS, Lee KY, Sohn SK, Cho CH. Der Einfluss der Anzahl der entnommenen Lymphknoten auf das Staging und das Überleben bei Patienten mit Rektumkarzinom im Stadium II und III, die sich einer tumorspezifischen mesorektalen Exzision unterziehen. Ann Surg. 2009;249:965-72. doi:10.1097/SLA.0b013e3181a6cc25.
- Rahbari NN, Bork U, Motschall E, et al. Der molekulare Nachweis von Tumorzellen in regionalen Lymphknoten ist mit einem Wiederauftreten der Erkrankung und einem schlechten Überleben bei nodal-negativem Darmkrebs verbunden: eine systematische Übersichtsarbeit und Metaanalyse. J Clin Oncol. 2012;30:60-70. doi:10.1200/JCO.2011.36.9504.
- Bertelsen CA, Neuenschwander AU, Jansen JE, et al. Danish Colorectal Cancer G. Krankheitsfreies Überleben nach vollständiger mesokolischer Exzision im Vergleich zur konventionellen Darmkrebsoperation: eine retrospektive, populationsbasierte Studie. Lanzette Oncol. 2015;16:161-8. doi:10.1016/s1470-2045(14)71168-4.
- Hohenberger W, Weber K, Matzel K, Papadopoulos T, Merkel S. Standardisierte Chirurgie bei Dickdarmkrebs: vollständige mesokolische Exzision und zentrale Ligatur - technische Hinweise und Ergebnis. Kolorektale Dis. 2009; 11:354-64; Diskussion 64-5. doi:10.1111/j.1463-1318.2008.01735.x.
- Gangireddy VGR, Coleman T, Kanneganti P, et al. Polypektomie versus Operation bei Dickdarmkrebs im Frühstadium: Größe und Lokalisation von Dickdarmkrebs beeinflussen das Langzeitüberleben. Int J kolorektale Dis. 2018;33:1349-57. doi:10.1007/s10350-007-9175-2.
- Hurwitz H, Fehrenbacher L, Novotny W, et al. Bevacizumab plus Irinotecan, Fluorouracil und Leucovorin bei metastasierendem Darmkrebs. N Engl J Med. 2004;350:2335-42. doi:10.1056/NEJMoa032691.
- Dienstmann R, Salazar R, Tabernero J. Personalisierung der adjuvanten Therapie bei Dickdarmkrebs: Auswahl optimaler Behandlungen für einzelne Patienten. J Clin Oncol. 2015;33:1787-96. doi:10.1200/JCO.2014.60.0213.
- Dudley JC, Lin MT, Le DT, Eshleman JR. Mikrosatelliteninstabilität als Biomarker für die PD-1-Blockade. Clin Cancer Res. 2016;22:813-20. doi:10.1158/1078-0432.CCR-15-1678.
Cite this article
Erstad DJ, Berger DL. Offene linke Kolektomie bei Dickdarmkrebs: Resektion des linken Dickdarms und des Sigmas mit Kolostomiebildung. J Med Insight. 2024; 2024(29). doi:10.24296/jomi/29.

