Adrenalectomia retroperitoneoscópica posterior bilateral com preservação cortical no lado direito
Main Text
Table of Contents
A adrenalectomia poupadora de corticais permite a ressecção do(s) tumor(es) adrenal(is), preservando o tecido adrenal não afetado para evitar a insuficiência adrenal. Isso é especialmente importante em pacientes afetados por tumores adrenais bilaterais, geralmente feocromocitomas.
A adrenalectomia retroperitoneoscópica posterior (PRA) permite uma abordagem minimamente invasiva para a ressecção da glândula adrenal em comparação com a adrenalectomia transabdominal laparoscópica mais tradicional e as abordagens abertas. A técnica PRA é cada vez mais utilizada por cirurgiões endócrinos de alto volume em todo o mundo. Essa abordagem é ideal para tratar pacientes com doença bilateral e foi usada neste caso de um paciente que apresenta feocromocitomas bilaterais no contexto da síndrome da neoplasia endócrina múltipla 2A.
A adrenalectomia retroperitoneoscópica posterior (PRA) foi popularizada pela primeira vez na Alemanha por Walz e colegas. As glândulas supra-renais são acessadas por meio de uma abordagem retroperitoneal usando instrumentação laparoscópica e insuflação de CO2 . 1 Ao fazer isso, o cirurgião evita a entrada na cavidade peritoneal e a mobilização das vísceras circundantes, incluindo intestino, fígado, baço e pâncreas. Em comparação com as abordagens de adrenalectomia transabdominal aberta e laparoscópica (LTA), essa técnica promove a recuperação do paciente com menor tempo de internação, menos dor e risco reduzido de íleo paralítico. 2-4
Uma das vantagens do PRA é que ele permite o acesso bilateral a ambas as glândulas supra-renais por meio de uma abordagem minimamente invasiva, sem exigir o reposicionamento do paciente durante as operações. 2 Pacientes que apresentam tumores adrenais bilaterais, geralmente feocromocitomas devido à síndrome de Von Hippel Lindau (VHL) ou neoplasia endócrina múltipla tipo 2 (NEM2), são candidatos ideais para essa abordagem. Em ambos os processos patológicos, ocorrem frequentemente tumores bilaterais. Como tal, os pacientes podem precisar de adrenalectomias bilaterais para obter uma cura bioquímica.
Para prevenir a insuficiência adrenal aguda pós-operatória (crise addisoniana), a adrenalectomia poupadora de corticais pode ser realizada. Durante este procedimento, o tecido tumoral culpado é removido, preservando o tecido adrenal normal. 5 Tradicionalmente, essa técnica tem sido descrita ao lado de abordagens abertas e LTA; no entanto, para doenças bilaterais, a abordagem PRA está sendo cada vez mais utilizada com sucesso.
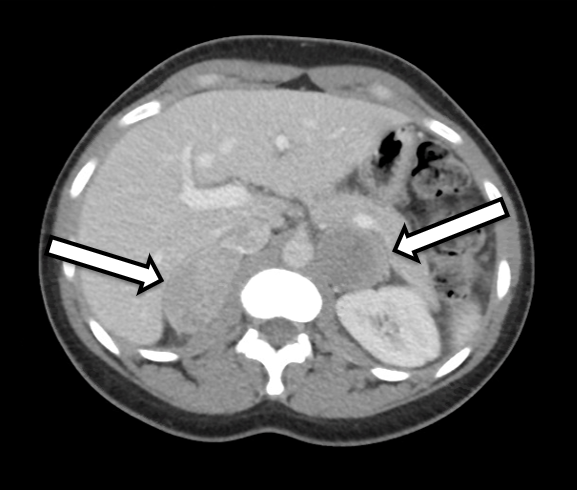
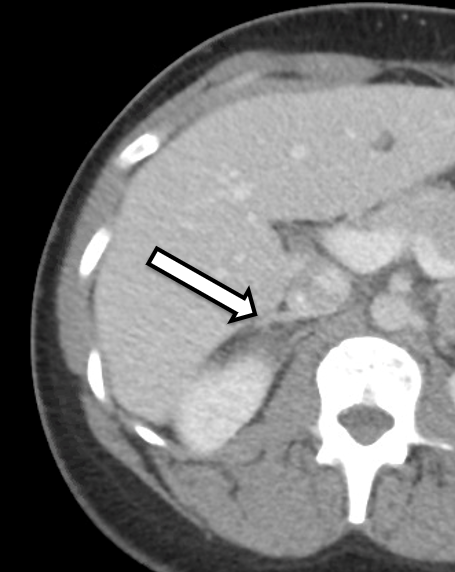
A paciente é uma mulher de 31 anos que apresentou feocromocitomas bilaterais bioquimicamente inequívocos. Ela apresentava sintomas de hipertensão e palpitações, o que levou a uma investigação mais aprofundada por seu médico de cuidados primários. Sua investigação laboratorial foi significativa para metanefrinas plasmáticas livres elevadas a 642 pg/ml (intervalo de referência < 57 pg/mL) e normetanefrina a 2284 pg/ml (< referência 148 pg/ml), bem como metanefrinas urinárias elevadas, consistentes com um feocromocitoma. A imagem transversal incluiu uma TC do abdome com contraste IV. A TC revelou nódulos adrenais bilaterais com unidades Hounsfield pré-contraste e características gerais de imagem do feocromocitoma bilateral (Figura 1). Uma revisão detalhada de sua imagem demonstrou tecido do córtex adrenal de aparência normal no lado direito (Figura 2) que seria propício à adrenalectomia poupadora de cortical neste lado.
Devido à sua pouca idade e à presença de tumores bilaterais, ela foi investigada mais a fundo para outros tumores associados à NEM2A, especificamente câncer medular de tireoide e hiperparatireoidismo primário. De fato, descobriu-se que ela tinha um nível elevado de calcitonina sérica de 229 pg/ml (referência < 5 pg/ml), e os achados de ultrassonografia e aspiração com agulha fina foram consistentes com carcinoma medular de tireoide do lobo tireoidiano direito. Seus níveis séricos intactos de paratormônio e cálcio não eram dignos de nota.
A TC e a RNM são as principais técnicas radiológicas usadas para obter imagens das glândulas supra-renais normais e anormais. Na TC, os feocromocitomas são frequentemente bem definidos a partir dos tecidos circundantes e geralmente demonstram unidades de Hounsfield pré-contraste de 30 a 40. Lesões menores tendem a parecer simples e sólidas, enquanto lesões maiores podem ter características mais císticas, bem como outras características complexas. Na ressonância magnética, os feocromocitomas têm uma aparência clássica de "lâmpada" em imagens ponderadas em T2. Exames de imagem funcionais também podem ser obtidos, especialmente quando a doença metastática é uma preocupação. O método mais comum é o uso de 131 I- e 123 I-metaiodobenzilguanidina (MIBG), que é um análogo da norepinefrina e se localiza preferencialmente em tecidos simpathomedulares. 6
Preferimos que o paciente seja submetido a TC ou RM com protocolo adrenal dentro de aproximadamente 3 a 6 meses após a operação para planejamento operatório. Neste caso, o paciente foi encaminhado para nós após uma TC mostrando massas adrenais bilaterais com características de imagem suspeitas de feocromocitoma. Em uma revisão detalhada de sua imagem, ficou evidente que o membro medial inferior da glândula adrenal direita tinha tecido do córtex adrenal não afetado que poderia ser potencialmente preservado durante a ressecção.
Os feocromocitomas se originam das células da crista neural da medula adrenal e secretam quantidades excessivas de catecolaminas. A prevalência geral de feocromocitomas foi estimada entre 1:6500 e 1:2500, com uma idade média de início entre 40 e 50 anos e uma prevalência ligeiramente maior em mulheres. A maioria dos tumores é benigna. 6 Curiosamente, não existe uma única característica patológica, incluindo tamanho, taxa mitótica ou invasão vascular ou capsular, que possa prever com precisão o potencial maligno, embora vários algoritmos preditivos tenham sido criados. 7 Aproximadamente 10–15% dos tumores podem apresentar e/ou desenvolver doença metastática, indicativa de transformação maligna. 8 A sobrevida específica da doença para feocromocitomas malignos foi estimada em aproximadamente 70% em 5 anos com base na análise do banco de dados Surveillance, Epidemiology, and End Results (SEER). 9
O tratamento padrão para feocromocitomas é a ressecção cirúrgica. Antes da operação, o paciente deve ser submetido ao bloqueio das catecolaminas, que geralmente é realizado com o bloqueador não seletivo do receptor alfa fenoxibenzamina ou um bloqueador alfa seletivo, como a doxazosina. Agentes anti-hipertensivos adicionais também podem ser necessários, incluindo betabloqueadores. No entanto, os betabloqueadores só devem ser iniciados após o paciente ter sido colocado em alfabloqueadores para evitar uma crise hipertensiva causada por um bloqueio do receptor beta sem oposição. Além disso, os pacientes estão cronicamente desidratados e necessitam de ressuscitação fluídica pré-operatória. 10
Pacientes acometidos por feocromocitomas frequentemente sofrem episódios de hipertensão grave e outras manifestações clínicas de produção excessiva de catecolaminas, incluindo palpitações, dores de cabeça, ataques de pânico e diaforese. 11 Embora os medicamentos para pressão arterial possam proporcionar alívio parcial, o único tratamento durável e de longo prazo é a ressecção da(s) lesão(ões) culpada(s). Além disso, aqueles que continuam sem intervenção correm o risco de crises hipertensivas graves, potencialmente levando à morte. 12 Portanto, pacientes com feocromocitomas devem procurar tratamento cirúrgico rapidamente.
Em pacientes que apresentam feocromocitomas bilaterais, a adrenalectomia poupadora de corticais pode prevenir a ocorrência de insuficiência adrenal durante a ressecção do tecido culpado. Estudos anteriores mostraram que a adrenalectomia total pode ser altamente mórbida. Por exemplo, em uma série publicada por Lairmore et al. em que 43 pacientes foram submetidos a adrenalectomia completa para feocromocitomas bilaterais, 23% sofreram episódios de insuficiência adrenal e um paciente morreu de uma crise addisoniana. 13 Além disso, pacientes submetidos à adrenalectomia total relatam má qualidade de vida e hospitalizações frequentes relacionadas à insuficiência adrenal. 14
A adrenalectomia poupadora de cortical é uma opção inestimável para pacientes com síndromes genéticas associadas a feocromocitomas. Essas síndromes incluem NEM2, VHL e neurofibromatose tipo 1 (NF1), entre outras. É importante observar que os pacientes diagnosticados com feocromocitomas bilaterais devem ser encaminhados para testes genéticos. O teste de calcitonina pode ser um complemento útil para identificar pacientes com NEM2, pois o teste genético pode levar vários meses para ser realizado e interpretado adequadamente. Aproximadamente 40-80% dos pacientes com NEM2A ou VHL desenvolverão feocromocitomas bilaterais, e esses tumores geralmente são benignos. 15 Como tal, a adrenalectomia poupadora de cortical pode remover o tecido afetado, deixando para trás tecido suficiente para prevenir a insuficiência adrenal com risco mínimo de recorrência.
O primeiro caso de adrenalectomia poupadora de cortical foi descrito por Irvin et al. em 1983. 16 Desde então, algumas instituições relataram sucesso na realização de adrenalectomia poupadora de cortical por meio de abordagens abertas ou minimamente invasivas com taxas de recorrência bastante baixas e, principalmente, baixa ocorrência de insuficiência adrenal. 14 O uso de PRA vem aumentando à medida que cirurgiões endócrinos de alto volume implementam essa técnica. O PRA foi descrito pela primeira vez em 1995 e depois desenvolvido através da experiência de Walz e seus colegas. 1, 4, 17 Estudos retrospectivos comparando PRA com LTA mostram diminuição do tempo operatório, diminuição da perda sanguínea e nenhuma diferença nos desfechos em longo prazo.
Mais recentemente, a PRA também está sendo utilizada para adrenalectomia poupadora de cortical. Em uma série recente, foi descrita a experiência ao longo de um período de 25 anos de realização de adrenalectomias poupadoras de corticais para feocromocitomas bilaterais usando a abordagem RPA. Sessenta e seis pacientes foram operados com um total de 101 adrenalectomias realizadas. O tempo operatório médio foi de 128 minutos para cirurgias bilaterais, e relataram apenas duas complicações maiores. Eles foram capazes de realizar uma operação poupadora de corticais em 89 dos casos e, desses pacientes, 91% não necessitaram de esteróides no pós-operatório. Apenas um paciente apresentou doença persistente, enquanto nenhuma recidiva foi relatada. 18 Os pacientes devem ser avisados de que podem ter alguma insuficiência adrenal após a cirurgia. Isso depende do tamanho do tecido adrenal remanescente e da preservação do fluxo sanguíneo. A insuficiência adrenal temporária é tratada em estreita consulta com endocrinologia e exames laboratoriais apropriados.
O procedimento é realizado sob anestesia geral com intubação endotraqueal. Devido às alterações hemodinâmicas que podem ocorrer durante a cirurgia devido ao tumor, uma linha arterial é colocada para monitorização da pressão arterial, e o anestesiologista administra drogas vasoativas conforme a necessidade. Um cateter de Foley é colocado para monitorar o débito urinário. Dependendo do grau de elevação das catecolaminas e de outros fatores do paciente, uma linha venosa central pode ser colocada para acesso venoso adicional e monitoramento da pressão venosa central.
Após a indução da anestesia geral e intubação endotraqueal, o paciente é colocado em decúbito ventral com os quadris dobrados a 90 graus. Uma mesa Cloward com uma sela cirúrgica Cloward é usada para permitir que o abdômen fique pendurado de forma dependente. A posição do canivete e a Sela Cirúrgica Cloward abrem o espaço retroperitoneal para maximizar a exposição. Todos os pontos de pressão, incluindo rosto, braços, quadris e pernas, são extensivamente acolchoados. A crista ilíaca, as pontas da 11ª e 12ª costelas e a borda dos músculos paraespinhosos são marcos importantes marcados pelo cirurgião. A incisão inicial é colocada logo abaixo da ponta da 12ª costela. As tesouras são usadas para dividir nitidamente o tecido mole e entrar no retroperitônio. O dedo do cirurgião é então usado para liberar o espaço e orientar a colocação de uma porta de 5 mm medial e lateralmente, ambas inclinadas em cerca de 30 graus e voltadas para a posição da glândula adrenal. Uma porta de balão de 10 mm é então colocada na incisão do meio. O retroperitônio é insuflado com CO2 através de tubos de alto fluxo a uma pressão de insuflação de 25 mmHg.
Um osciloscópio de 5 mm a 30 graus é inserido na porta de 10 mm e um dispositivo LigaSure é usado para criar o espaço retroperitoneal. A dissecção começa pela identificação dos músculos paraespinhosos medialmente, que é seguida pela identificação do rim inferiormente. A câmera é então normalmente movida para a porta medial e o cirurgião usa um dispositivo LigaSure e uma pinça intestinal através das portas lateral e central, respectivamente. A dissecção continua sobre o polo superior do rim e ao longo dos músculos paraespinhais medialmente, em direção à glândula adrenal. A exposição é facilitada em parte pela pressão descendente sobre o rim. À medida que a glândula adrenal é identificada, a extensão inferior da glândula e sua relação com a veia adrenal são determinadas. À direita, esta dissecção revela a VCI, da qual a glândula adrenal é dissecada para revelar a veia adrenal. À esquerda, a veia adrenal se origina da veia renal esquerda.
Neste ponto, a relação precisa do tecido adrenal cortical inalterado com o tumor culpado é determinada. Isso é em parte determinado por uma avaliação detalhada da imagem pré-operatória em conjunto com os achados intraoperatórios. Ocasionalmente, a ultrassonografia intraoperatória pode ser útil. Uma vez identificado um plano adequado, o feocromocitoma é então dividido do tecido adrenal normal com um dispositivo LigaSure. A glândula adrenal é altamente vascularizada, portanto, atenção meticulosa é dada à hemostasia à medida que a glândula é seccionada. Nesse caso, o membro medial inferior da glândula adrenal direita nativa era adequado para preservação. Se possível, a veia deve ser preservada. No entanto, isso não é necessário, nem sempre é viável, uma vez que há drenagem venosa adicional ao longo das pequenas artérias adrenais. Durante a operação atual, descobriu-se que a veia adrenal estava entrando diretamente no tumor e, como tal, foi dividida com clipes. Nesse ponto, as inserções medial e lateral do tumor são retiradas, deixando a inserção superior para permitir que o tumor fique pendurado e forneça um local superior de contratração. Deve-se tomar cuidado para não entrar na cavidade peritoneal durante as dissecções lateral e cefálica. Uma vez que o tumor tenha sido dissecado circunferencialmente, as inserções superiores são retiradas e a glândula é removida do espaço retroperitoneal com um dispositivo Endocatch. A porta de 10 mm é fechada em camadas, enquanto os locais das portas de 5 mm são fechados apenas no nível da pele.
A patologia final revelou um feocromocitoma direito de 5,2 cm e um feocromocitoma esquerdo de 5,6 cm. O teste realizado no primeiro dia de pós-operatório demonstrou uma leve diminuição da produção de cortisol. Como tal, o paciente foi temporariamente colocado em uma dose baixa de esteróides orais. A paciente recebeu alta no segundo dia de pós-operatório com excelente recuperação quando foi atendida na clínica duas semanas após a operação, com um plano para desmamar a dose baixa de prednisona.
Andrew frame, Cloward Surgical Saddle, dispositivo LigaSure e bolsa de recuperação Endocatch.
Os autores não têm divulgações.
O paciente referido neste artigo em vídeo deu seu consentimento informado para ser filmado e está ciente de que informações e imagens serão publicadas online.
References
- Walz MK, Peitgen K, Hoermann R, Giebler RM, Mann K, Eigler FW. Retroperitoneoscopia posterior como nova abordagem minimamente invasiva para adrenalectomia: resultados de 30 adrenalectomias em 27 pacientes. Mundo J Surg. 1996; 20(7):769-774. DOI:10.1007/S002689900117.
- Callender GG, Kennamer DL, Grubbs EG, Lee JE, Evans DB, Perrier ND. Adrenalectomia retroperitoneoscópica posterior. Adv Surg. 2009; 43(1):147-157. DOI:10.1016/j.yasu.2009.02.017.
- Perrier ND, Kennamer DL, Bao R, et al. Adrenalectomia retroperitoneoscópica posterior: técnica preferida para remoção de tumores benignos e metástases isoladas. Ann Surg. 2008; 248(4):666-674. DOI:10.1097/SLA.0b013e31818a1d2a.
- Walz MK, Peitgen K, Walz MV, et al. Adrenalectomia retroperitoneoscópica posterior: lições aprendidas em cinco anos. Mundo J Surg. 2001; 25(6):728-734. DOI:10.1007/S00268-001-0023-6.
- Lee JE, Curley SA, Gagel RF, Evans DB, Hickey RC. Adrenalectomia poupadora de cortical para pacientes com feocromocitoma bilateral. Cirurgia. 1996; 120(6):1064-1071. DOI:10.1016/S0039-6060(96)80056-0.
- Farrugia FA, Martikos G, Tzanetis P, et al. Feocromocitoma, diagnóstico e tratamento: revisão da literatura. Endocr Regul. 2017; 51(3):168-181. DOI:10.1515/enr-2017-0018.
- Feocromocitoma da glândula adrenal Scaled Score (PASS) para separar neoplasias benignas de malignas: um estudo clínico-patológico e imunofenotípico de 100 casos. Am J Surg Pathol. 2002; 26(5):551-566. DOI:10.1097%2F00000478-200205000-00002.
- Pacak K, Wimalawansa SJ. Feocromocitoma e paraganglioma. Prática de Endoscópio. 2015; 21(4):406-412. DOI:10.4158/EP14481. RA.
- Goffredo P, Sosa JA, Roman SA. Feocromocitoma maligno e paraganglioma: uma análise em nível populacional de sobrevida a longo prazo ao longo de duas décadas. J Surg Oncol. 2013; 107(6):659-664. DOI:10.1002/jso.23297.
- Melhoria do manejo pré-operatório em pacientes com feocromocitoma adrenal. Int J Clin Exp Med. 2014; 7(12):5541-5546. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4307515.
- Chen H, Sippel RS, O'Dorisio MS, Vinik AI, Lloyd RV, Pacak K; Sociedade Norte-Americana de Tumores Neuroendócrinos (NANETS). A diretriz de consenso da North American Neuroendocrine Tumor Society para o diagnóstico e tratamento de tumores neuroendócrinos: feocromocitoma, paraganglioma e câncer medular de tireoide. Pâncreas. 2010; 39(6):775-783. DOI:10.1097/MPA.0b013e3181ebb4f0.
- Sutton MG, Sheps SG, Lie JT. Prevalência de feocromocitoma clinicamente insuspeito: revisão de uma série de autópsias de 50 anos. Mayo Clin Proc. 1981; 56(6):354-360.
- Lairmore TC, Ball DW, Baylin SB, Wells SA Jr. Manejo de feocromocitomas em pacientes com múltiplas síndromes de neoplasia endócrina tipo 2. Ann Surg. 1993; 217(6):595-603. DOI:10.1097/00000658-199306000-00001.
- Walz MK. Extensão da adrenalectomia para neoplasia adrenal: preservação cortical (subtotal) versus adrenalectomia total. Surg Clin Norte Am. 2004; 84(3):743-753. DOI:10.1016/j.suc.2004.01.003.
- Renard J, Clerici T, Licker M, Triponez F. Feocromocitoma e paraganglioma abdominal. J Visc Surg. 2011; 148(6):e409-e416. DOI:10.1016/j.jviscsurg.2011.07.003.
- Irvin GL 3rd, Fishman LM, Sher JA. Feocromocitoma familiar. Cirurgia. 1983; 94(6):938-940. https://www.surgjournal.com/article/0039-6060(83)90403-8/texto completo.
- Mercan S, Seven R, Ozarmagan S, Tezelman S. Adrenalectomia retroperitoneal endoscópica. Cirurgia. 1995; 118(6):1071-1076. DOI:10.1016/S0039-6060(05)80116-3.
- Alesina PF, Hinrichs J, Meier B, Schmid KW, Neumann HP, Walz MK. Arco Langenbecks Surg. 2012; 397(2):233-238. DOI:10.1007/S00423-011-0851-2.
Cite this article
Brown TC, Carling T. Adrenalectomia retroperitoneoscópica posterior bilateral com preservação cortical no lado direito. J Med Insight. 2021; 2021(282). DOI:10.24296/jomi/282.