右側皮質保留を伴う両側後方後腹膜鏡下副腎摘出術
Main Text
皮質を保つ副腎摘出術は、影響を受けていない副腎組織を保存しつつ副腎腫瘍の切除を行い、副腎不全を防ぎます。これは特に両側性副腎腫瘍、通常は褐色細胞腫の患者に重要です。
後方後腹膜鏡下副腎摘出術(PRA)は、従来の腹腔鏡経腹腔鏡下副腎摘出術や開腹法に比べて、低侵襲な副腎切除術を可能にします。PRA技術は世界中の大量の内分泌外科医によってますます利用されています。このアプローチは両側性疾患患者に理想的であり、多発性内分泌腫瘍2A症候群の状況で両側性褐色細胞腫を発症した患者の場合に用いられました。
後方後腹膜鏡副腎摘出術(PRA)は、ウォルツらによってドイツで初めて普及しました。副腎は腹腔鏡下器具とCO2 吸入を用いた後腹膜アプローチでアクセスされます。1 この手術により、外科医は腹膜腔への侵入や周囲の内臓(腸、肝臓、脾臓、膵臓を含む)の動員を回避します。開腹および腹腔鏡下経腹部副腎摘出術(LTA)アプローチと比較して、この技術は患者の回復を促進し、入院期間の短縮、痛みの軽減、イリュースリスクの低減につながります。2-4
PRAの利点の一つは、手術中に患者の体位変更を必要とせず、低侵襲アプローチで両側の副腎にアクセスできることです。2 両側性副腎腫瘍、通常はフォン・ヒッペル・リンダウ(VHL)による褐色細胞腫や多発性内分泌腫瘍2型(MEN2)症候群を発症する患者がこのアプローチの理想的な候補者です。両方の疾患過程において、両側性腫瘍は頻繁に発生します。そのため、生化学的治癒を得るために両側性の副腎摘出術が必要になることがあります。
術後の急性副腎不全(アジソン危機)を防ぐために、皮質を保つ副腎摘出術が実施されます。この処置では、腫瘍の原因組織を除去しつつ、正常な副腎組織は保存されます。5 伝統的に、この手法はオープンアプローチやLTAアプローチと並んで説明されてきました。しかし、両側性疾患においてはPRAアプローチがますます成功裏に利用されています。
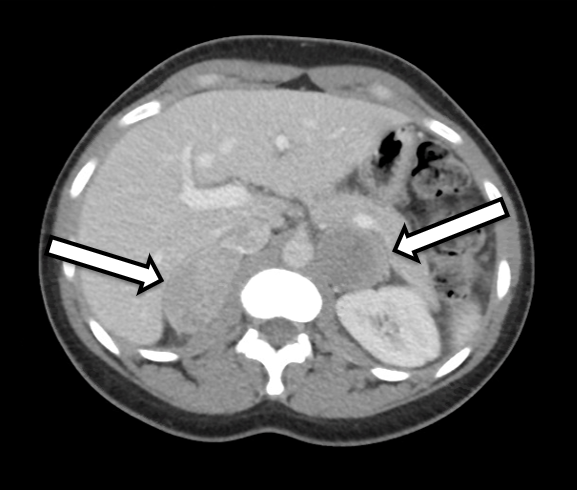
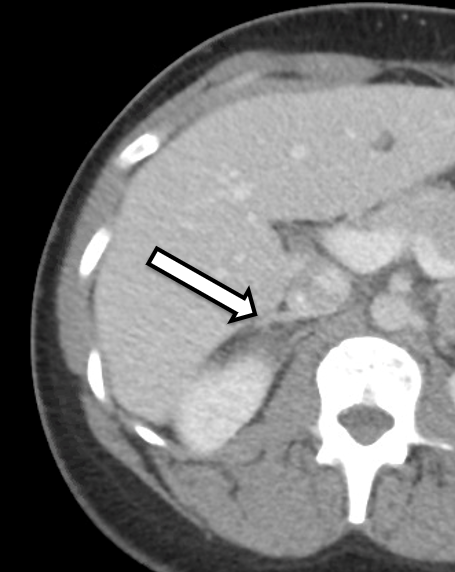
患者は31歳の女性で、生化学的に明確な両側性褐色細胞腫を発症しました。彼女は高血圧と動悸の症状があり、それによりかかりつけ医によるさらなる検査が行われました。彼女の検査結果は、遊離血漿メタネフリンが642 pg/ml(基準範囲<57 pg/mL)、ノルメタネフリンが2284 pg/ml(基準<148 pg/ml)および尿中メタネフリンの上昇で、褐色細胞腫と一致する有意な結果を示しました。断面画像検査には腹部CTと点滴造影が含まれていました。CTでは両側の副腎結節と、造影前ハウンズフィールド単位、および両側性褐色細胞腫の全体的な画像特性が確認されました(図1)。彼女の画像を詳しく確認したところ、右側の副腎皮質組織が正常に見えることが示されており(図2)、この側では皮質を保つ副腎摘出術に適しています。
若さと両側性腫瘍の存在から、髄質性甲状腺がん や原発性副甲状腺機能亢進症など、他のMEN2A関連腫瘍についてもさらに調査されました。実際、血清カルシトニン値が229 pg/ml(参考<5 pg/ml)と高値が認められ、超音波検査および細針吸引検査の結果は右甲状腺葉の髄質性甲状腺癌 と一致しました。彼女の血清、副甲状腺ホルモン、カルシウム値は異常なしでした。
CTとMRIは、正常および異常な副腎の画像診断に用いられる主な放射線技術です。CTでは、周囲組織からはっきりと特徴づけられ、通常は30–40の人工系ハウンズフィールド単位を示します。小さな病変は単純でしっかりと見える傾向がありますが、大きな病変は嚢胞性の特徴や複雑な特徴を持つことがあります。MRIでは、T2加重画像で褐色細胞腫が典型的な「電球」のような外観を示します。また、特に転移性疾患が懸念される場合は機能的画像検査も実施されることがあります。最も一般的な方法は、ノルエピネフリンの類似体であり、交錯多嚢組織に優先的に局在する131 I-および123-メタイオドベンジルグアニジン(MIBG)を使用することです。6
手術計画のために、手術後約3〜6か月以内に副腎プロトコルCTまたはMRIのいずれかを受けることを推奨します。今回の場合、患者は両側の副腎腫瘤となって褐色細胞腫の画像検査が疑わしいCT検査を受けた後、当院に紹介されました。詳細な診察や画像検査の結果、右副腎下側内側肢には損傷のない副腎皮質組織があり、切除時に保存可能であることが明らかでした。
褐色細胞腫は副腎髄質の神経稜細胞に由来し、過剰な量のカテコールアミンを分泌します。褐色細胞腫の全体的な有病率は1:6500から1:2500と推定されており、発症年齢は40〜50歳の間で、女性ではやや高い有病率です。ほとんどの腫瘍は良性です。興味深い ことに、悪性の可能性を正確に予測できる単一の病理的特徴(サイズ、有糸分裂率、血管や被膜の浸潤など)は存在しませんが、さまざまな予測アルゴリズムが作成されています。7 腫瘍の約10〜15%が転移性疾患を伴うか、または発症することがあり、これは悪性転換の兆候です。8 悪性ペクロモサイトーマの疾患特異的生存率は、監視・疫学・最終結果(SEER)データベースの解析に基づき、5年後に約70%と推定されています。9
褐色細胞腫の標準治療は外科的切除です。手術前に、患者はカテコールアミン遮断を受ける必要があり、通常は非選択的α受容体遮断薬フェノキシベンザミンまたは選択的α遮断薬(ドキサゾシン)を用いて行われます。追加の降圧薬、特にベータブロッカーが必要になる場合もあります。しかし、β遮断薬は、β受容体遮断薬による高血圧危機を防ぐために、患者がアルファ遮断薬を投与された後にのみ開始すべきです。さらに、患者は慢性的に脱水状態にあり、術前の人工蘇生が必要です。10
褐色細胞腫に罹患する患者は、重度の高血圧や、動悸、頭痛、パニック発作、透汗などの過剰なカテコールアミン産生の臨床症状を頻繁に経験します。11 血圧の薬は部分的な緩和をもたらすことがありますが、長期的かつ持続的な治療は原因病変の切除だけです。さらに、介入を続けない人は重度の高血圧危機のリスクがあり、死に至る可能性があります。12 したがって、褐色細胞腫の患者は迅速に外科的治療を受けるべきです。
両側性褐色細胞腫の患者では、皮質保存型副腎摘出術により、原因組織を切除する際に副腎機能不全の発生を防ぐことができます。過去の研究では、全副腎摘出術は非常に重症であることが示されています。例えば、Lairmore ら が発表したシリーズでは、両側性の褐色細胞腫に対して43人の患者が全副腎摘出術を受け、23%が副腎不全の発作を起こし、1人はアジソン危機で死亡しました。13 さらに、全副腎摘出術を受けた患者は生活の質が低下し、副腎不全に関連する頻繁な入院を報告しています。14
皮質保全副腎摘出術は、褐色細胞腫に関連する遺伝性症候群の患者にとって非常に貴重な選択肢です。これらの症候群にはMEN2、VHL、神経線維腫症1型(NF1)などが含まれます。両側性褐色細胞腫と診断された患者は遺伝子検査を紹介されるべきだという点に注意が必要です。カルシトニン検査は、遺伝子検査が実施され適切に解釈されるまでに数か月かかるため、MEN2患者を特定するのに役立つ補助手段となる可能性があります。MEN2AまたはVHLの患者の約40〜80%は両側性の褐色細胞腫を発症し、これらの腫瘍は通常良性です。したがって 、皮質を保つ副腎摘出術は影響を受けた組織を除去しつつ、副腎不全を防ぐために再発リスクを最小限に抑えるのに十分な組織を残すことができます。
皮質を保つ副腎摘出術の最初の症例は、1983年にIrvin ら によって記述されました。16 それ以降、一部の機関では、皮質を保つ副腎摘出術を開放的または低侵襲的アプローチで実施し、再発率が比較的低く、重要なのは副腎不全の発生率も低いと報告されています。 14 PRAの使用は、大量の内分泌外科医がこの技術を導入したことで増加しています。PRAは1995年に初めて記述され、その後ウォルツと彼の同僚たちの経験を通じてさらに発展しました。1、4、 17 PRAとLTAを比較した後ろ向き研究では、手術時間の短縮、出血量の減少、長期的な転帰に差がないことが示されています。
最近では、PRAは皮質を保つ副腎摘出術にも利用されています。最近のシリーズでは、両側性褐色細胞腫に対して25年間にわたりRPAアプローチを用いた皮質保存副腎切除術の経験が記述されました。66名の患者が手術を受け、合計101例の副腎摘出術が行われました。両側手術の平均手術時間は128分で、主要な合併症は2件のみ報告されました。89件で皮質を保つ手術を行うことができ、そのうち91%は術後にステロイドを必要としませんでした。持続的な疾患が認められた患者は1人のみで、再発は報告されていませんでした。18 患者には手術後に副腎不全の可能性があることを注意してください。これは残存副腎組織の大きさと血流の維持に依存します。一時的な副腎機能不全は内分泌科医と密に相談し、適切な検査を受けて管理されます。
この手術は全身麻酔下で気管挿管を行います。腫瘍による手術中の血行動態の変化のため、動脈ラインが血圧測定のために設置され、麻酔科医が必要に応じて血管活性薬を投与します。尿排出量を監視するためにフォーリーカテーテルが挿入されます。カテコールアミン上昇の度合いやその他の患者要因に応じて、追加の静脈アクセスと中心静脈圧のモニタリングのために中心静脈ラインを設置することができます。
全身麻酔誘導と気管挿管の後、患者は腰を90度曲げた伏せジャックナイフ姿勢に置かれます。クラワードテーブルとクラワード外科サドルは、腹部を依存的に垂らすために使われます。ジャックナイフ姿勢とクロワード外科サドルは後腹膜空間を開き、露出を最大化します。顔、腕、腰、脚を含むすべての圧迫点には十分なパッドが施されています。腸骨稜、第11および第12肋骨の先端、そして脊椎側筋の縁は、外科医によって重要なランドマークとして記されています。最初の切開は12肋骨の先端のすぐ下に位置します。ハサミは軟部組織を鋭く分け、後腹膜に侵入するために使われます。その後、外科医の指で鈍くスペースを開け、5mmポートを内側および横方向に誘導します。どちらも約30度の角度で副腎の位置に向けられます。その後、中央切開部に10mmバルーンポートを設置します。腹膜後部は高流量チューブを通じてCO2 で25 mmHgの吸気圧で満たされます。
5mmの30度スコープが10mmポートに挿入され、LigaSure装置で後腹膜空間を作り出します。解離はまず内側の副棘筋を特定し、その後腎臓を下位に特定します。その後、カメラは通常内側ポートに移動し、外科医は外側ポートと中央ポートからLigaSureデバイスと腸のグラーパーを使用します。解離は腎臓の上極を越え、副腎の方向に向かって脊髄側筋に沿って内側へと続きます。曝露は部分的に腎臓への下向き圧力によって促進されます。副腎が特定されると、その下部範囲と副腎静脈との関係が判明します。右側の解剖では、副腎を剥離して副腎静脈が現れる下腔内腔(IVC)が現れます。左側では副腎静脈が左腎静脈から発射されます。
この時点で、変異していない皮質副腎組織と原因腫瘍との正確な関係が判明します。これは、術前画像検査の詳細な評価と術中所見を組み合わせて判断される部分があります。時には術中超音波検査が役立つことがあります。適切な平面が特定されると、LigaSure装置で正常な副腎組織から褐色細胞腫を分離します。副腎は非常に血管が豊富であるため、切除時に止血に細心の注意を払います。この場合、先住民右副腎の下内側肢が保存に適していました。可能であれば、静脈は保存すべきです。しかし、これは必ずしも必要ではなく、また常に実現可能でもありません。なぜなら、小副腎動脈に沿って追加の静脈排液が行われるためです。現在の手術で副腎静脈が腫瘍に直接入っていることが判明し、クリップで分割されました。この時点で腫瘍の内側および外側の付着部が取り除かれ、上部付着部が残って腫瘍が垂れ下がり、逆牽引の上位部を提供します。外側および頭郭郭清の際は腹膜腔に入らないように注意が必要です。腫瘍を円周的に解離した後、上付着部を採取し、エンドキャッチ装置で腺を後腹膜空間から除去します。10mmポートは層状に閉じており、5mmポートは皮膚の高さでのみ閉じています。
最終病理では右5.2cmの褐色細胞腫と5.6cmの左側褐色細胞腫が認められました。術後初日に行われた検査では、コルチゾール産生が軽度に減少していることが示されました。そのため、患者は一時的に低用量の経口ステロイドを投与されました。患者は術後2日目に退院し、手術後2週間後にクリニックで良好な回復を得て、低用量プレドニゾンの減薬計画が立てられました。
アンドリューフレーム、クロワード外科用サドル、リガシュア装置、エンドキャッチ回収バッグ。
著者側には開示はありません。
この動画で言及されている患者は撮影に同意しており、情報や画像がオンラインで公開されることを認識しています。
References
- ヴァルツ・MK、パイトゲン・K、ホーアマン・R、ギーブラー・RM、マン・K、アイグラー・FW。副腎摘出術における新たな低侵襲アプローチとしての後方後腹部腹膜鏡検査:27名の患者における30件の副腎摘出術の結果。 ワールド・ジャーナル・サージ。 1996;20(7):769-774. doi:10.1007/s002689900117。
- キャレンダーGG、ケナマーDL、グラブスEG、リーJE、エヴァンスDB、ペリエND。後腹膜後視鏡副腎摘出術。 アドベンティブサージ。 2009;43(1):147-157. doi:10.1016/j.yasu.2009.02.017.
- ペリエND、ケンナマーDL、バオR他。後方後腹膜鏡下副腎摘出術:良性腫瘍および単離転移の除去に推奨される技術。 アン・サージ。 2008;248(4):666-674. doi:10.1097/SLA.0b013e31818a1d2a.
- Walz MK、Peitgen K、Walz MVら。後方後腹膜鏡副腎摘出術:5年以内に得た教訓。 ワールド・ジャーナル・サージ。 2001;25(6):728-734. doi:10.1007/s00268-001-0023-6。
- リー・JE、カーリーSA、ゲーゲルRF、エバンスDB、ヒッキーRC。両側性褐色細胞腫患者に対する皮質保容副腎摘出術。 手術。 1996;120(6):1064-1071. doi:10.1016/S0039-6060(96)80056-0。
- ファルルジア・FA、マルティコス・G、ツァネティス・Pら。褐色細胞腫、診断および治療:文献レビュー。 内分泌調節。 2017;51(3):168-181. DOI:10.1515/ENR-2017-0018。
- Thompson LD. 良性腫瘍と悪性腫瘍を分離するための副腎スケールドスコア(PASS)の色素細胞腫:100例の臨床病理学的および免疫表現型研究。 私は外科病理学のジャーナルです。 2002;26(5):551-566. doi:10.1097%2F00000478-200205000-00002。
- パチャク・K、ウィマラワンサSJ。褐色細胞腫と副神経節腫。内分泌科。2015;21(4):406-412.DOI:10.4158/EP14481。RA。
- ゴフレドP、ソーサJA、ローマンSA。悪性褐色細胞腫および副神経節腫:20年以上の長期生存の集団レベル分析。 J Surg Oncol。 2013;107(6):659-664. doi:10.1002/jso.23297。
- Li J, Yang CH. 副腎褐色細胞腫患者における術前管理の改善。 国際臨床経験医学。 2014;7(12):5541-5546. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4307515。
- チェンH、シッペルRS、オドリシオMS、ヴィニクAI、ロイドRV、パチャクK;北米神経内分泌腫瘍学会(NANETS)。北米神経内分泌腫瘍学会の神経内分泌腫瘍(褐色細胞腫、副神経節腫、髄質性甲状腺がん)の診断および管理に関するコンセンサスガイドライン。 膵臓。 2010;39(6):775-783. doi:10.1097/MPA.0b013e3181ebb4f0.
- サットン MG、シェップス SG、リー JT。臨床的に疑われていない褐色細胞腫の有病率:50年間の解剖シリーズのレビュー。 メイヨー・クリン・プロック。 1981;56(6):354-360.
- Lairmore TC、Ball DW、Baylin SB、Wells SA Jr. 多発性内分泌腫瘍タイプ2症候群患者における褐色細胞腫の管理。 アン・サージ。 1993;217(6):595-603. DOI:10.1097/00000658-199306000-00001。
- Walz MK. 副腎腫瘍に対する副腎摘出の範囲:皮質保留(サブトータル)と全副腎摘出術。 サージ・クリン・ノースAM。 2004;84(3):743-753. DOI:10.1016/J.SUC.2004.01.003.
- レナードJ、クレリチT、リッカーM、トリポネズF. 褐色細胞腫および腹部副神経節腫。 J Visc Surg。 2011;148巻6号:e409-e416。 doi:10.1016/j.jviscsurg.2011.07.003.
- アーヴィンGL 3位、フィッシュマンLM、シャーJA。家族性褐色細胞腫。 手術。 1983;94(6):938-940. https://www.surgjournal.com/article/0039-6060(83)90403-8/全文。
- メルカン・S、セブン・R、オザールマガン・S、テゼルマン・S. 内視鏡的後腹膜副腎摘出術。 手術。 1995;118(6):1071-1076. doi:10.1016/S0039-6060(05)80116-3。
- アレシナPF、ヒンリッヒスJ、マイヤーB、シュミットKW、ノイマンHP、ヴァルツMK。両側性褐色細胞腫に対する低侵襲皮質保存手術。 ランゲンベックスアーチサージ。 2012;397(2):233-238. DOI:10.1007/S00423-011-0851-2。
Cite this article
ブラウン TC、カーリング T. 右側皮質保存を伴う両側後方後腹膜鏡下副腎摘出術。 J Med Insight。 2021;2021(282). DOI:10.24296/jomi/282。