Adrenalectomía retroperitoneoscópica posterior bilateral con preservación cortical en el lado derecho
Main Text
Table of Contents
La adrenalectomía con preservación cortical permite la resección de los tumores suprarrenales mientras se preserva el tejido suprarrenal no afectado para prevenir la insuficiencia suprarrenal. Esto es especialmente importante en pacientes afectados con tumores suprarrenales bilaterales, generalmente feocromocitomas.
La adrenalectomía retroperitoneoscópica posterior (ARP) permite un abordaje mínimamente invasivo para la resección de la glándula suprarrenal en comparación con la adrenalectomía transabdominal laparoscópica más tradicional y los abordajes abiertos. La técnica PRA es cada vez más utilizada por cirujanos endocrinos de alto volumen en todo el mundo. Este abordaje es ideal para tratar a los pacientes con enfermedad bilateral y se utilizó en este caso de un paciente que presentaba feocromocitomas bilaterales en el contexto del síndrome de neoplasia endocrina múltiple 2A.
La adrenalectomía retroperitonescópica posterior (PRA) fue popularizada por primera vez en Alemania por Walz y sus colegas. Se accede a las glándulas suprarrenales a través de un abordaje retroperitoneal mediante instrumentación laparoscópica e insuflación de CO2 . 1 Al hacerlo, el cirujano evita la entrada en la cavidad peritoneal y la movilización de las vísceras circundantes, incluyendo el intestino, el hígado, el bazo y el páncreas. En comparación con los abordajes de adrenalectomía transabdominal (LTA) abierta y laparoscópica, esta técnica promueve la recuperación del paciente con una menor duración de la estadía, menos dolor y menor riesgo de íleo. 2-4
Una de las ventajas de la PRA es que permite el acceso bilateral a ambas glándulas suprarrenales a través de un abordaje mínimamente invasivo sin necesidad de reposicionar al paciente durante las operaciones. 2 Los pacientes que presentan tumores suprarrenales bilaterales, por lo general feocromocitomas debidos a Von Hippel Lindau (VHL) o síndrome de neoplasia endocrina múltiple tipo 2 (NEM2), son candidatos ideales para este abordaje. En ambos procesos patológicos, es frecuente la aparición de tumores bilaterales. Como tal, los pacientes pueden requerir adrenalectomías bilaterales para lograr una cura bioquímica.
Con el fin de prevenir la insuficiencia suprarrenal aguda postoperatoria (crisis de Addison), se puede realizar una adrenalectomía con preservación cortical. Durante este procedimiento, se extirpa el tejido tumoral culpable mientras se conserva el tejido suprarrenal normal. 5 Tradicionalmente, esta técnica se ha descrito junto con los enfoques abiertos y LTA; sin embargo, en el caso de las enfermedades bilaterales, el enfoque de la ARP se utiliza cada vez con más éxito.
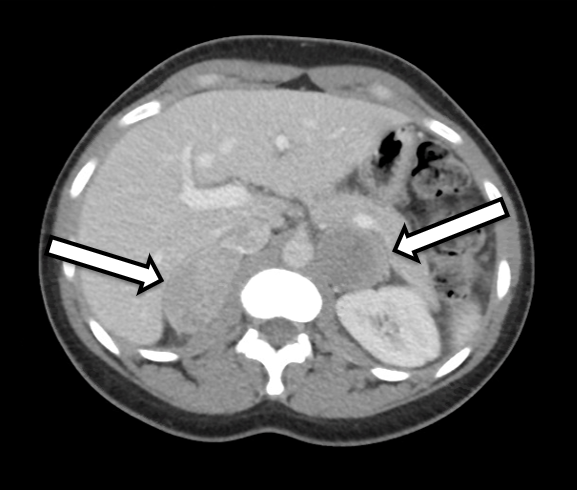
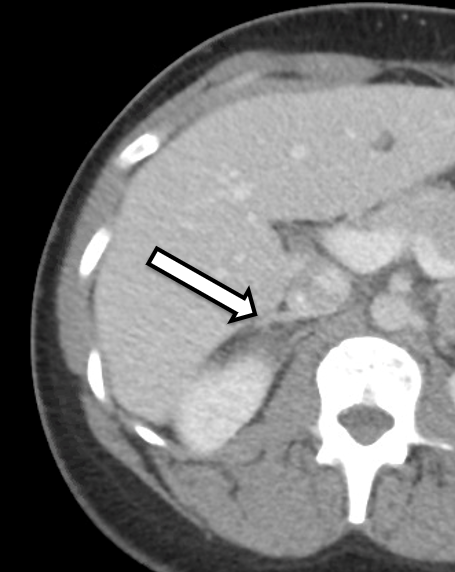
Se trata de una mujer de 31 años que presentó feocromocitomas bilaterales bioquímicamente inequívocos. Tenía síntomas de hipertensión y palpitaciones, lo que provocó una investigación adicional por parte de su médico de atención primaria. Su evaluación de laboratorio fue significativa para metanefrinas plasmáticas libres elevadas a 642 pg/ml (rango de referencia < 57 pg/mL) y normetanefrina a 2284 pg/ml (referencia < 148 pg/ml), así como metanefrinas urinarias elevadas, compatibles con un feocromocitoma. Las imágenes transversales incluyeron una tomografía computarizada del abdomen con contraste intravenoso. La TC reveló nódulos suprarrenales bilaterales con unidades de Hounsfield precontraste y características generales de imagen del feocromocitoma bilateral (Figura 1). Una revisión minuciosa de sus imágenes demostró que el tejido de la corteza suprarrenal en el lado derecho (Figura 2) de apariencia normal sería propicio para la adrenalectomía con preservación cortical en este lado.
Debido a su corta edad y a la presencia de tumores bilaterales, se investigó más a fondo para detectar otros tumores asociados a la NEM2A, específicamente el cáncer medular de tiroides y el hiperparatiroidismo primario. De hecho, se encontró que tenía un nivel elevado de calcitonina sérica de 229 pg/ml (referencia < 5 pg/ml), y los hallazgos de la ecografía y la aspiración con aguja fina fueron compatibles con carcinoma medular de tiroides del lóbulo tiroideo derecho. Sus niveles séricos de hormona paratiroidea intacta y calcio no eran notables.
La tomografía computarizada y la resonancia magnética son las principales técnicas radiológicas utilizadas para obtener imágenes de las glándulas suprarrenales normales y anormales. En la TC, los feocromocitomas a menudo están bien definidos a partir de los tejidos circundantes y, por lo general, muestran unidades de Hounsfield previas al contraste de 30–40. Las lesiones más pequeñas tienden a parecer simples y sólidas, mientras que las lesiones más grandes pueden tener características más quísticas, así como otras características complejas. En la resonancia magnética, los feocromocitomas tienen una apariencia clásica de "bombilla" en las imágenes ponderadas en T2. También se pueden obtener imágenes funcionales, especialmente cuando la enfermedad metastásica es una preocupación. El método más común es el uso de 131 I- y 123 I-metayodobencilguanidina (MIBG), que es un análogo de la norepinefrina y se localiza preferentemente en los tejidos simpathomedulares. 6
Preferimos que el paciente se someta a una TC o una resonancia magnética del protocolo suprarrenal dentro de aproximadamente 3 a 6 meses después de la operación para la planificación operatoria. En este caso, el paciente fue remitido a nosotros tras una TAC que mostraba masas suprarrenales bilaterales con características imagenológicas sospechosas de feocromocitoma. En una revisión detallada de sus imágenes, se evidenció que la extremidad medial inferior de la glándula suprarrenal derecha tenía tejido de la corteza suprarrenal no afectado que podría conservarse potencialmente durante la resección.
Los feocromocitomas se originan a partir de las células de la cresta neural de la médula suprarrenal y secretan cantidades excesivas de catecolaminas. La prevalencia general de feocromocitomas se ha estimado entre 1:6500 y 1:2500, con una edad promedio de inicio entre 40 y 50 años y una prevalencia ligeramente mayor en las mujeres. La mayoría de los tumores son benignos. 6 Curiosamente, no existe una sola característica patológica, incluyendo el tamaño, la tasa mitótica o la invasión vascular o capsular, que pueda predecir con precisión el potencial maligno, aunque se han creado varios algoritmos predictivos. 7 Aproximadamente el 10-15% de los tumores pueden presentar y/o desarrollar enfermedad metastásica, indicativa de transformación maligna. 8 Se ha calculado que la supervivencia específica de la enfermedad para los feocromocitomas malignos es de alrededor de 70 % a 5 años según el análisis de la base de datos Surveillance, Epidemiology, and End Results (SEER). 9
El tratamiento estándar para los feocromocitomas es la resección quirúrgica. Antes de la operación, el paciente debe someterse a un bloqueo de catecolaminas, que generalmente se realiza utilizando el bloqueador no selectivo de los receptores alfa fenoxibenzamina o un bloqueador alfa selectivo como la doxazosina. También pueden ser necesarios agentes antihipertensivos adicionales, incluidos los betabloqueantes. Sin embargo, los betabloqueantes solo deben iniciarse después de que un paciente haya recibido alfabloqueantes para prevenir una crisis hipertensiva causada por un bloqueo de los receptores beta sin oposición. Además, los pacientes están crónicamente deshidratados y requieren reanimación preoperatoria con líquidos. 10
Los pacientes afectados por feocromocitomas frecuentemente sufren episodios de hipertensión grave y otras manifestaciones clínicas de producción excesiva de catecolaminas, incluyendo palpitaciones, cefaleas, ataques de pánico y diaforesis. 11 Si bien los medicamentos para la presión arterial pueden proporcionar un alivio parcial, el único tratamiento duradero a largo plazo es la resección de las lesiones culpables. Además, aquellos que continúan sin intervención corren el riesgo de sufrir crisis hipertensivas graves, que pueden provocar la muerte. 12 Por lo tanto, los pacientes con feocromocitomas deben buscar tratamiento quirúrgico de manera expedita.
En los pacientes que presentan feocromocitomas bilaterales, la adrenalectomía con preservación cortical puede prevenir la aparición de insuficiencia suprarrenal mientras se reseca el tejido culpable. Estudios previos han demostrado que la adrenalectomía total puede ser altamente mórbida. Por ejemplo, en una serie publicada por Lairmore et al. en la que 43 pacientes se sometieron a adrenalectomía completa por feocromocitomas bilaterales, el 23% sufrió episodios de insuficiencia suprarrenal y un paciente murió de una crisis de Addison. 13 Además, los pacientes que se han sometido a una adrenalectomía total reportan una mala calidad de vida y hospitalizaciones frecuentes relacionadas con la insuficiencia suprarrenal. 14
La adrenalectomía con preservación cortical es una opción invaluable para los pacientes con síndromes genéticos asociados con feocromocitomas. Estos síndromes incluyen NEM2, VHL y neurofibromatosis tipo 1 (NF1), entre otros. Es importante tener en cuenta que los pacientes diagnosticados con feocromocitomas bilaterales deben ser remitidos para pruebas genéticas. Las pruebas de calcitonina pueden ser un complemento útil para identificar a los pacientes con NEM2, ya que las pruebas genéticas pueden tardar varios meses en realizarse e interpretarse correctamente. Alrededor del 40–80 % de los pacientes con NEM2A o VHL presentarán feocromocitomas bilaterales, y estos tumores suelen ser benignos. 15 Como tal, la adrenalectomía con preservación cortical puede eliminar el tejido afectado, mientras deja suficiente tejido para prevenir la insuficiencia suprarrenal con un riesgo mínimo de recurrencia.
El primer caso de adrenalectomía con preservación cortical fue descrito por Irvin et al. en 1983. 16 Desde entonces, algunas instituciones han reportado éxito en la realización de adrenalectomía con preservación cortical a través de abordajes abiertos o mínimamente invasivos con tasas de recurrencia bastante bajas y, lo que es más importante, una baja incidencia de insuficiencia suprarrenal. 14 El uso de la PRA ha ido en aumento a medida que los cirujanos endocrinos de alto volumen han implementado esta técnica. La PRA se describió por primera vez en 1995 y luego se desarrolló aún más a través de la experiencia de Walz y sus colegas. 1, 4, 17 Los estudios retrospectivos que comparan la PRA con la LTA muestran una disminución de los tiempos quirúrgicos, una disminución de la pérdida de sangre y ninguna diferencia en los resultados a largo plazo.
Más recientemente, la PRA también se está utilizando para la adrenalectomía con preservación cortical. En una serie reciente, se describió la experiencia durante un período de 25 años de realizar adrenalectomías con preservación cortical para feocromocitomas bilaterales mediante el abordaje de RPA. Sesenta y seis pacientes fueron intervenidos y se realizaron un total de 101 adrenalectomías. El tiempo operatorio promedio fue de 128 minutos para las cirugías bilaterales y solo reportaron dos complicaciones mayores. Pudieron realizar una operación de preservación cortical en 89 de los casos y de esos pacientes, el 91% no requirió esteroides en el postoperatorio. Solo un paciente presentó enfermedad persistente, mientras que no se reportaron recidivas. 18 Se debe advertir a los pacientes que podrían tener alguna insuficiencia suprarrenal después de la cirugía. Esto depende del tamaño del tejido suprarrenal remanente y de la preservación del flujo sanguíneo. La insuficiencia suprarrenal temporal se maneja en estrecha consulta con endocrinología y pruebas de laboratorio adecuadas.
El procedimiento se realiza bajo anestesia general con intubación endotraqueal. Debido a las alteraciones hemodinámicas que pueden ocurrir durante la cirugía debido al tumor, se coloca una vía arterial para el monitoreo de la presión arterial y el anestesiólogo administra medicamentos vasoactivos según sea necesario. Se coloca un catéter de Foley para controlar la diuresis. Dependiendo del grado de elevación de la catecolamina y otros factores del paciente, se puede colocar una vía venosa central para el acceso venoso adicional y la monitorización de la presión venosa central.
Después de la inducción de la anestesia general y la intubación endotraqueal, el paciente se coloca en una posición prona con las caderas dobladas a 90 grados. Se utiliza una mesa Cloward con una silla de montar quirúrgica Cloward para permitir que el abdomen cuelgue de manera dependiente. La posición de la navaja y la silla de montar quirúrgica Cloward abren el espacio retroperitoneal para maximizar la exposición. Todos los puntos de presión, incluidos la cara, los brazos, las caderas y las piernas, están ampliamente acolchados. La cresta ilíaca, las puntas de las costillas 11 y 12 y el borde de los músculos paraespinosos son puntos de referencia importantes marcados por el cirujano. La incisión inicial se coloca justo debajo de la punta de la 12ª costilla. Las tijeras se utilizan para dividir bruscamente el tejido blando e introducirlo en el retroperitoneo. A continuación, se utiliza el dedo del cirujano para despejar el espacio sin rodeos y guiar la colocación de un puerto de 5 mm medial y lateralmente, ambos con un ángulo de unos 30 grados y dirigidos hacia la posición de la glándula suprarrenal. A continuación, se coloca un puerto de globo de 10 mm en la incisión central. El retroperitoneo se insufla con CO2 a través de un tubo de alto flujo a una presión de insuflación de 25 mmHg.
En el puerto de 10 mm se inserta un endoscopio de 5 mm y 30 grados, y se utiliza un dispositivo LigaSure para crear el espacio retroperitoneal. La disección comienza con la identificación medial de los músculos paraespinosos, a la que sigue la identificación del riñón inferior. A continuación, la cámara suele trasladarse al puerto medial y el cirujano utiliza un dispositivo LigaSure y una pinza intestinal a través de los puertos lateral y central, respectivamente. La disección continúa sobre el polo superior del riñón y a lo largo de los músculos paraespinales medialmente, en dirección a la glándula suprarrenal. La exposición se ve facilitada en parte por la presión descendente sobre el riñón. A medida que se identifica la glándula suprarrenal, se determina la extensión inferior de la glándula y su relación con la vena suprarrenal. A la derecha, esta disección revela la VCI, de la que se diseca la glándula suprarrenal para revelar la vena suprarrenal. A la izquierda, la vena suprarrenal se origina en la vena renal izquierda.
En este punto, se determina la relación precisa del tejido suprarrenal cortical inalterado con el tumor culpable. Esto se determina en parte por una evaluación detallada de las imágenes preoperatorias junto con los hallazgos intraoperatorios. En ocasiones, la ecografía intraoperatoria puede ser útil. Una vez que se identifica un plano adecuado, el feocromocitoma se divide del tejido suprarrenal normal con un dispositivo LigaSure. La glándula suprarrenal es una glándula altamente vascularizada, por lo que se presta una atención meticulosa a la hemostasia a medida que se secciona la glándula. En este caso, la extremidad medial inferior de la glándula suprarrenal derecha nativa era adecuada para la preservación. Si es posible, se debe preservar la vena. Sin embargo, esto no es necesario, ni siempre es factible, dado que hay drenaje venoso adicional a lo largo de las pequeñas arterias suprarrenales. Durante la operación actual, se encontró que la vena suprarrenal ingresaba directamente al tumor y, como tal, se dividió con clips. En este punto, se retiran las inserciones medial y lateral del tumor, dejando la inserción superior para permitir que el tumor cuelgue y proporcione un sitio superior de contratracción. Se tiene cuidado de no entrar en la cavidad peritoneal durante las disecciones lateral y cefálica. Una vez que el tumor se ha diseccionado circunferencialmente, se toman las inserciones superiores y se extirpa la glándula del espacio retroperitoneal con un dispositivo Endocatch. El puerto de 10 mm se cierra en capas, mientras que los sitios de puerto de 5 mm se cierran solo a nivel de la piel.
La anatomía patológica final reveló un feocromocitoma derecho de 5,2 cm y un feocromocitoma izquierdo de 5,6 cm. Las pruebas realizadas en el primer día postoperatorio demostraron una leve disminución de la producción de cortisol. Como tal, el paciente fue colocado temporalmente con una dosis baja de esteroides orales. La paciente fue dada de alta en el segundo día postoperatorio con una excelente recuperación cuando fue atendida en la clínica dos semanas después de su operación, con un plan para dejar la dosis baja de prednisona.
Marco Andrew, silla de montar quirúrgica Cloward, dispositivo LigaSure y bolsa de recuperación Endocatch.
Los autores no tienen divulgaciones.
El paciente al que se refiere este artículo en vídeo ha dado su consentimiento informado para ser filmado y es consciente de que la información y las imágenes se publicarán en línea.
References
- Walz MK, Peitgen K, Hoermann R, Giebler RM, Mann K, Eigler FW. Retroperitoneoscopia posterior como nuevo abordaje mínimamente invasivo para la adrenalectomía: resultados de 30 adrenalectomías en 27 pacientes. Mundo J Surg. 1996;20(7):769-774. doi:10.1007/s002689900117.
- Callender GG, Kennamer DL, Grubbs EG, Lee JE, Evans DB, Perrier ND. Adrenalectomía retroperitoneoscópica posterior. Adv Surg. 2009;43(1):147-157. doi:10.1016/j.yasu.2009.02.017.
- Perrier ND, Kennamer DL, Bao R, et al. Adrenalectomía retroperitoneoscópica posterior: técnica preferida para la extirpación de tumores benignos y metástasis aisladas. Ana Surg. 2008;248(4):666-674. doi:10.1097/SLA.0b013e31818a1d2a.
- Walz MK, Peitgen K, Walz MV, et al. Adrenalectomía retroperitoneoscópica posterior: lecciones aprendidas en cinco años. Mundo J Surg. 2001;25(6):728-734. doi:10.1007/s00268-001-0023-6.
- Lee JE, Curley SA, Gagel RF, Evans DB, Hickey RC. Adrenalectomía cortical-conservadora para pacientes con feocromocitoma bilateral. Cirugía. 1996;120(6):1064-1071. doi:10.1016/S0039-6060(96)80056-0.
- Farrugia FA, Martikos G, Tzanetis P, et al. Feocromocitoma, diagnóstico y tratamiento: revisión de la literatura. Endocr Regul. 2017;51(3):168-181. doi:10.1515/enr-2017-0018.
- Thompson LD. Pheochromocytoma of the Adrenal gland Scaled Score (PASS) to separate benign of malignant neoplasms: a clinicopathologic and immunophenotypic study of 100 cases. Am J Surg Pathol. 2002;26(5):551-566. doi:10.1097%2F00000478-200205000-00002.
- Pacak K, Wimalawansa SJ. Feocromocitoma y paraganglioma. Endocr Pract. 2015;21(4):406-412. doi:10.4158/EP14481. RA.
- Goffredo P, Sosa JA, Román SA. Feocromocitoma maligno y paraganglioma: un análisis a nivel poblacional de la supervivencia a largo plazo durante dos décadas. J Surg Oncol. 2013;107(6):659-664. doi:10.1002/jso.23297.
- Li J, Yang CH. Mejora del manejo preoperatorio en pacientes con feocromocitoma suprarrenal. Int J Clin Exp Med. 2014;7(12):5541-5546. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4307515.
- Chen H, Sippel RS, O'Dorisio MS, Vinik AI, Lloyd RV, Pacak K; Sociedad Norteamericana de Tumores Neuroendocrinos (NANETS). La guía de consenso de la Sociedad Norteamericana de Tumores Neuroendocrinos para el diagnóstico y tratamiento de tumores neuroendocrinos: feocromocitoma, paraganglioma y cáncer medular de tiroides. Páncreas. 2010;39(6):775-783. doi:10.1097/MPA.0b013e3181ebb4f0.
- Sutton MG, Sheps SG, Lie JT. Prevalencia de feocromocitoma clínicamente insospechado: revisión de una serie de autopsias a 50 años. Mayo Clin Proc. 1981;56(6):354-360.
- Lairmore TC, Ball DW, Baylin SB, Wells SA Jr. Manejo de feocromocitomas en pacientes con síndromes de neoplasia endocrina múltiple tipo 2. Ana Surg. 1993;217(6):595-603. doi:10.1097/00000658-199306000-00001.
- Walz MK. Extensión de la adrenalectomía para la neoplasia suprarrenal: preservación cortical (subtotal) versus adrenalectomía total. Surg Clin Norte Am. 2004;84(3):743-753. doi:10.1016/j.suc.2004.01.003.
- Renard J, Clerici T, Licker M, Triponez F. Feocromocitoma y paraganglioma abdominal. J Visc Surg. 2011;148(6):e409-e416. doi:10.1016/j.jviscsurg.2011.07.003.
- Irvin GL 3º, Fishman LM, Sher JA. Feocromocitoma familiar. Cirugía. 1983;94(6):938-940. https://www.surgjournal.com/article/0039-6060(83)90403-8/texto completo.
- Mercan S, Seven R, Ozarmagan S, Tezelman S. Adrenalectomía retroperitoneal endoscópica. Cirugía. 1995;118(6):1071-1076. doi:10.1016/S0039-6060(05)80116-3.
- Alesina PF, Hinrichs J, Meier B, Schmid KW, Neumann HP, Walz MK. Cirugía mínimamente invasiva con preservación cortical para feocromocitomas bilaterales. Langenbecks Arch Surg. 2012;397(2):233-238. doi:10.1007/s00423-011-0851-2.
Cite this article
Brown TC, Carling T. Adrenalectomía retroperitoneoscópica posterior bilateral con preservación cortical en el lado derecho. J Med Insight. 2021;2021(282). doi:10.24296/jomi/282.