Bilaterale posteriore retroperitoneoskopische Adrenalektomie mit kortikaler Schonung auf der rechten Seite
Main Text
Table of Contents
Die kortikalschonende Adrenalektomie ermöglicht die Resektion von Nebennierentumoren unter Beibehaltung des nicht betroffenen Nebennierengewebes, um eine Nebenniereninsuffizienz zu verhindern. Dies ist besonders wichtig bei Patienten mit beidseitigen Nebennierentumoren, typischerweise Phäochromozytomen.
Die posteriore retroperitoneoskopische Adrenalektomie (PRA) ermöglicht einen minimalinvasiven Ansatz zur Nebennierenresektion im Vergleich zur traditionelleren laparoskopischen transabdominalen Adrenalektomie und offenen Zugängen. Die PRA-Technik wird zunehmend von endokrinen Chirurgen mit hohem Volumen auf der ganzen Welt eingesetzt. Dieser Ansatz ist ideal für Patienten mit bilateraler Erkrankung und wurde in diesem Fall eines Patienten mit bilateralen Phäochromozytomen im Rahmen des multiplen endokrinen Neoplasie-2A-Syndroms verwendet.
Die posteriore retroperitoneoskopische Adrenalektomie (PRA) wurde in Deutschland erstmals von Walz und Kollegen populär gemacht. Der Zugang zu den Nebennieren erfolgt über einen retroperitonealen Zugang mit laparoskopischen Instrumenten und CO2 -Insufflation. 1 Auf diese Weise vermeidet der Chirurg den Eintritt in die Bauchhöhle und die Mobilisierung der umliegenden Eingeweide, einschließlich Darm, Leber, Milz und Bauchspeicheldrüse. Im Vergleich zu offenen und laparoskopischen transabdominalen Adrenalektomieansätzen (LTA) fördert diese Technik die Genesung des Patienten mit verkürzter Aufenthaltsdauer, weniger Schmerzen und einem geringeren Ileusrisiko. 2-4
Einer der Vorteile von PRA besteht darin, dass es einen beidseitigen Zugang zu beiden Nebennieren über einen minimal-invasiven Ansatz ermöglicht, ohne dass der Patient während der Operationen neu positioniert werden muss. 2 Patienten mit beidseitigen Nebennierentumoren, typischerweise Phäochromozytomen aufgrund des Von-Hippel-Lindau-Syndroms (VHL) oder des multiplen endokrinen Neoplasien-Typ-2-Syndroms (MEN2), sind ideale Kandidaten für diesen Ansatz. Bei beiden Krankheitsverläufen kommt es häufig zu bilateralen Tumoren. Daher kann es sein, dass Patienten eine bilaterale Adrenalektomie benötigen, um eine biochemische Heilung zu erreichen.
Um ein postoperatives akutes Nebennierenversagen (Addison-Krise) zu verhindern, kann eine kortikal-schonende Adrenalektomie durchgeführt werden. Bei diesem Eingriff wird das verursacherliche Tumorgewebe entfernt, während das normale Nebennierengewebe erhalten bleibt. 5 Traditionell wurde diese Technik neben offenen und LTA-Ansätzen beschrieben; Bei bilateralen Erkrankungen wird der PRA-Ansatz jedoch zunehmend mit Erfolg eingesetzt.
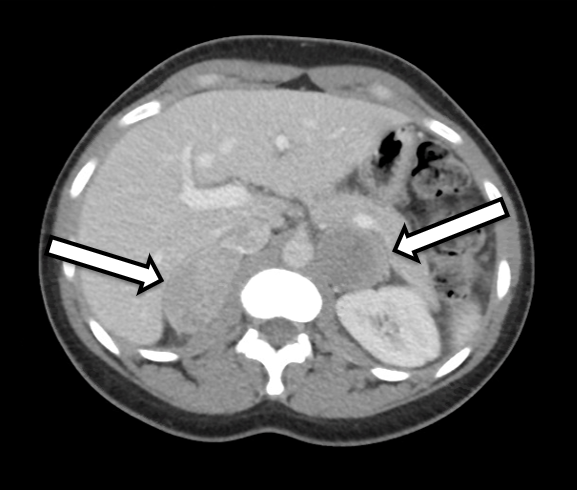
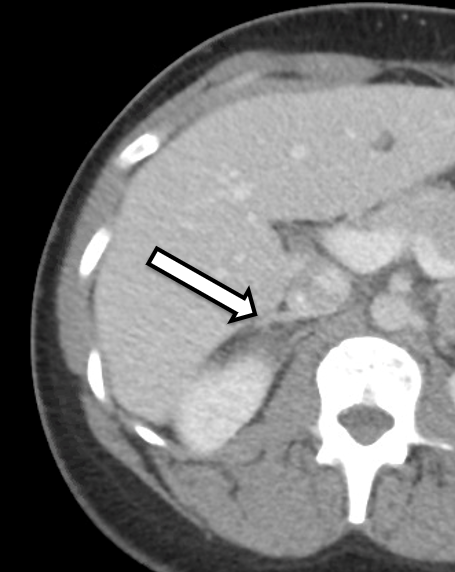
Bei der Patientin handelt es sich um eine 31-jährige Frau, die biochemisch eindeutige bilaterale Phäochromozytome aufwies. Sie hatte Symptome von Bluthochdruck und Herzklopfen, was zu weiteren Untersuchungen durch ihren Hausarzt führte. Ihre Laboruntersuchung war signifikant für erhöhte Metanephrine im freien Plasma bei 642 pg/ml (Referenzbereich < 57 pg/ml) und Normetanephrin bei 2284 pg/ml (Referenz < 148 pg/ml) sowie für erhöhte Metanephrine im Urin, was mit einem Phäochromozytom übereinstimmt. Die Schnittbildgebung umfasste eine CT des Abdomens mit IV-Kontrastmittel. Die CT zeigte bilaterale Nebennierenknoten mit Präkontrast-Hounsfield-Einheiten und allgemeine bildgebende Merkmale des bilateralen Phäochromozytoms (Abbildung 1). Eine genaue Überprüfung ihrer Bildgebung zeigte normal erscheinendes Nebennierenrindengewebe auf der rechten Seite (Abbildung 2), das für eine kortikalschonende Adrenalektomie auf dieser Seite förderlich wäre.
Aufgrund ihres jungen Alters und des Vorhandenseins bilateraler Tumoren wurde sie weiter auf andere MEN2A-assoziierte Tumoren untersucht, insbesondere auf medullären Schilddrüsenkrebs und primären Hyperparathyreoidismus. Es wurde tatsächlich ein erhöhter Serum-Calcitonin-Spiegel von 229 pg/ml (Referenz < 5 pg/ml) festgestellt, und die Befunde des Ultraschalls und der Feinnadelaspiration stimmten mit einem medullären Schilddrüsenkarzinom des rechten Schilddrüsenlappens überein. Ihr intaktes Serum, ihr Parathormon- und Kalziumspiegel waren unauffällig.
CT und MRT sind die primären radiologischen Techniken, die zur Darstellung normaler und abnormaler Nebennieren verwendet werden. In der CT sind Phäochromozytome oft gut vom umgebenden Gewebe abgegrenzt und weisen typischerweise Vorkontrast-Hounsfield-Einheiten von 30–40 auf. Kleinere Läsionen neigen dazu, einfach und solide zu erscheinen, während größere Läsionen eher zystische Eigenschaften sowie andere komplexe Merkmale aufweisen können. In der MRT haben Phäochromozytome auf T2-gewichteten Bildern ein klassisches "Glühbirnen"-Aussehen. Eine funktionelle Bildgebung kann ebenfalls durchgeführt werden, insbesondere wenn eine metastasierende Erkrankung ein Problem darstellt. Die gebräuchlichste Methode ist die Verwendung von 131 I- und 123 I-Metaiodobenzylguanidin (MIBG), einem Analogon von Noradrenalin, das bevorzugt in sympathomedullären Geweben lokalisiert ist. 6
Wir bevorzugen es, dass sich der Patient innerhalb von ca. 3-6 Monaten nach der Operation entweder einer Nebennieren-CT oder einer MRT für die Operationsplanung unterzieht. In diesem Fall wurde der Patient an uns überwiesen, nachdem er ein CT hatte, das beidseitige Nebennierenmassen mit bildgebenden Merkmalen zeigte, die für ein Phäochromozytom verdächtig waren. In einer detaillierten Übersichtsarbeit bzw. ihrer Bildgebung zeigte sich, dass die untere mediale Extremität der rechten Nebenniere nicht betroffenes Nebennierenrindengewebe aufwies, das möglicherweise während der Resektion erhalten bleiben könnte.
Phäochromozytome entspringen den Neuralleistenzellen des Nebennierenmarks und sezernieren überschüssige Mengen an Katecholaminen. Die Gesamtprävalenz von Phäochromozytomen wurde auf 1:6500 bis 1:2500 geschätzt, mit einem durchschnittlichen Erkrankungsalter zwischen 40 und 50 Jahren und einer etwas höheren Prävalenz bei Frauen. Die meisten Tumoren sind gutartig. 6 Interessanterweise gibt es kein einzelnes pathologisches Merkmal, einschließlich Größe, Mitoserate oder Gefäß- oder Kapselinvasion, das das maligne Potenzial genau vorhersagen kann, obwohl verschiedene Vorhersagealgorithmen entwickelt wurden. 7 Etwa 10–15 % der Tumoren können eine metastasierende Erkrankung aufweisen und/oder entwickeln, was auf eine maligne Transformation hinweist. 8 Das krankheitsspezifische Überleben bei malignen Phäochromozytomen wurde auf der Grundlage einer Analyse der Datenbank Surveillance, Epidemiology, and End Results (SEER) nach 5 Jahren auf etwa 70 % geschätzt. 9
Die Standardbehandlung von Phäochromozytomen ist die chirurgische Resektion. Vor der Operation muss sich der Patient einer Katecholaminblockade unterziehen, die in der Regel mit dem nichtselektiven Alpha-Rezeptorblocker Phenoxybenzamin oder einem selektiven Alpha-Blocker wie Doxazosin durchgeführt wird. Möglicherweise sind auch zusätzliche blutdrucksenkende Mittel, einschließlich Betablocker, erforderlich. Betablocker sollten jedoch erst begonnen werden, nachdem ein Patient auf Alpha-Blocker gesetzt wurde, um eine hypertensive Krise zu verhindern, die durch eine unwidersprochene Beta-Rezeptor-Blockade verursacht wird. Darüber hinaus sind die Patienten chronisch dehydriert und benötigen eine präoperative Flüssigkeitswiederbelebung. 10
Patienten, die von Phäochromozytomen betroffen sind, leiden häufig unter Episoden schwerer Hypertonie und anderen klinischen Manifestationen einer übermäßigen Katecholaminproduktion, einschließlich Herzklopfen, Kopfschmerzen, Panikattacken und Schwitzen. 11 Während Blutdruckmedikamente eine teilweise Linderung verschaffen können, ist die einzige langfristige, dauerhafte Behandlung die Resektion der schuldigen Läsion(en). Darüber hinaus besteht bei denjenigen, die ohne Intervention weitermachen, das Risiko schwerer hypertensiver Krisen, die möglicherweise zum Tod führen. 12 Daher sollten Patienten mit Phäochromozytomen umgehend eine chirurgische Behandlung in Anspruch nehmen.
Bei Patienten mit bilateralen Phäochromozytomen kann die kortikal-schonende Adrenalektomie das Auftreten einer Nebenniereninsuffizienz verhindern, während das verursacherliche Gewebe reseziert wird. Frühere Studien haben gezeigt, dass die totale Adrenalektomie sehr morbide sein kann. In einer von Lairmore et al. veröffentlichten Serie zum Beispiel, in der sich 43 Patienten einer vollständigen Adrenalektomie wegen bilateraler Phäochromozytome unterzogen, erlitten 23% Episoden von Nebenniereninsuffizienz und ein Patient starb an einer Addison-Krise. 13 Darüber hinaus berichten Patienten, die sich einer totalen Adrenalektomie unterzogen haben, über eine schlechte Lebensqualität und häufige Krankenhausaufenthalte im Zusammenhang mit Nebenniereninsuffizienz. 14
Die kortikalschonende Adrenalektomie ist eine unschätzbare Option für Patienten mit genetischen Syndromen, die mit Phäochromozytomen assoziiert sind. Zu diesen Syndromen gehören unter anderem MEN2, VHL und Neurofibromatose Typ 1 (NF1). Es ist wichtig zu beachten, dass Patienten, bei denen bilaterale Phäochromozytome diagnostiziert wurden, für genetische Tests überwiesen werden sollten. Calcitonin-Tests können eine hilfreiche Ergänzung zur Identifizierung von Patienten mit MEN2 sein, da es mehrere Monate dauern kann, bis Gentests durchgeführt und richtig interpretiert werden. Etwa 40–80 % der Patienten mit MEN2A oder VHL entwickeln bilaterale Phäochromozytome, und diese Tumoren sind in der Regel gutartig. 15 Daher kann die kortikal-schonende Adrenalektomie das betroffene Gewebe entfernen, während genügend Gewebe zurückbleibt, um eine Nebenniereninsuffizienz mit minimalem Rezidivrisiko zu verhindern.
Der erste Fall einer kortikal-schonenden Adrenalektomie wurde 1983 von Irvin et al. beschrieben. 16 Seitdem haben einige Einrichtungen über Erfolge bei der Durchführung einer kortikalschonenden Adrenalektomie durch offene oder minimal-invasive Ansätze mit relativ niedrigen Rezidivraten und vor allem einem geringen Auftreten von Nebenniereninsuffizienz berichtet. 14 Die Verwendung von PRA hat zugenommen, da endokrine Chirurgen mit hohem Volumen diese Technik eingeführt haben. PRA wurde erstmals 1995 beschrieben und dann durch die Erfahrungen von Walz und seinen Kollegen weiterentwickelt. 1, 4, 17 Retrospektive Studien, die PRA mit LTA vergleichen, zeigen verkürzte Operationszeiten, einen geringeren Blutverlust und keinen Unterschied in den Langzeitergebnissen.
In jüngerer Zeit wird PRA auch für die kortikal-schonende Adrenalektomie eingesetzt. In einer kürzlich erschienenen Serie wurden die Erfahrungen über einen Zeitraum von 25 Jahren mit der Durchführung von kortikal-schonenden Adrenalektomien bei bilateralen Phäochromozytomen mit dem RPA-Ansatz beschrieben. Sechsundsechzig Patienten wurden operiert, wobei insgesamt 101 Adrenalektomien durchgeführt wurden. Ihre durchschnittliche Operationszeit betrug 128 Minuten für bilaterale Operationen, und sie berichteten nur über zwei schwerwiegende Komplikationen. In 89 der Fälle konnten sie eine kortikal-schonende Operation durchführen, und von diesen Patienten benötigten 91% postoperativ keine Steroide. Nur ein Patient hatte eine persistierende Erkrankung, während keine Rezidive berichtet wurden. 18 Die Patienten sollten darauf hingewiesen werden, dass sie nach der Operation eine gewisse Nebenniereninsuffizienz haben könnten. Dies ist abhängig von der Größe des verbleibenden Nebennierengewebes und der Erhaltung der Durchblutung. Die Behandlung einer vorübergehenden Nebenniereninsuffizienz erfolgt in enger Absprache mit der Endokrinologie und geeigneten Laboruntersuchungen.
Der Eingriff wird unter Vollnarkose mit endotrachealer Intubation durchgeführt. Aufgrund der hämodynamischen Veränderungen, die während der Operation aufgrund des Tumors auftreten können, wird ein arterieller Zugang zur Blutdrucküberwachung gelegt, und der Anästhesist verabreicht bei Bedarf vasoaktive Medikamente. Ein Foley-Katheter wird gelegt, um die Harnausscheidung zu überwachen. Abhängig vom Grad der Katecholaminerhöhung und anderen Patientenfaktoren kann ein zentraler Venenzugang für einen zusätzlichen venösen Zugang und die Überwachung des zentralvenösen Drucks gelegt werden.
Nach Einleitung der Vollnarkose und der endotrachealen Intubation wird der Patient in eine Bauchlage gebracht, wobei die Hüften um 90 Grad gebeugt sind. Eine Cloward-Liege mit einem Cloward-OP-Sattel wird verwendet, um den Bauch abhängig hängen zu lassen. Die Klappmesserposition und der Cloward Surgical Saddle öffnen den retroperitonealen Raum, um die Belichtung zu maximieren. Alle Druckpunkte, einschließlich Gesicht, Arme, Hüften und Beine, sind umfangreich gepolstert. Der Beckenkamm, die Spitzen der 11. und 12. Rippe und der Rand der paraspinösen Muskeln sind wichtige Orientierungspunkte, die der Chirurg markiert. Der erste Schnitt wird knapp unterhalb der Spitze der 12. Rippe platziert. Mit einer Schere wird das Weichgewebe scharf geteilt und in das Retroperitoneum gelangt. Der Finger des Chirurgen wird dann verwendet, um den Raum stumpf zu räumen und die Platzierung eines 5-mm-Ports medial und lateral zu führen, die beide um etwa 30 Grad abgewinkelt und auf die Position der Nebenniere gerichtet sind. Im mittleren Schnitt wird dann eine 10-mm-Ballonöffnung platziert. Das Retroperitoneum wird durch High-Flow-Schläuche mit CO2 auf einen Insufflationsdruck von 25 mmHg insuflatiert.
In den 10-mm-Anschluss wird ein 5-mm-30-Grad-Oszilloskop eingesetzt, und ein LigaSure-Gerät wird verwendet, um den retroperitonealen Raum zu schaffen. Die Dissektion beginnt mit der medialen Identifizierung der paraspinösen Muskeln, gefolgt von der Identifizierung der Niere inferior. Die Kamera wird dann in der Regel zum medialen Port bewegt und der Chirurg verwendet ein LigaSure-Gerät und einen Darmgreifer durch den lateralen bzw. zentralen Port. Die Dissektion erfolgt über den oberen Pol der Niere und entlang der paraspinalen Muskeln medial in Richtung der Nebenniere. Die Exposition wird zum Teil durch einen Abwärtsdruck auf die Niere erleichtert. Bei der Identifizierung der Nebenniere wird die untere Ausdehnung der Drüse und ihre Beziehung zur Nebennierenvene bestimmt. Auf der rechten Seite zeigt diese Dissektion die IVC, von der die Nebenniere präpariert wird, um die Nebennierenvene freizulegen. Links entspringt die Nebennierenvene der linken Nierenvene.
An dieser Stelle wird die genaue Beziehung des unveränderten kortikalen Nebennierengewebes zum schuldigen Tumor bestimmt. Dies wird zum Teil durch eine detaillierte Auswertung der präoperativen Bildgebung in Verbindung mit intraoperativen Befunden ermittelt. Gelegentlich kann intraoperativer Ultraschall nützlich sein. Sobald eine geeignete Ebene identifiziert ist, wird das Phäochromozytom mit einem LigaSure-Gerät vom normalen Nebennierengewebe getrennt. Die Nebenniere ist stark vaskularisiert, so dass der Blutstillung beim Durchtrennen der Drüse große Aufmerksamkeit geschenkt wird. In diesem Fall war die untere mediale Extremität der nativen rechten Nebenniere für die Konservierung geeignet. Wenn möglich, sollte die Vene erhalten bleiben. Dies ist jedoch nicht notwendig und auch nicht immer machbar, da es zu einer zusätzlichen venösen Drainage entlang der kleinen Nebennierenarterien kommt. Bei der aktuellen Operation wurde festgestellt, dass die Nebennierenvene direkt in den Tumor eintritt und daher mit Clips geteilt wurde. An diesem Punkt werden die medialen und lateralen Ansätze des Tumors entfernt, so dass der obere Ansatz übrig bleibt, damit der Tumor nach unten hängen kann und eine überlegene Stelle der Gegentraktion entsteht. Es wird darauf geachtet, dass während der lateralen und cephaladischen Dissektionen nicht in die Bauchhöhle gelangt. Nachdem der Tumor umlaufend präpariert wurde, werden die oberen Ansätze entnommen und die Drüse mit einem Endocatch-Gerät aus dem retroperitonealen Raum entfernt. Der 10-mm-Port wird in Schichten geschlossen, während die 5-mm-Portstellen nur auf Höhe der Haut geschlossen sind.
Die endgültige Pathologie ergab ein 5,2 cm langes rechtes Phäochromozytom und ein 5,6 cm langes linkes Phäochromozytom. Tests, die am ersten Tag der Operation durchgeführt wurden, zeigten eine leicht verminderte Cortisolproduktion. Daher wurde der Patient vorübergehend auf eine niedrige Dosis oraler Steroide gesetzt. Die Patientin wurde am zweiten postoperativen Tag mit ausgezeichneter Genesung nach Hause entlassen, als sie zwei Wochen nach ihrer Operation in der Klinik gesehen wurde, mit dem Plan, die niedrige Dosis von Prednison abzusetzen.
Andrew-Rahmen, Cloward Surgical Sattel, LigaSure-Gerät und Endocatch-Rückholbeutel.
Die Autoren machen keine Angaben.
Der Patient, auf den sich dieser Videoartikel bezieht, hat seine Einverständniserklärung gegeben, gefilmt zu werden, und ist sich bewusst, dass Informationen und Bilder online veröffentlicht werden.
References
- Walz MK, Peitgen K, Hoermann R, Giebler RM, Mann K, Eigler FW. Posteriore Retroperitoneoskopie als neuer minimal-invasiver Ansatz für die Adrenalektomie: Ergebnisse von 30 Adrenalektomien bei 27 Patienten. Welt J Surge 1996;20(7):769-774. doi:10.1007/s002689900117
- Callender GG, Kennamer DL, Grubbs EG, Lee JE, Evans DB, Perrier ND. Posteriore retroperitoneoskopische Adrenalektomie. Adv Surge 2009;43(1):147-157. doi:10.1016/j.yasu.2009.02.017
- Perrier ND, Kennamer DL, Bao R, et al. Posteriore retroperitoneoskopische Adrenalektomie: bevorzugte Technik zur Entfernung von gutartigen Tumoren und isolierten Metastasen. Ann Surg 2008;248(4):666-674. doi:10.1097/SLA.0b013e31818a1d2a
- Walz MK, Peitgen K, Walz MV, et al. Posteriore retroperitoneoskopische Adrenalektomie: Lehren aus fünf Jahren. Welt J Surge 2001;25(6):728-734. doi:10.1007/s00268-001-0023-6
- Lee JE, Curley SA, Gagel RF, Evans DB, Hickey RC. Kortikal-sparende Adrenalektomie bei Patienten mit bilateralem Phäochromozytom. Chirurgie. 1996;120(6):1064-1071. doi:10.1016/S0039-6060(96)80056-0
- Farrugia FA, Martikos G, Tzanetis P, et al. Phäochromozytom, Diagnose und Behandlung: Überprüfung der Literatur. Endocr Regul. 2017;51(3):168-181. doi:10.1515/enr-2017-0018
- Thompson LD. Phäochromozytom der Nebenniere Scaled Score (PASS) zur Trennung von gutartigen von malignen Neoplasmen: eine klinisch pathologische und immunphänotypische Studie mit 100 Fällen. Am J Surg Pathol. 2002;26(5):551-566. doi:10.1097%2F00000478-200205000-00002
- Pacak K, Wimalawansa SJ. Phäochromozytom und Paragangliom. Endokr-Praxis. 2015;21(4):406-412. doi:10.4158/EP14481 RA.
- Goffredo P, Sosa JA, Roman SA. Malignes Phäochromozytom und Paragangliom: eine Analyse des Langzeitüberlebens auf Populationsebene über zwei Jahrzehnte. J Surg Oncol. 2013;107(6):659-664. doi:10.1002/jso.23297
- Li J, Yang CH. Verbesserung des präoperativen Managements bei Patienten mit adrenalem Phäochromozytom. Int J Clin Exp Med. 2014;7(12):5541-5546. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4307515.
- Chen H, Sippel RS, O'Dorisio MS, Vinik AI, Lloyd RV, Pacak K; North American Neuroendocrine Tumor Society (NANETS). Die Konsensleitlinie der North American Neuroendocrine Tumor Society für die Diagnose und Behandlung von neuroendokrinen Tumoren: Phäochromozytom, Paragangliom und medullärer Schilddrüsenkrebs. Bauchspeicheldrüse. 2010;39(6):775-783. doi:10.1097/MPA.0b013e3181ebb4f0
- Sutton MG, Sheps SG, Lie JT. Prävalenz von klinisch unvermuteten Phäochromozytomen: Überprüfung einer 50-jährigen Autopsieserie. Mayo Clin Proc. 1981;56(6):354-360.
- Lairmore TC, Ball DW, Baylin SB, Wells SA Jr. Management von Phäochromozytomen bei Patienten mit multiplen endokrinen Neoplasie-Typ-2-Syndromen. Ann Surg 1993;217(6):595-603. doi:10.1097/00000658-199306000-00001
- Walz MK. Ausmaß der Adrenalektomie bei Nebennierenneoplasma: kortikale Schonung (Zwischensumme) versus totale Adrenalektomie. Surg Clin Nord Am. 2004;84(3):743-753. doi:10.1016/j.suc.2004.01.003
- Renard J, Clerici T, Licker M, Triponez F. Phäochromozytom und abdominales Paragangliom. J. Visc Surg 2011;148(6):E409-E416. doi:10.1016/j.jviscsurg.2011.07.003
- Irvin GL 3. Platz, Fishman LM, Sher JA. Familiäres Phäochromozytom. Chirurgie. 1983;94(6):938-940. https://www.surgjournal.com/article/0039-6060(83)90403-8/Volltext.
- Mercan S, Seven R, Ozarmagan S, Tezelman S. Endoskopische retroperitoneale Adrenalektomie. Chirurgie. 1995;118(6):1071-1076. doi:10.1016/S0039-6060(05)80116-3
- Alesina PF, Hinrichs J, Meier B, Schmid KW, Neumann HP, Walz MK. Minimalinvasive kortikal-schonende Chirurgie bei bilateralen Phäochromozytomen. Langenbecks Bogen Surg. 2012;397(2):233-238. doi:10.1007/s00423-011-0851-2
Cite this article
Brown TC, Carling T. Bilaterale posteriore retroperitoroskopische Adrenalektomie mit kortikaler Schonung auf der rechten Seite. J Med Einblick. 2021;2021(282). doi:10.24296/jomi/282.