Antrectomía abierta y resección duodenal para tumor neuroendocrino
Main Text
Table of Contents
En este video se describe la técnica quirúrgica para la resección duodenal abierta y la antrectomía, que se realizó por un tumor neuroendocrino del bulbo duodenal. En este procedimiento, comenzamos con una laparotomía de la línea media superior y procedemos con la movilización del estómago distal, el duodeno y la cabeza del páncreas. Para movilizar, Kocherizamos el duodeno, luego ligamos esa arteria gástrica derecha y diseccionamos el ligamento gastrohepático, seguido de la ligadura de los vasos gastroepiploicos derechos y desmontamos el ligamento gastrocólico dejando al descubierto el saco menor. Una vez que las estructuras están adecuadamente movilizadas, diseccionamos la primera porción del duodeno de la cabeza del páncreas y la seccionamos con una grapadora TA. A continuación, se realiza la antrectomía, extrayendo la muestra. Para la reconstrucción, realizamos una gastroyeyunostomía retrocólica de extremo a lado cosida a mano. Esta técnica se puede utilizar para múltiples indicaciones, incluida la enfermedad de úlcera péptica y otras lesiones masivas del antro, el píloro o el bulbo duodenal.
Maniobra de Kocher; antrectomía; duodenectomía; tumor neuroendocrino; Gastroyeyunostomía.
Los tumores neuroendocrinos (TNE) surgen de las células secretoras del sistema neuroendocrino difuso, que incluye el tracto digestivo y el páncreas. Los tumores neuroendocrinos son el segundo cáncer digestivo más común después del cáncer colorrectal. Aproximadamente el 70% de los tumores neuroendocrinos ocurren en el intestino delgado o el colon, el 12% en el páncreas y el 5% en el apéndice. 1 Los TNE son de carácter heterogéneo, la mayoría tienen un crecimiento lento y un subconjunto segregará hormonas o aminas bioactivas que darán lugar a trastornos funcionales. 2 Los tumores carcinoides son un tipo de tumores neuroendocrinos que surgen de las células enterocromafines que producen serotonina. Otros tipos de tumores neuroendocrinos pueden producir insulina, glucagón, somatostatina, gastrina o péptido intestinal vasoactivo (VIP). Los tumores neuroendocrinos se diagnostican mediante una combinación de presentación clínica, marcadores bioquímicos, patología e imágenes. 3 La agresividad de los tumores neuroendocrinos está determinada principalmente por el grado del tumor, que varía en función de la localización. 4 La incidencia ha aumentado en las últimas cuatro décadas, pero se cree que esto se atribuye en parte al aumento de las imágenes diagnósticas. El veintisiete por ciento de los pacientes presentarán enfermedad metastásica en el momento del diagnóstico. 5
Dada la heterogeneidad de los tumores neuroendocrinos, que presentan variabilidad en la agresividad biológica y la secreción de sustancias químicas bioactivas, el tratamiento de estos tumores suele requerir un enfoque personalizado. La resección quirúrgica sigue siendo el único tratamiento curativo para los tumores neuroendocrinos en general. La resección endoscópica también se puede considerar para las lesiones duodenales de menos de un centímetro de diámetro. Sin embargo, este procedimiento es técnicamente desafiante debido a las características anatómicas del duodeno. Además, conlleva un riesgo de perforación y un margen vertical positivo debido a la infiltración en la submucosa. 6,11
En este video, realizamos una resección duodenal con antrectomía para un tumor endoendocannabinoide duodenal en una mujer de 48 años. La masa presentaba características benignas en el estudio clínico; Sin embargo, debido a un aumento en el tamaño de la lesión en la endoscopia de vigilancia, se tomó la decisión de proceder con resección quirúrgica con intención curativa.
Se trata de una mujer de 48 años con antecedentes de enfermedad por reflujo gastroesofágico a la que se le encontró un tumor en el bulbo duodenal en la esofagogastroduodenoscopia. Se realizó una ecografía endoscópica para caracterizar aún más la lesión, que resultó ser de 5 mm en su dimensión máxima y parecía submucosa. Se tatuó la lesión y se realizó un seguimiento endoscópico de rutina para controlar la masa. Dos años más tarde, la masa había crecido modestamente y fue remitida a la clínica quirúrgica para una resección. Sus otros antecedentes médicos se caracterizan por obesidad, diabetes mellitus e hipertensión. No tiene antecedentes quirúrgicos abdominales previos. Su última colonoscopia fue hace tres años y fue normal. Tiene una puntuación de la Sociedad Americana de Anestesiólogos (ASA) de 2 y su índice de masa corporal (IMC) es de 31.
Al paciente se le realizó un examen físico sin complicaciones. En la consulta, se presentó sin aparente angustia con signos vitales normales. Tenía un habitus normal. Su examen abdominal no presentaba ninguna observación, sin evidencia de cicatrices quirúrgicas previas, hernias o sensibilidad a la palpación. Su abdomen era blando y no distendido.
Las imágenes relevantes se pueden ver en la Figura 1.
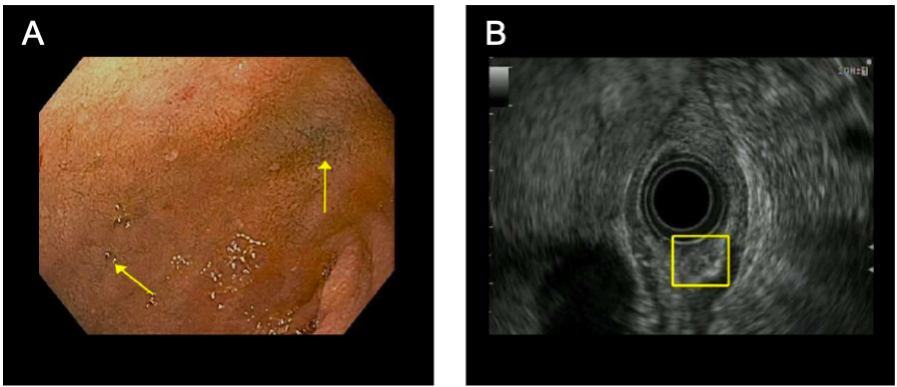
Figura 1. Imágenes relevantes. (A) Imagen endoscópica del duodeno. Las flechas amarillas apuntan a un tatuaje de tinta azul de la marcación endoscópica previa de la masa. La lesión es pequeña y no es visible en la endoscopia convencional. (B) Imagen de ultrasonido endoscópica del tumor neuroendocrino, que se captura dentro de la caja amarilla. La lesión es subepitelial en la ecografía.
El curso clínico de los tumores neuroendocrinos es muy variable. Las lesiones de bajo grado y bien diferenciadas suelen tener un curso lento con un potencial metastásico bajo, mientras que los tumores neuroendotólicos de alto grado progresan rápidamente con diseminación a distancia. La supervivencia también se relaciona con la ubicación del tumor, y los tumores neuroendocrinos pancreáticos con características de grado alto tienen tasas de supervivencia a 5 años deprimibles de menos del 10 %. 7 La secuencia de alteraciones genéticas y epigenéticas que impulsan el desarrollo de los TNE es variable cuando se comparan las lesiones de bajo grado con las de alto grado, pero también cuando se compara el origen del tipo de célula, lo que indica que la patología molecular y el curso clínico posterior es heterogéneo entre los TNE.
El único tratamiento curativo posible para los tumores neuroendocrinos es la resección quirúrgica del tumor. No obstante, el cirujano debe discutir los riesgos y beneficios de una operación con el paciente. En ciertos casos, es razonable intentar la resección endoscópica para las lesiones pequeñas con características de riesgo bajo. Para la enfermedad metastásica, la cirugía puede estar indicada si la totalidad de la enfermedad es extirpable, o en situaciones en las que la citorreducción podría mejorar significativamente la calidad de vida de las masas secretoras de hormonas. Sin embargo, en la mayoría de los casos de enfermedad metastásica, la quimioterapia citotóxica y la terapia antihormonal son los pilares del tratamiento.
La justificación de la resección quirúrgica para los tumores neuroendocrinos no metastásicos es la extirpación completa de la enfermedad con intención curativa.
Hay varias advertencias sobre la resección quirúrgica de los tumores neuroendocrinos. En primer lugar, se puede considerar la vigilancia de los tumores neuroendocrinos duodenales de menos de 1 cm de diámetro con características de riesgo bajo, la resección endoscópica es aceptable.8 En segundo lugar, para las lesiones de alto grado, el papel de la cirugía es menos claro debido al mayor riesgo de diseminación a distancia y al mal pronóstico. En tercer lugar, se puede considerar la citorreducción quirúrgica no curativa en ciertos casos de enfermedad metastásica para mejorar la calidad de vida de los tumores secretores de hormonas.
Como hemos mostrado en este vídeo, los principales pasos del procedimiento para esta operación son los siguientes: (1) laparotomía de la línea media superior, extracción del ligamento falciforme, exploración de la cavidad peritoneal; (2) Kocherización del duodeno; (3) ligar la arteria gástrica derecha, desmontaje del ligamento gastrohepático; (4) ligadura de la arteria gastroepiploica derecha, desmontaje del ligamento gastrocólico y entrada en el saco menor; (5) movilización de la primera porción del duodeno fuera de la cabeza del páncreas; (6) seccionar el duodeno con una grapadora TA; (7) seccionar el antro del estómago con una grapadora ILA; y (8) realizar una reconstrucción Billroth II con una gastroyroyeyunostomía retrocólica de Hoffmeister de extremo a lado. Este abordaje permite una movilización extensa del duodeno y la parte distal del estómago para asegurar márgenes de resección negativos.
Hay dos opciones para la gastroyeyunostomía: antecólica y retrocólica. En el abordaje retrocólico, el yeyuno se introduce a través de una ventana mesentérica del colon transverso, lo que da como resultado un asa aferente más corta y un menor riesgo de síndrome de asa aferente. Por otro lado, el abordaje antecólico se considera técnicamente más fácil y se prefiere en casos de neoplasias malignas. 12
Los tumores neuroendocrinos duodenales son poco frecuentes, ya que representan menos del 5 % de las neoplasias duodenales primarias y menos del 10 % de todos los tumores neuroendocrinos. 9 La mayoría de los tumores neuroendocrinos duodenales son no funcionales, de menos de 2 cm de diámetro, y se descubren incidentalmente en pacientes asintomáticos. 8 Estos tumores suelen presentarse en la mucosa profunda y tienen un aspecto submucoso en la endoscopia. El tratamiento estándar para los tumores neuroendocrinos duodenales es la resección quirúrgica. Sin embargo, para las lesiones de bajo grado, tamaño pequeño y no funcionales, se puede considerar la resección endoscópica. 10 No se recomienda la observación de lesiones pequeñas de bajo grado debido al riesgo de metástasis en los ganglios linfáticos.
El tipo de resección quirúrgica depende de la ubicación y el tamaño de la lesión dentro del duodeno. Los tumores ampulares tienden a tener un pronóstico más precario y, a menudo, requieren una pancreaticoduodenectomía para obtener márgenes negativos y un rendimiento ganglionar adecuado. Los tumores endoendocannabinoides duodenales en el borde antimesentérico del intestino a veces se pueden resecar de forma fragmentada si son lo suficientemente pequeños y con características de bajo riesgo. Para otros casos, es necesaria una resección duodenal segmentaria. En el caso de nuestro paciente, optamos por realizar una resección D1 con una antrectomía. Elegimos este procedimiento porque la lesión no era localizable intraoperatoriamente y, por lo tanto, no era susceptible de una resección en cuña.
- Tiempo de operación: 68 minutos
- Pérdida de sangre estimada: 50 mL
- Fluidos: 1700 mL cristaloide
- Duración de la estancia: alta hospitalaria a domicilio sin servicios en el día 4 del postoperatorio
- Morbilidad: sin complicaciones
- Patología final: tumor neuroendocrino, grado 1, tinciones positivas para gastrina
- Bisturí de 10 hojas
- Electrocauterización
- Pinzas DeBakey
- Retractor de mano de pared abdominal
- Abrazadera Schnidt
- Lazos de seda 3-0 y 2-0 para ligadura de mesenterio
- Tijeras Metzenbaum
- Grapadora ILA
- Grapadora TA
- 3-0 Vicryl y 3-0 seda para gastroyeyunostomía
- 1-0 Sutura de Prolene para cierre fascial
- Grapadora de piel
Nada que revelar.
El paciente al que se refiere este artículo de vídeo ha dado su consentimiento informado para ser filmado y es consciente de que la información y las imágenes se publicarán en línea.
Nos gustaría agradecer a Theresa Kim, MD por ayudar en esta operación.
References
- Frilling A, Akerstrom G, Falconi M, et al. Enfermedad tumoral neuroendocrina: un panorama en evolución. Cáncer Endocr Relat. 2012; 19:R163-85. doi:10.1530/ERC-12-0024.
- Cives M, Strosberg JR. Tumores neuroendocrinos gastroenteropancreáticos. CA Cáncer J Clin. 2018;68:471-87. doi:10.3322/caac.21493.
- Oberg K, Couvelard A, Delle Fave G, et al, Antibes Consensus Conference p. ENETS Consensus Guidelines for Standard of Care in Neuroendocrine Tumorours: Biochemical Markers. Neuroendocrinología. 2017;105:201-11. https://doi.org/10.1159/000461583.
- Kloppel G, La Rosa S. Índice de marcaje Ki67: evaluación y papel pronóstico en las neoplasias neuroendocrinas gastroenteropancreáticas. Arco de Virchows. 2018;472:341-9. doi:10.1007/s00428-017-2258-0.
- Dasari A, Shen C, Halperin D, et al. Tendencias en los resultados de incidencia, prevalencia y supervivencia en pacientes con tumores neuroendocrinos en los Estados Unidos. JAMA Oncol. 2017;3:1335-42. doi:10.1001/jamaoncol.2017.0589.
- Partelli S, Bartsch DK, Capdevila J, et al, Antibes Consensus Conference p. ENETS Consensus Guidelines for Standard of Care in Neuroendocrine Tumorours: Surgery for Monthly Intestinal and Pancreatic Neuroendocrine Tumors. Neuroendocrinología. 2017;105:255-65. doi:10.1159/000464292.
- Strosberg JR, Cheema A, Weber J, Han G, Coppola D, Kvols LK. Validez pronóstica de una nueva clasificación de estadificación del American Joint Committee on Cancer para los tumores neuroendocrinos de páncreas. J Clin Oncol. 2011;29:3044-9. doi:10.1200/JCO.2011.35.1817.
- Sato Y, Hashimoto S, Mizuno K, Takeuchi M, Terai S. Tratamiento de los tumores neuroendocrinos gástricos y duodenales. Mundo J Gastroenterol 2016;22:6817-28. doi:10.3748/wjg.v22.i30.6817.
- Yao JC, Hassan M, Phan A, et al. Cien años después de "carcinoide": epidemiología y factores pronósticos de tumores neuroendocrinos en 35.825 casos en los Estados Unidos. J Clin Oncol. 2008;26:3063-72. doi:10.1200/JCO.2007.15.4377.
- Kulke MH, Shah MH, Benson AB III, et al; Red Nacional Integral del Cáncer. Tumores neuroendocrinos, versión 1.2015. J Natl Compr Canc Netw. Enero de 2015; 13(1):78-108. doi:10.6004/jnccn.2015.0011.
- Furukawa K, Nakamura M, Kawashima H, Fujishiro M. Resección endoscópica de un tumor neuroendocrino duodenal. Rev Esp Enferm Dig. 2022; 114(5):291-292. doi:10.17235/reed.2021.8232/2021.
- Miyazaki Y, Oda T, Shimomura O, et al. Gastroyeyunostomía retrocólica tras pancreaticoduodenectomía: tasa satisfactoria de vaciamiento gástrico retardado. Páncreas. 2019; 48(4):579-584. doi:10.1097/MPA.0000000000001295.
Cite this article
Antiguo DJ, Berger DL. Anrectomía abierta y resección duodenal para tumor neuroendocrino. J Med Insight. 2024; 2024(28). doi:10.24296/jomi/28.

