副鼻腔内視鏡による膵臓デブリードメント
Main Text
副鼻腔内視鏡検査(STE)は、死んだ組織や感染した組織のデブリードメントを行う低侵襲技術です。STEは通常、感染した膵臓または膵周囲壊死の治療に用いられますが、他にも応用例が記載されています。STEは経皮ドレーンを設置し、その後透視誘導によるドレーン経路拡張を行い、作業用鞘の設置を可能にします。その後、内視鏡を鞘から挿入し、壊死組織のデブライドを行います。その後、同じ管内からドレインを交換します。この場合、STEを用いて外傷性膵損傷による感染膵周囲壊死を除死し、腸瘻で合併症を起こします。
急性膵炎はアメリカ合衆国で年間27万5千人以上に影響を及ぼしています。約20%が壊死を発症し、そのうち10〜20%が感染性壊死を発症します。感染性膵臓または膵周囲壊死は壊死性膵炎の介入における主要な適応症です。1、2
患者は58歳の男性で、自動車事故に巻き込まれ膵臓を含む複数の怪我を負いました。当初は別の病院で管理され、内視鏡下逆行性胆管膵管造影と膵管ステントメントを受けました。彼は症状を伴う急性膵周積液の蓄積を発症し、経皮的排膿を受けたところ感染が判明しました。膵臓周囲の貯水が解決しなかったため、ドレーンの容量を拡大しました。下腹部の左腹膜後膜コレクションは有意に改善したが、膵尾部に持続的な壊死性コレクションが発生し、経皮的排尿でも改善しなかった。透視ドレーン注射により、コレクションが小腸と連携していることが示されました。彼は持続的な腹痛と断続的に発熱していたため、私たちのところに紹介されました。
身体検査の結果、健康そうでバイタルサインも正常な男性であることが判明しました。頭、頸部、心肺検査はすべて正常でした。腹部は柔らかく、左腹腹は軽い痛みがあった。外側腹部から2つの24 Frドレーンが突き出ており、膿性の排出物がありました。
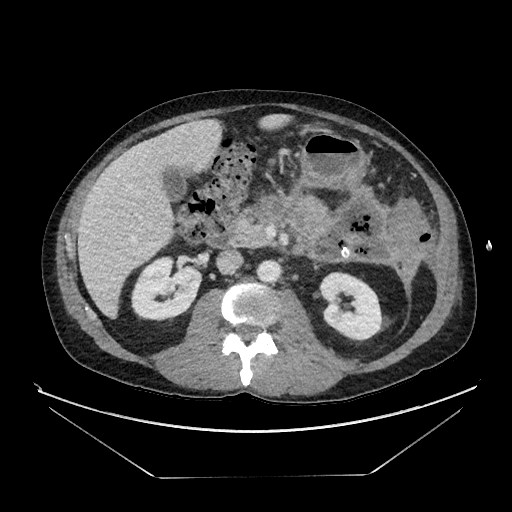
腹部CTスキャンでは、膵尾部左上腹部に持続的な9 cm x 6 cmの壁状壊死が認められました(図1)。
ほとんどの膵周壊死は急性膵炎に起因し、これは主にエタノールの使用や胆石によって引き起こされます。このような外傷性壊死は比較的まれです。ほとんどの膵炎は軽度で、膵周囲液体の蓄積や壊死などの局所的な合併症を引き起こしません。これらの症状が起きた場合は、最初は非介入的に管理し、壊死や液体の蓄積はほとんどの場合治ります。壊死や液体の蓄積が続く場合、今回のように感染のリスクがあります。感染が発生した場合は、まず低侵襲の排尿(内視鏡的または経皮的)をステップアップアプローチで管理すべきです。20〜40%の確率で感染は解決します。そうでない場合は、一般的に死死切除術が求められます。2–4
私たちに紹介された当時、患者にはいくつかの選択肢がありました。経皮的排膿を継続すれば、この場合は最終的に採取が解決したかもしれませんが、その代償として数週間にわたる外部排液が続きました。この患者の壊死性コレクションは胃に接していなかったため、経胃ドレナージには適していませんでした。ビデオ支援後腹膜デブリードメント(VARD)または副鼻腔内視鏡検査(STE)は、この患者にとって低侵襲の選択肢です。開腹外科的死死切除術も可能だったでしょう。
このケースでSTEを選んだのは、コレクションの総規模が比較的小さく、腸瘻の存在が創傷合併症のリスクを高めるため、STEによって合併症が最小限に抑えられるからです。
近年、感染した膵臓壊死の治療は開腹手術から低侵襲のステップアップアプローチへとシフトしています。2–4 この記事では、低侵襲死死切除術の重要な技術の一つであるSTEについて説明します。5 STEおよびその他の低侵襲技術を用いたステップアップアプローチは、感染膵壊死の介入を受ける患者の罹患率と死亡率を有意に減少させました。6 どのような技術を用いるにせよ、一般的な管理原則には、壊死を抑えるための早期非介入的管理、低侵襲排膿による初期介入、明確に定義された壊死に対処する低侵襲壊死切除術が含まれます。
本記事では感染性膵周囲壊死の治療にSTEを用いることを示していますが、STEを最適化するために利用可能な他の技術を理解することが重要です。主な他の技術としては、内視鏡または外科的に行うことができる経胃壊死切除術(VARD)と経胃壊死切除術があります。VARDは壊死の後腹膜窓を必要とし、大量の壊死を傍生溝に追跡する迅速なデブリードメントに最適です。壊死洞にアクセスするために排水管の上をカットダウンする作業を含みます。経胃壊死切除術は、壊死腔への経胃窓が明確に存在し、壊死の大部分が後部胃に連続している場合に好まれる方法です。内視鏡的経胃ドレナージおよびデブリードメントおよびVARDは、最近の2件のランダム化試験で開放性死死切除術と好意的に比較されています。3,8,9 両者とも、デブリードメント後の新発臓器不全の発生率を減少させることが示されました。内視鏡的デブリードメントは外科的壊死切除術と比べて死亡率および外瘻形成の減少にもつながった。主な欠点は経胃アクセスの解剖学的要件と複数回の再介入の頻繁性(中央値3、2つの異なるランダム化試験で)です。9,10ステップアッププロトコルの一環として実施されたVARDは、開腹手術による壊死切除術に比べてコストと糖尿病発生率が低くなりましたが、死亡率の向上や瘻孔形成率の低下は認められませんでした。現在、8 VARD および内視鏡的経胃壊死切除術が直接比較され、直接比較された無作為化試験では、死亡や重大合併症に差はなく、膵瘻を含むいくつかの副次的評価項目において内視鏡的壊死切除術の方が有利であることが示されました。10
外科的経胃壊死切除術は開腹または腹腔鏡手術で行え、複数の処置を不要にし、胆嚢膵炎の場合は同時に胆嚢摘出術も行えます。しかし、内視鏡的経胃壊死切除術と同じ解剖学的制約が適用されます。最近の無作為化試験では、外科的経胃壊死切除術とVARDの組み合わせを比較し、手術的アプローチの合併症率は高いものの死亡率に差はありませんでした。11 これは外科的アプローチと内視鏡的経胃術を直接比較したものではありませんが、外科的アプローチは選択的に使用すべきであることを示唆しています。内視鏡経胃ドレナージと経皮ドレナージを組み合わせる「デュアルモダリティドレナージ(DMD)」は、内視鏡ドレナージの主な利点である外瘻の発生率の低さを得られるだけでなく、内視鏡で到達しにくい部分へのアクセスも可能にします。12 DMDの元の説明では、どちらの経路でも死死切除術は行われていませんでした。現在では、経胃ドレナージとSTEまたはVARDによる壊死切除術を組み合わせて行うのが日常的です。13 これは外科的壊死切除術(迅速な解株と胃に隣接しない壊死へのアクセスが容易になる)と内視鏡的経胃壊死切除術(外瘻の制御)の主な利点を組み合わせていることがわかりました。
VARDとSTEを比較すると、それぞれに利点と欠点があります。VARDは外科医に馴染みのある機器、例えば腹腔鏡による可視化やリング・腹腔鏡的鉗子によるデブリードメントを用い、腔内挿入後の実際のデブリードメント行為は開腹外科的壊死切除術と非常によく似ています。これらの理由から、多くの外科医はこの技術を採用しやすいと感じるかもしれません。VARDは開放性壊死切除術と同様に、壊死の大きな塊を迅速にデブリードメントでき、私たちの経験では、これまでに繰り返しの処置を必要としたことはありません。VARDには主に二つの欠点があります。一つは、創傷合併症は一般的に軽度ですが比較的一般的であることです。もう一つは、壊死への後腹膜経路が必要で、その経路はドレーン管に沿って安全に切り込むのに十分な幅であり、また完全なデブリードメントが可能な位置から腔内に入ります。
VARDや内視鏡的経胃ドレナージと比較すると、STEは解剖学的な要件が比較的少ないです。経皮的にアクセス可能なほぼすべての壊死コレクションはSTEでアクセス可能です。これは、壊死への唯一のまたは最良の経路が経腹膜や肋間経路である場合や、壊死への窓口が非常に狭く、VARDのカットダウンが重要構造への損傷のリスクがある場合に利点となります。この柔軟性はSTEの最大の利点の一つであり、患者の適格性を大幅に拡大し、経胃や後腹膜アプローチではアクセスできないコレクションの治療のために、より病的な開放性壊死切除術や非常に長時間の経皮的ドレナージの必要性を不要にします。さらに、STEは切開部が実際のドレーン部位であるため、基本的に創傷合併症がありません。しかし、STEは硬性腎鏡や術中透視など、外科医があまり頻繁に使わない機器への慣れが必要です。比較的少ない機器設備が必要なため、大規模な壊死コレクションでは複数の手順が必要になることが多いです。
この場合、壊死の比較的少ない集団で、完全なデブリードメントは一度の手術で行われました。壊死の量が多い場合や、壊死が脾臓血管などの重要構造に密着しているため、ドレーンをそのままにし、再検査を計画します。再手術を計画する場合は、同じ皮膚切開を通って大きな排液カテーテルの隣に7Frカテーテルを挿入し、灌流を行います。通常、0.9%の生理食塩水を200ml/時間に連続灌流し、48〜72時間間隔で施行します。もし存在する場合、灌流カテーテルを点滴ポンプに接続し、ドレナージカテーテルはドレナージバッグに接続され、皮膚はカテーテルの周囲を縫合を断続して閉じます。一定期間の灌漑後、残存壊死は緩やかに付着し、初期の処置で継続した場合よりもはるかに迅速かつ安全に除去されることが非常に一般的です。このため、出血のリスクがあるため、腔壁を強くデブリードする誘惑は避け、再開の閾値は低く設定すべきです。このガイドラインに従っても、中央値手術件数は1件のままで、平均は1.8件(範囲1〜4)です。7
最後に、この症例は空腸への腸瘻の形成を示しています。小腸、胃、結腸への腸瘻は珍しくありません。これまでに、瘻孔に直接介入する必要はなく、すべての瘻は壊死腔の完全なデブリードメントで閉じています。今回のように。近位腸の外科的修復や切除、または遠位小腸や大腸瘻孔の場合は、非常に選択的に使用すべきです。この患者は手術の翌日に自宅で退院しました。彼のドレーンは術後12日目に取り除かれました。
- 放射線透膜手術台
- Cアーム
- Amplatz スーパースティッフガイドワイヤー(直径0.035インチ)、ボストンサイエンティフィック
- 高圧腎造毛術バルーンカテーテルおよびシース(30 FR)、ボストン・サイエンティフィック
- 硬性腎鏡(30 fr)、ストルツ
- 16-28 Fr 経皮的ドレクター
特に開示することはない。
この動画で言及されている患者は撮影に同意しており、情報や画像がオンラインで公開されることを認識しています。
References
- ピーリーAF、クロケットSD、バリットASら。アメリカ合衆国における消化器系、肝臓、膵臓疾患の負担。 消化器内科。 2015;149(7):1731-1741. DOI:10.1053/J.Gastro.2015.08.045。
- テナーS、ベイリーJ、デウィットJ、ヴェッジSS;アメリカ消化器学会。アメリカ消化器学会ガイドライン:急性膵炎の管理。 私はJ Gastroenterolです。 2013;108(9):1400-1416. doi:10.1038/ajg.2013.218.
- ホレマンスRA、バッカーOJ、ボーアミースターMAら;オランダ膵炎研究グループ。壊死性膵炎患者の長期追跡観察におけるステップアップアプローチの優位性、開腹壊死切除術の優位性。 消化器内科。 2019;156(4):1016-1026. DOI:10.1053/J.Gastro.2018.10.045。
- 作業部会IAP/APA急性膵炎ガイドライン。急性膵炎管理のためのIAP/APAエビデンスに基づくガイドライン。 膵臓内科。 2013;13巻(4巻2号):e1-15。 doi:10.1016/j.pan.2013.07.063.
- カーター・CR、マッケイCJ、イムリー・CW。感染性膵壊死の管理における経皮的死死切除術および副鼻腔内視鏡:初期体験。 アン・サージ。 2000;232(2):175-180. doi:10.1097%2F00000658-200008000-00004。
- ファン・ブルンショット S、ホレマンス RA、バッカー OJ ほか。壊死性膵炎に対する低侵襲内視鏡的および内視鏡的と開腹性壊死切除術:1980人の患者の個別データの統合分析。 直感。 2018;67(4):697-706. DOI:10.1136/GUTJNL-2016-313341。
- フォン・ZV、ファゲンホルツPJ。感染した膵臓壊死に対する低侵襲デブリードマン。 J Gastrointest Surg。 2019;23(1):185-191. doi:10.1007/s11605-018-3908-5。
- ファン・サントフォールトHC、ベッセリンクMG、バッカーOJら;オランダ膵炎研究グループ。壊死性膵炎に対するステップアップアプローチ、または開腹壊死切除術。 N Engl J Med. 2010;362(16):1491-1502. doi:10.1056/NEJMoa0908821.
- バッカーOJ、ファン・サントフォールトHC、ファン・ブルンショットSら;オランダ膵炎研究グループ。感染性壊死性膵炎に対する内視鏡的経胃切除術と外科的死死切除術:ランダム化試験。 JAMA。 2012;307(10):1053-1061. doi:10.1001/jama.2012.276.
- van Brunschot S、van Grinsven J、van Santvoort HCら;オランダ膵炎研究グループ。感染性壊死性膵炎に対する内視鏡的または外科的ステップアップアプローチ:多施設無作為化試験。 ランセット。 2018;391(10115):51-58. doi:10.1016/S0140-6736(17)32404-2。
- バン・JY、アーノレッティJP、ホルトBAら。内視鏡的経腔内法は、低侵襲手術と比較して、壊死性膵炎患者の合併症や費用を削減します。 消化器内科。 2019;156巻4号:1027-1040.e3。 DOI:10.1053/J.Gastro.2018.11.031。
- ロス・AS、イラニ・S、ガン・SIら。感染および症状のある壁閉鎖膵壊死の二重モダリティドレナージ:長期臨床アウトカム。 消化管内分泌科。 2014;79(6):929-935. doi:10.1016/j.gie.2013.10.014.
- ファゲンホルツPJ、タベットA、ミューラーPR、フォルチオーネDG。内視鏡による経胃ドレナージとビデオ補助による後腹膜膵除詞術の複合療法―腸瘻による広範な膵壊死に対する最良の方法。 膵臓内科。 2016;16(5):788-790. doi:10.1016/j.pan.2016.06.009.
Cite this article
Fagenholz P. 副鼻腔内視鏡による膵臓デブリードメント。 J Med Insight。 2021;2021(250). doi:10.24296/jomi/250。