开腹远端胃切除术
Main Text
切缘阴性 (R0) 完全切除仍然是胃腺癌唯一可能治愈的治疗方法。手术的选择取决于肿瘤的位置以及疾病的分期。该患者出现症状性贫血,病情检查显示胃炎和远端胃小肿瘤。活检证实腺癌,超声内窥镜 (EUS) 将该肿瘤分期为 T2 N0。分期扫描显示没有远处转移性疾病的证据。鉴于该患者患有相对早期的肿瘤,我们选择进行前期手术,在这种情况下需要进行远端胃切除术。该视频展示了一位经验丰富的胃外科医生进行开腹远端胃切除术和“扩展”D1 淋巴结清扫术的技术。
尽管在过去几十年中,美国的胃癌发病率急剧下降,但胃癌仍然是癌症相关死亡的重要原因。尽管分期方式、手术治疗和围手术期护理有了显著改善,但大多数胃癌患者的预后仍然很差。这主要是由于这种癌症的侵袭性生物学以及大多数患者就诊的疾病晚期的结果。危险因素包括 幽门螺杆菌 和 EB 病毒 (EBV) 感染、恶性贫血、既往胃切除术、吸烟和高盐摄入量。大约 10% 的胃癌是由遗传性癌症综合征引起的,包括遗传性弥漫性胃癌 (HDGC),其特征是 E-钙粘蛋白 (CDH1) 基因的种系突变,以及遗传性非息肉病性结直肠癌 (HNPCC) 综合征,其特征是 DNA 错配修复基因的种系突变。最近,对胃癌的全面分子评估导致了一种分类方案,该方案定义了 4 种主要基因组亚型及其大致频率:EBV 感染的肿瘤 (9%)、微卫星不稳定 (MSI 高) 肿瘤 (22%)、基因组稳定的肿瘤 (20%) 和染色体不稳定的肿瘤 (50%)。1
提示胃癌诊断的典型症状很少(如果有的话),这解释了为什么这种癌症经常在晚期被诊断出来。早期症状,如上腹痛、消化不良和胃酸反流,是非特异性的,以至于大多数患者只是用抗酸剂进行经验性治疗,而不做进一步检查。随着疾病的进展,症状变得更加突出和不祥,包括吞咽困难、恶心、呕吐、早饱、厌食、疲劳和体重减轻等主诉。胃癌的位置和组织学类型通常决定了症状复杂性,从近端肿瘤的吞咽困难到梗阻性远端肿瘤的呕吐,再到弥漫性(塑料线炎)肿瘤的早期饱腹和体重减轻。2,3
这位患者是一位 84 岁的绅士,有胃炎病史和慢性胃食管交界处狭窄,他因疲劳和呼吸急促的症状到初级保健医生处就诊。获得全血细胞计数,显示患者贫血。他否认腹痛、恶心、呕吐、排便习惯改变、进食困难或体重减轻。
胃癌患者的体格检查通常无明显异常,可能除了上腹部压痛和不太可能触及的上腹部肿块。典型的同名体格检查发现,例如 Virchow 结、Sister Mary Joseph 的脐周淋巴结和 Blumer 搁架,很少出现,但当看到时提示晚期转移性疾病。同样,胃癌患者出现恶病质、黄疸、腹水和肝肿大通常意味着无法治愈的转移性疾病。我们的病人面貌很好,检查时他的腹部很软,没有可触及的肿块。
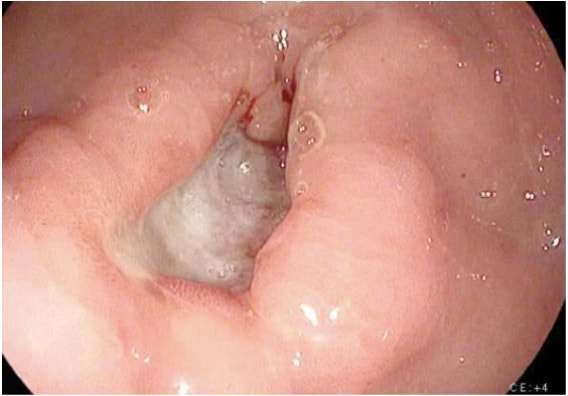
胃癌病情检查的影像学检查包括各种研究。胃癌的诊断通常很容易通过内窥镜检查和活检来确定(图 1)。内窥镜检查确定肿瘤在胃内的位置和范围,当与内窥镜超声 (EUS) 结合使用时,可以准确估计肿瘤浸润深度(T 分期)。EUS 是确定胃癌 T 分期最敏感的方式,EUS 能够评估区域淋巴结和可疑淋巴结的穿刺活检,以确认淋巴结受累(N 分期)。应进行胸部、腹部和盆腔的 CT 扫描,以评估远处转移扩散,例如向肺、肝、腹膜或切除区域外的淋巴结扩散。此外,CT 扫描在检测可能代表腹膜肿瘤扩散的少量腹水方面也很敏感,并且可以通过图像引导方式取样以进行细胞学检查。虽然在胃癌的术前分期中不常规推荐 PET 和 PET-CT 扫描,但它们肯定会提供额外的有用信息。PET 在检测原发性肿瘤方面敏感性较低,尤其是在早期和弥漫性胃癌中,但 PET 在检测区域淋巴结转移方面具有比 CT 更高的特异性 ( ̃90% vs. ̃60%) 并且对检测肝、肺和远处淋巴结转移具有合理的敏感性。4 此外,PET 可用于监测肿瘤对新辅助化疗的反应,因为它可以在早期准确检测对治疗的反应者,从而使临床医生能够使患者尽可能积极地接受化疗方案。
局部晚期癌症 (T3+/N+) 患者考虑通过腹腔镜进行额外分期。分期腹腔镜检查可以在计划的剖腹手术之前立即进行,也可以作为考虑术前治疗的患者的治疗前程序进行。分期腹腔镜检查通过识别影像学隐匿性腹膜和肝脏转移以及细胞学阳性,使超过 30% 的患者分期。5
胃癌通常通过淋巴结扩散或血行扩散,通常转移到肝脏、肺或腹膜。它也可以直接扩散到邻近器官,例如胰腺和横结肠。胃癌唯一可能的治愈性疗法是手术。即使采用完全的切缘阴性切除和(新)辅助治疗,5 年生存率仍然很低,为 ~40%。
在美国,胃癌最常见的治疗模式历来是前期手术,然后是高危 (T3/4、淋巴结阳性、黏着性差) 肿瘤患者的辅助放化疗(如 Intergroup 0116 试验所述)。6 然而,该试验中只有 64% 的患者能够按计划接受术后放化疗,因此许多人赞成对此类患者进行围手术期化疗,如英国医学研究委员会进行的 MAGIC 试验所述。在该试验中,患者被随机分配接受围手术期化疗 (术前和术后三个周期的表柔比星、顺铂和 5-氟尿嘧啶 (ECF))和手术或单独手术。与单独手术组相比,围手术期化疗组的 5 年生存率更高 (36% vs. 23%)。7 虽然只有 ~ 40% 的患者通过这种治疗方法完成了所有推荐的治疗,但超过 85% 的患者接受了所有 3 个计划的术前化疗周期,并且 所有 患者都至少接受了一个周期的化疗。对于高危肿瘤患者,在手术前至少进行几个周期的全身治疗具有几个优点:(1) 它允许对可能的微转移性疾病进行早期治疗;(2) 可以监测 体内 肿瘤对治疗的反应,例如使用 PET-CT 扫描成像;(3) 可以选择那些肿瘤生物学特别差但发展为早期转移性疾病的患者,因此不会从胃切除术中获得生存获益。7
切缘阴性 (R0) 完全切除仍然是胃腺癌唯一可能治愈的治疗方法。手术的选择取决于肿瘤的位置以及疾病的分期。组织学分级良好的浅表浸润性 (T1a) 胃癌可通过内镜黏膜切除术或楔形切除术治疗,伴或不伴前哨淋巴结活检。我们来自日本的外科同事已经广泛描述了这种程序,鉴于该国筛查性内窥镜检查的普遍性,胃癌经常在早期被诊断出来。由于美国大多数患者表现为有症状的局部晚期肿瘤,因此主要的手术问题是哪种手术的治愈机会最大,并发症发生率和死亡率可接受。许多患者不适合任何外科手术,要么是因为他们的身体状况不佳,要么是因为在术前影像学检查或腹腔镜检查时观察到转移性疾病。对于适合胃切除术的患者,选择包括全胃切除术、近端胃切除术和远端胃切除术。世界范围内在腹腔镜下进行这些手术的经验越来越多,短期结局和淋巴结检出率以及生存结局与传统的开放手术相当。然而,美国绝大多数胃癌切除术仍然通过开放方法进行。
应考虑立即手术切除的患者包括早期 (T1/T2 N0) 胃癌患者,以及需要立即缓解出血或高度肿瘤相关管腔梗阻的患者。然而,后一类患者的围手术期发病率和死亡率很高,必须仔细权衡切除可能的好处。局部晚期胃癌患者是术前化疗或放化疗的良好候选者。
由于该患者患有相对较早期的肿瘤 (uT2N0),并且相对于他的年龄来说健康状况非常好,因此他接受了远端胃切除术的前期手术。我们认为,开放性远端胃切除术限制了潜在低风险癌症新辅助化疗过度治疗的风险,同时如果最终病理报告显示更晚期 (例如,T3+/N+) 癌症,我们可以选择为他提供辅助治疗。
胃切除的范围取决于原发肿瘤的位置和范围。前瞻性随机试验未能证明,对于远端胃肿瘤患者,全胃切除术优于远端次全胃切除术的生存优势。8 因此,对于那些可以从肿瘤获得 5 至 6 cm 切缘同时仍保持合理大小的胃残余物的患者,应进行更保守的胃切除术,因为与全胃切除术相比,这可提供相同的生存率、更低的发病率和更好的生活质量。8 尽管如此,如有必要,应进行全胃切除术以实现 R0 切除,因为阳性切除切缘(R1 切除)导致生存率非常低。在荷兰胃癌试验中,与切除切缘阴性的患者相比,10% 的患者切除切缘阳性,因此 3 年生存率较低 (18% 对 63%)。9 然而,显微镜下受累的切缘似乎只影响那些淋巴结转移 5 个或更少患者的长期生存。对于近端胃癌,许多外科医生更喜欢全胃切除术而不是近端胃切除术,因为后者会长期导致症状性胃酸反流。
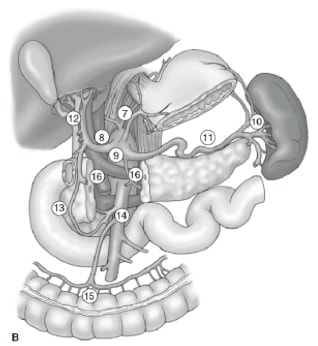
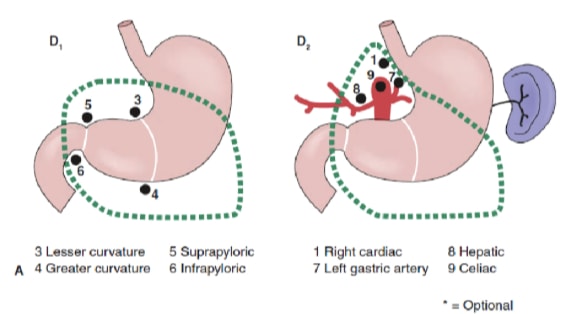
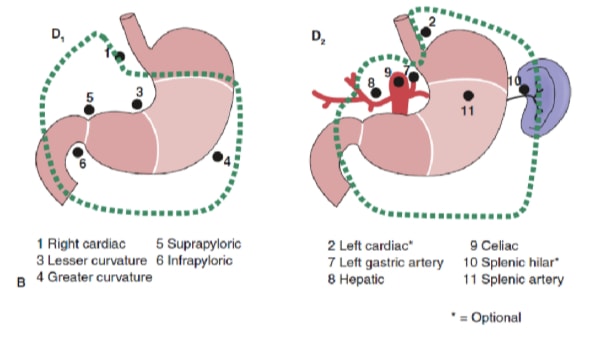
淋巴结清扫的程度是胃癌管理中最具争议的问题之一。胃癌登记处的报告和其他回顾性研究已将根治性胃切除术联合扩大 (D2) 淋巴结清扫术作为日本可治愈胃癌的标准治疗标准。10,11 日本胃癌研究会将胃的引流淋巴结盆分为 16 个站点,包括 6 个胃周站点(图 2a)和 10 个沿主要血管和胰腺附近的区域站点(图 2b)。淋巴结清扫的程度由名称 D 表示。D1 夹层仅包括胃周围淋巴结(第 1 至第 6 站);a D2 夹层包括沿肝总动脉、左胃动脉、腹腔动脉和脾动脉(第 7 至第 11 站)的淋巴结;D3 夹层包括肝门内和主动脉附近的其他淋巴结(第 12 至 16 站)(图 3)。
在西方患者中进行了两项大型前瞻性随机试验,比较了 D1 清扫术与 D2 清扫术的结局。这两项研究中较大的一项,即荷兰胃癌组试验,为期 15 年的随访表明,D2 淋巴结清扫术没有长期总生存期获益(29%% 对 21%, P = .34),但确实显示胃癌相关死亡率显著降低(37% 对 48%, P = .01)和比 D1 手术更低的局部区域复发率。9 然而,在接受更广泛的 D2 淋巴结清扫术的患者中,术后发病率 (43% 对 25%) 和死亡率 (10% 对 4%) 显着更高,这在很大程度上是由于该组为实现完全淋巴结清扫而进行的脾切除术和胰腺切除术次数更多。9 同样,医学研究委员会进行的英国合作试验报告称,与伴随脾切除术和胰腺切除术的高发生率相关,在随机接受 D2 夹层治疗的患者中,发病率增加,对总生存期或无复发生存期没有益处。12
尽管有这两项研究的结果,但研究人员认为,如果扩大 D2 淋巴结清扫术后的并发症发生率可以降低,那么 D2 清扫术带来的生存获益,正如亚洲经验丰富的中心所报告的那样,可能会转化为西方胃癌患者。13 因此,意大利胃癌研究组进行了一项 III 期试验,将患者随机分配到高容量中心进行保留胰腺的 D2 淋巴结清扫术或 D1 淋巴结清扫术,这些外科医生通过观察日本的外科医生完成了该技术的严格培训。他们报告了接受 D2 夹层的患者的发病率 (17.9%) 和死亡率 (3.0%) 令人印象深刻的低水平,其中胰腺切除术或脾切除术仅针对直接肿瘤浸润进行。14 然而,他们发现 D1 组和 D2 组之间的 5 年总生存期没有差异(66.5% 对 64.2%; P = 0.695),尽管亚组分析表明 D2 淋巴结清扫术可能对 T2-T4 和/或淋巴结阳性肿瘤患者有益。14
目前尚不清楚 D2 淋巴结清扫术是否只是一种彻底的分期手术,或者是否对某些患者亚群(如 N2 病患者)有治疗益处。应该注意的是,根据最新的第七版美国癌症联合委员会 (AJCC) 分期手册,胃癌患者的准确分期需要评估至少 15 个淋巴结。15 然后根据阳性淋巴结的数量进行分期,分为 N1(1 至 2 个阳性淋巴结)、N2(3 至 6 个阳性淋巴结)、N3a(7 至 15 个阳性淋巴结)和 N3b(16+ 个阳性淋巴结)类别。研究表明,患者生存率的提高与标本中检查的淋巴结数量增加之间存在相关性。16 当然,这可能只是反映了更准确的分期,而不是手术的治疗益处。然而,有间接证据表明,更广泛的淋巴结切除术可降低局部区域复发率,这可能转化为生存获益。事实上,在台湾的一个中心进行的一项随机试验发现,与接受 D1 夹层的患者 (53.6%) 相比,接受 D3 夹层的患者 (59.5%) 的总体 5 年生存率更高。13
对于过去十年在 MGH 接受治疗的患者,我们报告了胃切除术和 D2 淋巴结清扫术后的发病率和死亡率分别为 17% 和 0%,并且我们离体解剖标本的中位淋巴结检出率已增加到 40 个淋巴结。在美国,次全胃切除术和全胃切除术的中位住院时间平均为 9-10 天,但许多患者在 7 天内出院。胃次全切除术和全胃切除术的长期并发症包括维生素和矿物质缺乏,尤其是维生素 B12、维生素 D、铁和钙,以及典型的胃切除术后综合征,例如碱性反流性胃炎、倾倒综合征、Roux 淤滞综合征和传入肢体综合征。
手术是局限性胃癌唯一可能治愈的治疗方法,但即使对于那些可以切除 R0 的患者,围手术期化疗或术后放化疗也只能实现 35% 至 40% 的 5 年生存率。胃癌治疗的未来进展取决于更好的全身疗法以及早期诊断技术的发展。
A. 远端胃切除术:
胃腺癌,管状,错配修复蛋白表达不稳定。(见概要报告)。
B. 淋巴结活检,第 8 站:
4 个淋巴结 (0/4) 没有恶性肿瘤的证据。
C. 淋巴结活检,11 号站:
两个淋巴结 (0/2) 没有恶性肿瘤的证据。
D. 淋巴结活检,第 7 站:
两个淋巴结 (0/2) 没有恶性肿瘤的证据。
E. 淋巴结活检,第 3 站:
没有证据表明一个淋巴结 (0/1) 存在恶性肿瘤。
概要报告:
肿瘤分期摘要:pT1bN0。
特定部位:胃窦。
肿瘤大小(最大尺寸):0.3 cm(在载玻片上测量)。
WHO 分类: 管状腺癌。
组织学分级:G1(分化良好)
浸润程度:pT1b (肿瘤侵入粘膜下层)。
小血管(血液/淋巴管)浸润:无。
大血管(静脉)浸润:无。
神经周围浸润:无。
近端胃切缘:未受浸润性癌累及。
远端十二指肠缘:未受浸润性癌影响。(间隙 = 0.4 厘米)。
区域淋巴结:pN0(无区域淋巴结转移):检查了 31 个淋巴结。
*淋巴结总数包括所有标本部分。主标本 (标本 A) 包含 22 个淋巴结。
HER2 免疫组化:Her 2 评分 0/阴性(< 10% 的肿瘤细胞无反应性或非常微弱的膜染色)。
其他研究:
MLH1 和 PMS 丢失。
MSH2 和 MSH6 完好无损。
其他发现:
胃窦粘膜伴肠上皮化生和高度异型增生。
胃底腺息肉。
EB 病毒编码的 RNA (EBER) 为阴性。
我们的患者手术恢复良好,并于术后第 5 天出院。他的最终病理报告将肿瘤分期为 T1bN0,切除切缘为阴性。我们实现了出色的淋巴结收获(31 个淋巴结),因此我们对这个阶段分配的准确性充满信心。因此,他不需要辅助治疗,并且他的长期预后非常好。
固定腹壁牵开器系统对此作非常有帮助;我们使用了 Bookwalter,但其他选项包括 Thompson 和 Omni 牵开器系统。十二指肠和胃用吻合器横切,在本例中为 Endo-GIA 吻合器。血管密封装置,例如 LigaSure 装置或 Harmonic 手术刀,对于有效控制小血管非常有帮助。较大的血管,例如左胃动脉,可以用血管吻合器分开或通过传统的缝合结扎来控制。
作者没有要披露的冲突。
本视频文章中提到的患者已同意被拍摄,并且知道他的个人健康信息将以身份不明的方式在网上发布。
References
- 癌症基因组图谱研究网络。胃腺癌的综合分子特征。 自然界。 2014;513(7517):202-209. doi:10.1038/nature13480.
- 胃癌。在:Fischer J, ed. 精通外科。 第 7 版。费城,宾夕法尼亚州:Lippincott Williams & Wilkins;2017.
- Yoon SS,朴 DJ。胃腺。在:Cameron JL,Cameron AM,编辑 。当前的外科治疗。 第 11 版。宾夕法尼亚州费城:桑德斯,2014:87-95。
- Yun M. 使用 18 F-FDG PET/CT. 对胃癌代谢进行成像。 J 胃癌。 2014 年;14(1):1-6. doi:10.5230/jgc.2014.14.1.1.
- Ikoma N、Blum M、Chiang YJ 等人。胃癌放射学隐匿性腹膜癌分期腹腔镜和灌洗细胞学检查的检出率。 Ann Surg Oncol. 2016;23(13):4332-4337. doi:10.1245/s10434-016-5409-7.
- Macdonald JS、Smalley SR、Benedetti J 等人。手术后放化疗与单独手术治疗胃或胃食管交界处腺癌的比较。 N Engl J Med. 2001;345(10):725-730. doi:10.1056/NEJMoa010187.
- Cunningham D、Allum WH、Stenning SP 等人。围手术期化疗与单独手术治疗可切除胃食管癌。 N Engl J Med. 2006;355(1):11-20. doi:10.1056/NEJMoa055531.
- Bozzetti F, Marubini E, Bonfanti G, Miceli R, 钢琴 C, Gennari L;意大利胃肠道肿瘤研究组。胃癌的次全胃切除术与全胃切除术:意大利一项多中心随机试验的五年生存率。 安外科。 1999;230(2):170-178. doi:10.1097/00000658-199908000-00006.
- Bonenkamp JJ、Hermans J、Sasako M 等人;荷兰胃癌组。胃癌的扩展淋巴结清扫术。 N Engl J Med. 1999;340(12):908-914. doi:10.1056/NEJM199903253401202.
- Maruyama K, Okabayashi K, Kinoshita T. 日本胃外科的进展及其根基性的局限性。 世界外科杂志 1987;11(4):418-425. doi:10.1007/BF01655804.
- Sasako M, McCulloch P, 木下 T, 丸山 K.评估淋巴结清扫术治疗胃癌疗效的新方法。 Br J 外科。 1995;82(3):346-351. doi:10.1002/bjs.1800820321.
- Cuschieri A、Weeden S、Fielding J 等人;外科合作组。胃癌 D1 和 D2 切除术后的患者生存率:MRC 随机手术试验的长期结果。 Br J 癌症。 1999;79(9-10):1522-1530. doi:10.1038/sj.bjc.6690243..
- Wu CW, Hsiung CA, Lo SS, et al.胃癌患者的淋巴结清扫术:一项随机对照试验。 柳叶刀 Oncol。 2006;7(4):309-315. doi:10.1016/S1470-2045(06)70623-4.
- Degiuli M, Sasako M, Ponti A;意大利胃癌研究组。意大利胃癌研究组 D1 与 D2 切除术治疗胃癌的随机临床试验的发病率和死亡率。 Br J 外科。 2010;97(5):643-649. doi:10.1002/bjs.6936.
- Edge SB、Byrd DR、Compton CC、Fritz AG、Greene F、Trotti A,编辑 AJCC 癌症分期手册。 第 7 版。纽约州纽约市:施普林格;2010.
- 史密斯 DD,施瓦茨 RR,施瓦茨 RE。胃癌胃切除术后淋巴结总数对分期和生存率的影响:来自美国大型人群数据库的数据。 J Clin Oncol。 2005;23(28):7114-7124. doi:10.1200/JCO.2005.14.621.
Cite this article
开阔远端胃切除术。 J Med Insight. 2024;2024(191). doi:10.24296/jomi/191.


.jpg&w=3840&q=75&dpl=dpl_Ca7gcJXjbQN6bK8aruk8U4KsAWv7)
.jpg&w=3840&q=75&dpl=dpl_Ca7gcJXjbQN6bK8aruk8U4KsAWv7)