Açık Distal Gastrektomi (Açık Distal Gastrektomi)
Main Text
Table of Contents
Tam bir marjinal negatif (R0) rezeksiyon, gastrik adenokarsinom için potansiyel olarak küratif tek tedavi olmaya devam etmektedir. Operasyon seçimi, tümörün konumuna ve hastalığın evresine bağlıdır. Bu hastada semptomatik anemi ve tetkiklerde gastrit ve distal midede küçük bir tümör saptandı. Biyopsiler adenokarsinomu doğruladı ve endoskopik ultrasonografi (EUS) ile bu tümör T2 N0 olarak evrelendirildi. Evreleme taramaları uzak metastatik hastalık kanıtı göstermedi. Bu hastanın nispeten erken evre bir tümörü olduğu göz önüne alındığında, bu durumda distal gastrektomi gerektiren ön ameliyatla devam etmeyi seçtik. Bu video, deneyimli bir mide cerrahının "genişletilmiş" D1 lenf nodu diseksiyonu ile açık distal gastrektomi yapma tekniğini göstermektedir.
Amerika Birleşik Devletleri'nde mide kanseri insidansı son birkaç on yılda önemli ölçüde azalmış olsa da, mide kanseri kansere bağlı ölümlerin önemli bir nedeni olmaya devam etmektedir. Evreleme modaliteleri, cerrahi tedavi ve perioperatif bakımdaki önemli gelişmelere rağmen, mide kanserli hastaların çoğunun prognozu kötüdür. Bu, büyük ölçüde, bu kanserin agresif biyolojisinin yanı sıra çoğu hastanın klinisyene başvurduğu hastalığın ileri evresinin bir sonucudur. Risk faktörleri arasında Helicobacter pylori ve Epstein-Barr virüsü (EBV) enfeksiyonu, pernisiyöz anemi, geçirilmiş mide rezeksiyonu, sigara kullanımı ve yüksek tuz alımı yer alır. Mide kanserlerinin yaklaşık %10'u, E-kaderin (CDH1) genindeki germ hattı mutasyonları ile karakterize kalıtsal diffüz mide kanseri (HDGC) ve DNA uyumsuzluk onarım genlerindeki germ hattı mutasyonları ile karakterize kalıtsal polipozis olmayan kolorektal kanser (HNPCC) sendromu dahil olmak üzere kalıtsal kanser sendromlarına bağlıdır. Son zamanlarda, mide kanserinin kapsamlı bir moleküler değerlendirmesi, 4 ana genomik alt tipi ve bunların yaklaşık frekanslarını tanımlayan bir sınıflandırma şemasına yol açmıştır: EBV ile enfekte tümörler (% 9), mikrosatellit kararsız (MSI yüksek) tümörler (% 22), genomik olarak stabil tümörler (% 20) ve kromozomal olarak kararsız tümörler (% 50). 1
Mide kanseri tanısını düşündüren çok az klasik semptom vardır, bu da bu kanserin neden sıklıkla ileri bir aşamada teşhis edildiğini açıklar. Epigastrik ağrı, dispepsi ve asit reflü gibi erken semptomlar o kadar spesifik değildir ki, çoğu hasta daha fazla araştırma yapılmadan ampirik olarak antasitlerle tedavi edilir. Hastalık ilerledikçe semptomlar daha belirgin ve daha uğursuz hale gelir ve yutma güçlüğü, bulantı, kusma, erken doyma, iştahsızlık, yorgunluk ve kilo kaybı gibi şikayetleri içerir. Mide kanserinin yeri ve histolojik tipi, proksimal tümörler için disfajiden distal tümörleri tıkamak için kusmaya, yaygın tip (linitis plastica) tümörler için erken doygunluk ve kilo kaybına kadar sıklıkla semptom kompleksini belirler. 2,3
Bu hasta, gastrit öyküsü ve kronik gastroözofageal bileşke darlığı olan 84 yaşında bir beyefendi olup, yorgunluk ve nefes darlığı semptomları ile birinci basamak hekimine başvurmuştur. Tam kan sayımı yapıldı ve hastanın anemik olduğu görüldü. Karın ağrısı, mide bulantısı, kusma, bağırsak alışkanlıklarında değişiklik, yemek yeme güçlüğü veya kilo kaybını reddetti.
Mide kanserli bir hastanın fizik muayenesi, belki de epigastrik abdominal hassasiyet ve daha az olasılıkla palpe edilebilir bir epigastrik kitle dışında, tipik olarak dikkat çekicidir. Virchow'un düğümü, Rahibe Mary Joseph'in periumbilikal düğümü ve Blumer'in rafı gibi klasik isimsiz fiziksel bulgular nadiren bulunur, ancak görüldüğünde ilerlemiş metastatik hastalığa işaret eder. Benzer şekilde, bir mide kanseri hastasında kaşeksi, sarılık, asit ve hepatomegali varlığı tipik olarak tedavi edilemez metastatik hastalığı gösterir. Hastamızın görünüşü iyiydi ve muayenede yumuşak bir karın mevcuttu ve ele gelen kitle yoktu.
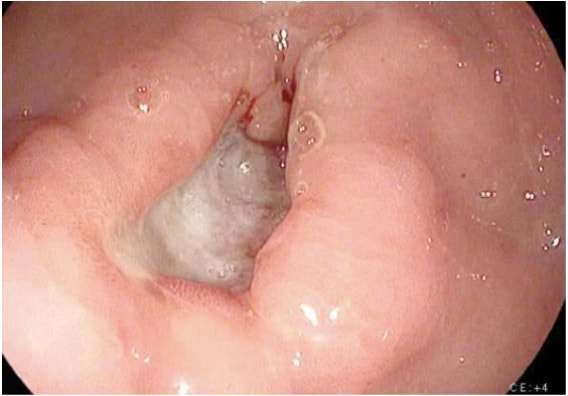
Mide kanserinin incelenmesi için görüntüleme çeşitli çalışmaları içerir. Mide kanseri tanısı genellikle biyopsi ile yapılan endoskopi ile kolayca konulur (Şekil 1). Endoskopi, tümörün mide içindeki yerini ve kapsamını tanımlar ve endoskopik ultrason (EUS) ile birleştirildiğinde, tümör invazyonunun derinliğinin (T aşaması) doğru bir şekilde tahmin edilmesini sağlar. EUS, mide kanserinin T evresini belirlemede en duyarlı modalitedir ve EUS, nodal tutulumu (N evresi) doğrulamak için bölgesel lenf düğümlerinin değerlendirilmesini ve şüpheli düğümlerin iğne biyopsisini sağlar. Rezeksiyon alanı dışındaki akciğerler, karaciğer, periton veya lenf düğümleri gibi uzak metastatik yayılımı değerlendirmek için göğüs, karın ve pelvisin BT taraması yapılmalıdır. Ek olarak, bir BT taraması, peritoneal tümör yayılımını temsil edebilecek ve sitolojik inceleme için görüntü kılavuzluğunda örneklenebilen küçük miktarlarda asitleri bile tespit etmede hassastır. PET ve PET-BT taramaları mide kanserinin preoperatif evrelemesinde rutin olarak önerilmese de, kesinlikle ek yararlı bilgiler sağlayabilirler. PET, özellikle erken ve diffüz tip mide kanserlerinde primer tümörü tespit etmede düşük bir duyarlılığa sahiptir, ancak PET, bölgesel lenf nodu metastazlarının saptanmasında BT'den daha yüksek bir özgüllüğe sahiptir ( ̃%90'a karşı ̃%60) ve karaciğer, akciğer ve uzak lenf nodu metastazlarının saptanması için makul bir duyarlılığa sahiptir. 4 Ek olarak, PET, neoadjuvan kemoterapiye tümör yanıtını izlemek için kullanılabilir, çünkü tedaviye yanıt verenleri erken bir aşamada doğru bir şekilde tespit eder ve böylece klinisyenin hastaları mümkün olduğunca aktif bir kemoterapi rejiminde tutmasını sağlar.
Lokorejyonel olarak ileri evre kanserli (T3+/N+) hastalar laparoskopi ile ek evreleme için düşünülür. Evreleme laparoskopisi, planlanan laparotomiden hemen önce yapılabileceği gibi, preoperatif tedavi düşünülen hastalarda yapılan bir ön tedavi işlemi olarak da yapılabilir. Evreleme laparoskopisi, radyolojik olarak gizli periton ve karaciğer metastazlarının tanımlanması ve pozitif sitoloji ile hastaların %30'undan fazlasını yukarı evrelendirir. 5
Mide kanseri tipik olarak lenf düğümleri yoluyla veya hematojen olarak yayılır ve genellikle karaciğere, akciğerlere veya peritona metastaz yapar. Ayrıca pankreas ve enine kolon gibi bitişik organları da içerecek şekilde doğrudan yayılabilir. Mide kanseri için tek potansiyel iyileştirici tedavi cerrahidir. Komple, marjinal negatif rezeksiyon ve (neo) adjuvan tedavi ile bile, 5 yıllık sağkalım oranı ~% 40 oranında düşük kalmaktadır.
Amerika Birleşik Devletleri'nde mide kanseri için en yaygın tedavi paradigması, tarihsel olarak ön cerrahi olmuştur, bunu yüksek riskli (T3 / 4, düğüm pozitif, zayıf kohezif tip) tümörleri olan hastalar için adjuvan kemoradyasyon tedavisi (Intergroup 0116 çalışmasında açıklandığı gibi) izlemiştir. 6 Bununla birlikte, bu çalışmadaki hastaların sadece% 64'ü planlandığı gibi postoperatif kemoradyoterapiyi alabilmiştir ve bu nedenle, İngiliz Tıbbi Araştırma Konseyi tarafından yürütülen MAGIC çalışmasında açıklandığı gibi, bu tür hastalar için perioperatif kemoterapiyi tercih etmektedir. Bu çalışmada, hastalar perioperatif kemoterapi (ameliyat öncesi ve sonrası üç döngü Epirubisin, Sisplatin ve 5-florourasil (ECF)) ve tek başına cerrahi veya cerrahi almak üzere randomize edildi. Perioperatif kemoterapi grubunda beş yıllık sağkalım oranları tek başına cerrahi gruba göre daha yüksekti (%36'ya karşı. %23). 7 Hastaların sadece ~ %40'ı bu tedavi yaklaşımıyla önerilen tüm tedaviyi tamamlasa da, hastaların %85'inden fazlası planlanan 3 preoperatif kemoterapi döngüsünün tümünü alır ve tüm hastalar en az bir kür kemoterapi alır. Yüksek riskli tümörleri olan hastalar için ameliyattan önce en az birkaç kür sistemik tedavinin uygulanması çeşitli avantajlar sağlar: (1) olası mikrometastatik hastalığın erken tedavisine izin verir; (2) PET-CT tarama görüntülemesi gibi tedaviye in vivo tümör yanıtı izlenebilir; ve (3) özellikle kötü tümör biyolojisine sahip, erken metastatik hastalık geliştiren ve bu nedenle gastrektomiden sağkalım yararı elde etmeyecek olan hastalar için seçim yapılabilir. 7
Tam bir marjinal negatif (R0) rezeksiyon, gastrik adenokarsinom için potansiyel olarak küratif tek tedavi olmaya devam etmektedir. Operasyon seçimi, tümörün konumuna ve hastalığın evresine bağlıdır. Uygun histolojik dereceli yüzeyel invaziv (T1a) mide kanserleri, eşlik eden sentinel lenf nodu biyopsisi ile veya bu biyopsi olmadan endoskopik mukozal rezeksiyon veya wedge eksizyon ile tedavi edilebilir. Bu tür prosedürler, o ülkede tarama endoskopik muayenelerinin yaygınlığı göz önüne alındığında, mide kanserlerinin sıklıkla erken evrede teşhis edildiği Japonya'daki cerrahi meslektaşlarımız tarafından kapsamlı bir şekilde tanımlanmıştır. Amerika Birleşik Devletleri'ndeki hastaların çoğunluğu semptomatik, lokorejyonel olarak ilerlemiş tümörlerle başvurduğundan, birincil cerrahi soru, hangi prosedürün kabul edilebilir morbidite ve mortalite ile tedavi için en büyük şansı sunduğudur. Birçok hasta ya tıbbi olarak uygun olmadığı için ya da preoperatif görüntüleme çalışmalarında görülen metastatik hastalığın varlığı ya da laparoskopi sırasında herhangi bir cerrahi işlem için aday değildir. Gastrik rezeksiyon için aday olan hastalar için seçenekler arasında total, proksimal ve distal gastrektomi bulunur. Bu prosedürlerin laparoskopik olarak uygulanmasında, iyileştirilmiş kısa vadeli sonuçlar ve nodal verimler ve geleneksel açık prosedürlerle eşit sağkalım sonuçları ile dünya çapında artan bir deneyim vardır. Bununla birlikte, Amerika Birleşik Devletleri'nde mide kanseri için rezeksiyonların büyük çoğunluğu hala açık yaklaşımla gerçekleştirilmektedir.
Acil cerrahi rezeksiyon için düşünülmesi gereken hastalar arasında erken evre (T1 / T2, N0) mide kanseri olanlar ve kanamanın acil palyasyonu veya yüksek dereceli tümörle ilişkili luminal tıkanıklık gerektiren hastalar bulunur. Bununla birlikte, bu son hasta popülasyonundaki perioperatif morbidite ve mortalite oranları önemlidir ve rezeksiyonun olası faydalarına karşı dikkatli bir şekilde tartılmalıdır. Lokorejyonel olarak ilerlemiş mide kanserli hastalar preoperatif kemoterapi veya kemoradyoterapi için iyi adaylardır.
Bu hastanın nispeten erken evre bir tümörü (uT2N0) olması ve yaşına göre sağlık durumunun oldukça iyi olması nedeniyle, distal gastrektomi ile ön ameliyat önerildi. Açık distal gastrektominin, potansiyel olarak düşük riskli bir kanser için neoadjuvan kemoterapi ile aşırı tedavi riskini sınırladığını ve son patoloji raporunun daha ileri (örneğin, T3 + / N +) bir kanser ortaya çıkarması durumunda ona adjuvan tedavi sunma seçeneğini bıraktığını hissettik.
Gastrik rezeksiyonun kapsamı, primer tümörün yeri ve kapsamı ile belirlenir. Prospektif, randomize çalışmalar, distal mide tümörü olan hastalarda total gastrektomi için distal, subtotal gastrektomiye göre sağkalım avantajı gösteremedi. 8 Bu nedenle, makul büyüklükte bir mide kalıntısını korurken tümörden 5 ila 6 cm'lik bir marj elde edilebilen hastalar için, daha konservatif bir mide rezeksiyonu yapılmalıdır, çünkü bu, total gastrektomiye göre daha az morbidite ve daha iyi bir yaşam kalitesi ile eşdeğer bir sağkalım oranı sağlar. 8 Bununla birlikte, pozitif rezeksiyon sınırları (R1 rezeksiyonları) çok kötü sağkalıma yol açtığından, R0 rezeksiyonu elde etmek için gerekirse total gastrektomi yapılmalıdır. Hollanda mide kanseri çalışmasında, hastaların% 10'unda pozitif rezeksiyon marjı ve buna bağlı olarak daha düşük 3 yıllık sağkalım (% 18'e karşı% 63) negatif rezeksiyon marjı olanlara kıyasla vardı. 9 Bununla birlikte, mikroskobik olarak tutulan sınırlar, yalnızca beş veya daha az lenf nodu metastazı olan hastalarda uzun süreli sağkalımı etkiliyor gibi görünmektedir. Proksimal mide kanserleri için, birçok cerrah, ikinci prosedürle semptomatik asit reflüsünün uzun süreli sekelleri nedeniyle proksimal gastrektomi yerine total gastrektomiyi tercih eder.
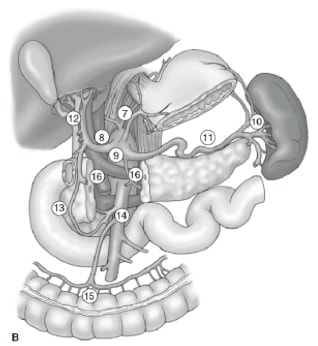
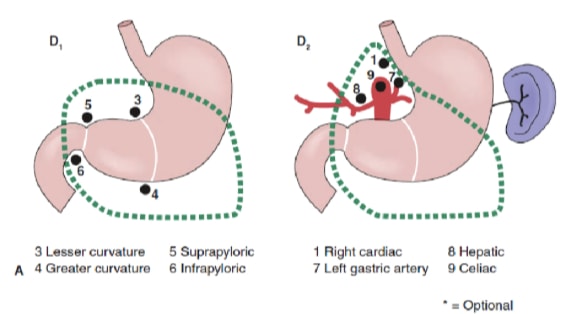
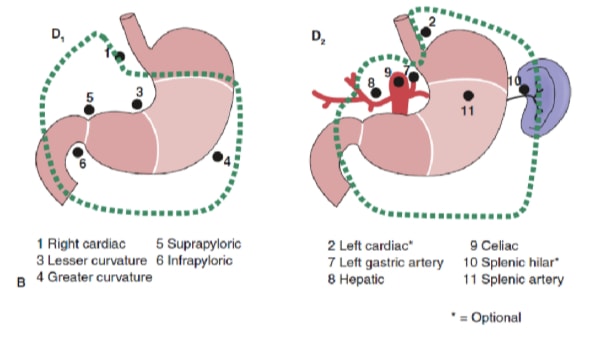
Lenf nodu diseksiyonunun yaygınlığı mide kanserinin tedavisinde en tartışmalı konulardan biridir. Mide Kanseri Kayıt Defterinden elde edilen raporlar ve diğer retrospektif çalışmalar, Japonya'da tedavi edilebilir mide kanserinin tedavisi için genişletilmiş (D2) lenfadenektomi ile radikal gastrektomiyi standart bakım haline getirmiştir. 10,11 Japon Mide Kanseri Araştırma Derneği, midenin boşaltan lenf nodu havzalarını, 6 perigastrik istasyon (Şekil 2a) ve ana damarlar boyunca ve pankreasa bitişik 10 bölgesel istasyon (Şekil 2b) dahil olmak üzere 16 istasyona sınıflandırır. Lenf nodu diseksiyonunun kapsamı D adı ile gösterilir. Bir D1 diseksiyonu sadece perigastrik düğümleri içerir (istasyon 1 ila 6); bir D2 diseksiyonu, ortak hepatik, sol mide, çölyak ve splenik arterler boyunca lenf düğümlerini içerir (istasyon 7 ila 11); ve bir D3 diseksiyonu, porta hepatis içinde ve aorta bitişik (istasyon 12 ila 16) ek düğümler içerir (Şekil 3).
Batılı hastalarda D1 diseksiyonun sonuçlarını D2 diseksiyonun sonuçlarıyla karşılaştıran iki büyük, prospektif randomize çalışma yapılmıştır. Bu iki çalışmanın daha büyüğü olan Hollanda Mide Kanseri Grubu Çalışması'nın on beş yıllık takibi, D2 lenf nodu disetiği ile uzun vadeli genel sağkalım yararı göstermedi (% 29'a karşı% 21, P = .34), ancak mide kanserine bağlı ölüm oranı (% 37'ye karşı% 48, P = .01) ve D1 cerrahisinden daha düşük bir lokorejyonel nüks oranı gösterdi. 9 Bununla birlikte, daha kapsamlı D2 lenfadenektomi geçiren hastalarda postoperatif morbidite (%43'e karşı %25) ve mortalite (%10'a karşı %4) oranları anlamlı olarak daha yüksekti, bu da büyük ölçüde tam bir nod diseksiyonu elde etmek için bu grupta daha fazla sayıda splenektomi ve pankreatektomi yapılmasından kaynaklanıyordu. 9 Benzer şekilde, Tıbbi Araştırma Konseyi tarafından yürütülen İngiliz Kooperatif çalışması, D2 diseksiyonuna randomize edilen hastalarda genel veya nükssüz sağkalımda bir fayda olmaksızın, yüksek eşlik eden splenektomi ve pankreatektomi oranlarıyla ilişkili artmış bir morbidite bildirmiştir. 12
Bu iki çalışmanın bulgularına rağmen, araştırmacılar, genişletilmiş bir D2 lenf nodu diseksiyonu sonrası komplikasyon oranı azaltılabilirse, Asya'daki deneyimli merkezler tarafından bildirildiği gibi, bir D2 diseksiyonunun sağladığı sağkalım yararının, mide kanseri olan Batılı hastalara çevrilebileceğini savundular. 13 Bu nedenle, İtalyan Mide Kanseri Çalışma Grubu, Japonya'daki usta cerrahların gözlemi yoluyla teknikte titiz bir eğitimi tamamlayan cerrahlar tarafından hastaları yüksek hacimli merkezlerde pankreas koruyucu D2 lenfadenektomi veya D1 lenfadenektomiye randomize eden bir faz III çalışma yürüttü. Sadece doğrudan tümör invazyonu için pankreatektomi veya splenektomi yapılan D2 diseksiyonu yapılan hastalarda etkileyici derecede düşük morbidite (%17.9) ve mortalite (%3.0) oranları bildirdiler. 14 Bununla birlikte, D1 ve D2 grupları arasında 5 yıllık genel sağkalımda bir fark bulamadılar (% 66.5'e karşı% 64.2; P = 0.695), ancak alt grup analizleri D2 lenfadenektominin T2-T4 ve/veya düğüm pozitif tümörleri olan hastalar için faydalı olabileceğini düşündürmektedir. 14
Bir D2 lenf nodu diseksiyonunun sadece kapsamlı bir evreleme prosedürü olup olmadığı veya belirli hasta alt grupları (örneğin, N2 hastalığı olan hastalar) için terapötik bir fayda olup olmadığı belirsizliğini korumaktadır. Amerikan Kanser Ortak Komitesi (AJCC) Evreleme El Kitabı'nın en son yedinci baskısına göre mide kanserli hastaların doğru evrelemesinin en az 15 lenf nodunun değerlendirilmesini gerektirdiği unutulmamalıdır. 15 Düğüm evrelemesi daha sonra N1 (1 ila 2 pozitif düğüm), N2 (3 ila 6 pozitif düğüm), N3a (7 ila 15 pozitif düğüm) ve N3b (16+ pozitif düğüm) kategorilerine sahip pozitif düğümlerin sayısına dayanır. Çalışmalar, gelişmiş hasta sağkalımı ile örnekte incelenen daha fazla sayıda lenf nodu arasında bir ilişki olduğunu göstermiştir. 16 Elbette bu, prosedürün terapötik bir yararının aksine daha doğru bir evrelemeyi yansıtıyor olabilir. Bununla birlikte, daha kapsamlı lenfadenektomilerin daha düşük lokorejyonel nüks oranlarına yol açtığına dair dolaylı kanıtlar vardır ve bu bir sağkalım yararına dönüşebilir. Nitekim, Tayvan'da tek bir merkezde yürütülen randomize bir çalışma, D3 diseksiyonu geçiren hastalar (%59.5) ile D1 diseksiyonu geçirenlere (%53.6) kıyasla genel olarak 5 yıllık bir sağkalım avantajı tanımlamıştır. 13
Son on yılda MGH'de tedavi edilen hastalarda gastrektomi ve D2 lenfadenektomi sonrası morbidite ve mortalite oranları sırasıyla %17 ve %0 olarak bildirilmiştir ve ex vivo diseksiyon ile medyan lenf nodu verimimiz 40 noda yükselmiştir. Amerika Birleşik Devletleri'nde subtotal ve total gastrektomi için medyan kalış süresi ortalama 9-10 gündür, ancak birçok hasta 7 gün içinde taburcu edilir. Subtotal ve total gastrektominin uzun vadeli komplikasyonları arasında vitamin ve mineral eksiklikleri, özellikle B12 vitamini, D vitamini, demir ve kalsiyum ve alkalin reflü gastrit, dumping sendromu, Roux staz sendromu ve afferent ekstremite sendromu gibi klasik postgastrektomi sendromları yer alır.
Cerrahi, lokalize mide kanseri için potansiyel olarak küratif tek tedavidir, ancak R0 rezeksiyonunun mümkün olduğu hastalarda bile, perioperatif kemoterapi veya postoperatif kemoradyoterapi ile sadece %35 ila %40 5 yıllık sağkalım elde edilir. Mide kanserinin tedavisinde gelecekteki ilerleme, daha iyi sistemik tedavilerin yanı sıra daha erken tanı için tekniklerin geliştirilmesine bağlıdır.
A. DISTAL MIDE REZEKSIYONU:
Gastrik adenokarsinom, tübüler tip, uyumsuzluk onarım protein ekspresyonu kararsız. (Bkz. sinoptik rapor).
B. LENF NODU BIYOPSISI, İSTASYON 8:
Dört lenf nodunda malignite bulgusu yoktur (0/4).
C. LENF NODU BIYOPSISI, İSTASYON 11:
İki lenf nodunda malignite bulgusu yoktur (0/2).
D. LENF NODU BIYOPSISI, İSTASYON 7:
İki lenf nodunda malignite bulgusu yoktur (0/2).
E. LENF NODU BIYOPSISI, İSTASYON 3:
Bir lenf nodunda malignite bulgusu yoktur (0/1).
SINOPTIK RAPOR:
TÜMÖR EVRESİ ÖZETİ: pT1bN0.
ÖZEL BÖLGE: Gastrik antrum.
TÜMÖR BOYUTU (En büyük boyut): 0.3 cm (slaytta ölçüldüğü gibi).
DSÖ SINIFLANDIRMASI: Tübüler adenokarsinom.
HİSTOLOJİK DERECE: G1 (İyi diferansiyel)
İSTİLA KAPSAMI: pT1b (Tümör submukozayı istila eder).
KÜÇÜK DAMAR (KAN/LENFATIK) İSTİLASI: Yok.
BÜYÜK DAMAR (VENÖZ) İSTİLASI: Yok.
PERİNÖRAL İSTİLA: Yok.
PROKSİMAL MİDE SINIRI: İnvaziv karsinomdan etkilenmez.
DİSTAL DUODENAL SINIR: İnvaziv karsinomdan etkilenmez. (açıklık= 0,4 cm).
BÖLGESEL LENF NODLARI: pN0 (Bölgesel lenf nodu metastazı yok): 31 lenf nodu incelendi.
* Lenf nodu toplamı tüm numune parçalarını içerir. Ana örnek (örnek A) 22 lenf nodu içeriyordu.
HER2 İMMÜNOHISTOKIMYA: Her 2 skoru 0/negatif (Tümör hücrelerinin < %10'unda reaktivite yok veya çok hafif membranöz boyama var).
Ek Çalışmalar:
MLH1 ve PMS kaybetti.
MSH2 ve MSH6 sağlam.
Ek bulgular:
Bağırsak metaplazisi ve yüksek dereceli displazi ile gastrik antral mukoza.
Fundik bez polip.
Epstein-Barr virüsü ile kodlanmış RNA (EBER) negatiftir.
Hastamız ameliyat sonrası iyi bir şekilde iyileşti ve ameliyat sonrası 5. günde taburcu edildi. Son patoloji raporunda tümör T1bN0 olarak derecelendirildi ve rezeksiyon sınırları negatifti. Mükemmel bir düğüm hasadı (31 lenf nodu) elde ettik, bu nedenle bu aşama atamasının doğruluğundan emin olabiliriz. Bu nedenle, adjuvan tedaviye ihtiyaç duymaz ve uzun vadeli prognozu mükemmeldir.
Sabit bir karın duvarı ekartör sistemi bu işlem için çok yardımcı olabilir; Bookwalter'ı kullandık, ancak diğer seçenekler arasında Thompson ve Omni ekartör sistemleri yer alıyor. Duodenum ve mide zımbalarla kesilir - bu durumda bir Endo-GIA zımbası. LigaSure cihazı veya Harmonik neşter gibi bir damar mühürleme cihazı, küçük kan damarlarının verimli kontrolünde oldukça yardımcıdır. Sol gastrik arter gibi daha büyük damarlar vasküler bir zımba ile bölünebilir veya geleneksel sütür ligasyonu ile kontrol edilebilir.
Yazarların ifşa edecek herhangi bir çatışması yoktur.
Bu video makalesinde atıfta bulunulan hasta, filme alınması için bilgilendirilmiş onayını vermiştir ve kişisel sağlık bilgilerinin tanımlanamayan bir şekilde çevrimiçi olarak yayınlanacağının farkındadır.
References
- Kanser Genom Atlası Araştırma Ağı. Gastrik adenokarsinomun kapsamlı moleküler karakterizasyonu. Doğa. 2014; 513(7517):202-209. doi:10.1038/doğa13480.
- Mullen JT. Mide kanseri. İçinde: Fischer J, ed. Cerrahi Ustalığı. 7. baskı. Philadelphia, PA: Lippincott Williams & Wilkins; 2017.
- Yoon SS, Park DJ'i. Gastrik adenokarsinom. İçinde: Cameron JL, Cameron, Eds. Güncel Cerrahi Tedavi. 11. baskı. Philadelphia, PA: Saunders, 2014: 87-95.
- Yun M. 18 F-FDG PET/CT kullanılarak mide kanseri metabolizmasının görüntülenmesi. J Mide Kanseri. 2014; 14(1):1-6. doi:10.5230/jgc.2014.14.1.1.
- Ikoma N, Blum M, Chiang YJ, et al. Mide kanserinin radyolojik olarak gizli peritoneal karsinomatozu için evreleme laparoskopisi ve lavaj sitolojisinin verimi. Ann Cerrahi Oncol. 2016; 23(13):4332-4337. doi:10.1245/s10434-016-5409-7.
- Macdonald JS, Smalley SR, Benedetti J ve diğerleri. Mide veya gastroözofageal bileşke adenokarsinomu için tek başına cerrahi ile karşılaştırıldığında ameliyat sonrası kemoradyoterapi. N Engl J Med. 2001; 345(10):725-730. doi:10.1056/NEJMoa010187.
- Cunningham D, Allum WH, Stenning SP ve diğerleri. Rezektabl gastroözofageal kanser için tek başına cerrahiye karşı perioperatif kemoterapi. N Engl J Med. 2006; 355(1):11-20. doi:10.1056/NEJMoa055531.
- Bozzetti F, Marubini E, Bonfanti G, Miceli R, Piyano C, Gennari L; İtalyan Gastrointestinal Tümör Çalışma Grubu. Mide kanseri için subtotal ve total gastrektomi: çok merkezli randomize bir İtalyan çalışmasında beş yıllık sağkalım oranları. Ann Cerrahi. 1999; 230(2):170-178. doi:10.1097/00000658-199908000-00006.
- Bonenkamp JJ, Hermans J, Sasako M, et al; Hollandalı Mide Kanseri Grubu. Mide kanseri için genişletilmiş lenf nodu diseksiyonu. N Engl J Med. 1999; 340(12):908-914. doi:10.1056/NEJM199903253401202.
- Maruyama K, Okabayashi K, Kinoshita T. Japonya'da mide cerrahisinde ilerleme ve radikallik sınırları. Dünya J Cerrahi. 1987; 11(4):418-425. doi:10.1007/BF01655804.
- Sasako M, McCulloch P, Kinoshita T, Maruyama K. Mide kanseri için lenf nodu diseksiyonunun terapötik değerini değerlendirmek için yeni bir yöntem. Br J Cerrahi. 1995; 82(3):346-351. doi:10.1002/bjs.1800820321.
- Cuschieri A, Weeden S, Fielding J ve diğerleri; Cerrahi Kooperatif Grubu. Mide kanseri için D1 ve D2 rezeksiyonlarından sonra hasta sağkalımı: MRC randomize cerrahi çalışmanın uzun vadeli sonuçları. Br J Kanser. 1999; 79(9-10):1522-1530. doi:10.1038/sj.bjc.6690243..
- Wu CW, Hsiung CA, Lo SS, et al. Mide kanserli hastalar için nodal diseksiyon: randomize bir kontrol çalışması. Neşter Oncol. 2006; 7(4):309-315. doi:10.1016/S1470-2045(06)70623-4.
- Degiuli M, Sasako M, Ponti A; İtalyan Mide Kanseri Çalışma Grubu. İtalyan Mide Kanseri Çalışma Grubu'nda morbidite ve mortalite, mide kanseri için D1 ve D2 rezeksiyonunun randomize klinik çalışması. Br J Cerrahi. 2010; 97(5):643-649. doi:10.1002/bjs.6936.
- Edge SB, Byrd DR, Compton CC, Fritz AG, Greene F, Trotti A, eds. AJCC Kanser Evreleme El Kitabı. 7. baskı. New York, NY: Springer; 2010.
- Smith DD, Schwarz RR, Schwarz RE. Mide kanseri için gastrektomi sonrası toplam lenf nodu sayısının evreleme ve sağkalım üzerindeki etkisi: büyük bir ABD popülasyon veri tabanından elde edilen veriler. J Klinik Oncol. 2005; 23(28):7114-7124. doi:10.1200/JCO.2005.14.621.
Cite this article
Merrill AL, Mullen JT. Açık distal gastrektomi. J Med İçgörü. 2024; 2024(191). doi:10.24296/jomi/191.


.jpg&w=3840&q=75&dpl=dpl_Ca7gcJXjbQN6bK8aruk8U4KsAWv7)
.jpg&w=3840&q=75&dpl=dpl_Ca7gcJXjbQN6bK8aruk8U4KsAWv7)