Gastrectomia Distal Aberta
Main Text
Table of Contents
Uma ressecção completa com margem negativa (R0) continua sendo o único tratamento potencialmente curativo para o adenocarcinoma gástrico. A escolha da operação depende da localização do tumor, bem como do estágio da doença. Esse paciente apresentava anemia sintomática, e a investigação demonstrou gastrite e um pequeno tumor no estômago distal. As biópsias confirmaram o adenocarcinoma e uma ultrassonografia endoscópica (EUS) classificou esse tumor como T2 N0. Os exames de estadiamento não mostraram evidências de doença metastática à distância. Dado que este paciente tinha um tumor em estágio relativamente inicial, optamos por prosseguir com a cirurgia inicial, que neste caso envolveu uma gastrectomia distal. Este vídeo mostra a técnica de um cirurgião gástrico experiente para realizar uma gastrectomia distal aberta com uma dissecção de linfonodo D1 "estendida".
Embora a incidência de câncer gástrico nos Estados Unidos tenha diminuído drasticamente nas últimas décadas, o câncer gástrico continua sendo uma importante causa de morte relacionada ao câncer. Apesar das melhorias significativas nas modalidades de estadiamento, terapia cirúrgica e cuidados perioperatórios, o prognóstico da maioria dos pacientes com câncer gástrico permanece ruim. Isso é em grande parte resultado da biologia agressiva desse câncer, bem como do estágio avançado da doença em que a maioria dos pacientes se apresenta ao médico. Os fatores de risco incluem infecção por Helicobacter pylori e vírus Epstein-Barr (EBV), anemia perniciosa, ressecção gástrica prévia, tabagismo e alta ingestão de sal. Aproximadamente 10% dos cânceres gástricos são devidos a síndromes de câncer hereditárias, incluindo câncer gástrico difuso hereditário (HDGC), caracterizado por mutações germinativas no gene E-caderina (CDH1), e síndrome hereditária de câncer colorretal sem polipose (HNPCC), caracterizada por mutações germinativas em genes de reparo de incompatibilidade de DNA. Recentemente, uma avaliação molecular abrangente do câncer gástrico levou a um esquema de classificação que define 4 subtipos genômicos principais e suas frequências aproximadas: tumores infectados por EBV (9%), tumores instáveis microssatélites (MSI-high) (22%), tumores genomicamente estáveis (20%) e tumores cromossomicamente instáveis (50%). 1
Existem poucos, se houver, sintomas clássicos sugestivos de um diagnóstico de câncer de estômago, o que explica por que esse câncer é frequentemente diagnosticado em estágio avançado. Os sintomas iniciais, como dor epigástrica, dispepsia e refluxo ácido, são tão inespecíficos que a maioria dos pacientes é simplesmente tratada empiricamente com antiácidos sem investigação adicional. À medida que a doença progride, os sintomas tornam-se mais proeminentes e mais ameaçadores e incluem queixas como disfagia, náuseas, vômitos, saciedade precoce, anorexia, fadiga e perda de peso. A localização e o tipo histológico do câncer gástrico geralmente ditam o complexo dos sintomas, desde disfagia para tumores proximais até vômitos para tumores distais obstrutivos, saciedade precoce e perda de peso para tumores do tipo difuso (linite plástica). 2,3
Este paciente é um senhor de 84 anos com história de gastrite e estenose crônica da junção gastroesofágica que se apresentou ao seu médico de cuidados primários com sintomas de fadiga e falta de ar. Um hemograma completo foi obtido e mostrou que o paciente estava anêmico. Negava dor abdominal, náuseas, vômitos, alteração dos hábitos intestinais, dificuldade para comer ou perda de peso.
O exame físico de um paciente com câncer gástrico geralmente não apresenta nada digno de nota, talvez com exceção de desconforto abdominal epigástrico e, menos provável, de uma massa epigástrica palpável. Achados físicos clássicos de mesmo nome, como o nódulo de Virchow, o nódulo periumbilical da Irmã Mary Joseph e a prateleira de Blumer, raramente estão presentes, mas quando vistos indicam doença metastática avançada. Da mesma forma, a presença de caquexia, icterícia, ascite e hepatomegalia em um paciente com câncer gástrico geralmente significa doença metastática incurável. Nosso paciente apresentava boa aparência e, ao exame, apresentava abdômen mole e sem massas palpáveis.
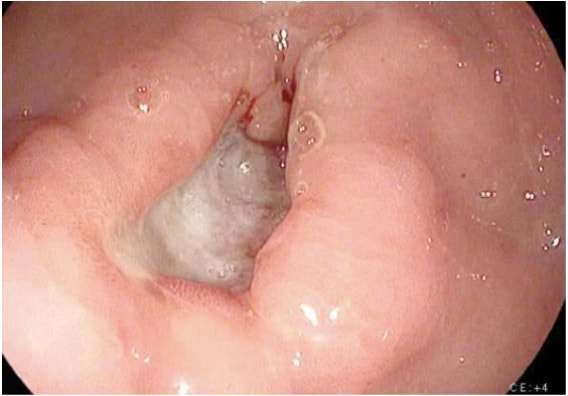
A imagem para investigação do câncer gástrico inclui uma variedade de estudos. O diagnóstico de câncer gástrico geralmente é prontamente estabelecido por endoscopia com biópsia (fig. 1). A endoscopia define a localização e a extensão do tumor dentro do estômago e, quando combinada com a ultrassonografia endoscópica (EUS), permite uma estimativa precisa da profundidade da invasão do tumor (estágio T). A USE é a modalidade mais sensível no estabelecimento do estágio T de um câncer gástrico, e a USE permite uma avaliação dos linfonodos regionais e biópsia por agulha de linfonodos suspeitos para confirmar o envolvimento nodal (estágio N). Uma tomografia computadorizada (TC) do tórax, abdome e pelve deve ser realizada para avaliar a disseminação metastática à distância, como pulmões, fígado, peritônio ou linfonodos fora do campo de ressecção. Além disso, uma tomografia computadorizada é sensível para detectar até mesmo pequenas quantidades de ascite que podem representar a disseminação do tumor peritoneal e que podem ser amostradas por meios guiados por imagem para exame citológico. Embora os exames de PET e PET-CT não sejam rotineiramente recomendados no estadiamento pré-operatório do câncer gástrico, eles certamente podem fornecer informações úteis adicionais. A PET tem baixa sensibilidade na detecção do tumor primário, especialmente em cânceres gástricos precoces e difusos, mas a PET tem uma especificidade maior do que a TC (90% vs. 60%) na detecção de metástases linfonodais regionais e tem uma sensibilidade razoável para a detecção de metástases hepáticas, pulmonares e linfonodais distantes. 4 Além disso, o PET pode ser usado para monitorar a resposta do tumor à quimioterapia neoadjuvante, pois detecta com precisão os respondedores à terapia em um estágio inicial, permitindo assim que o clínico mantenha os pacientes em um regime de quimioterapia o mais ativo possível.
Pacientes com cânceres locorregionalmente avançados (T3+/N+) são considerados para estadiamento adicional por laparoscopia. A laparoscopia de estadiamento pode ser realizada imediatamente antes da laparotomia planejada ou como um procedimento de pré-tratamento realizado em pacientes que consideram a terapia pré-operatória. A laparoscopia de estadiamento supera mais de 30% dos pacientes por meio da identificação de metástases peritoneais e hepáticas radiograficamente ocultas e citologia positiva. 5
O câncer gástrico geralmente se espalha pelos gânglios linfáticos ou hematogenamente e comumente metastatiza para o fígado, pulmões ou peritônio. Também pode se espalhar diretamente para envolver órgãos adjacentes, como o pâncreas e o cólon transverso. A única terapia curativa potencial para o câncer gástrico é a cirurgia. Mesmo com ressecção completa com margem negativa e terapia (neo)adjuvante, a taxa de sobrevida em 5 anos permanece baixa em ~40%.
O paradigma de tratamento mais comum para o câncer gástrico nos Estados Unidos tem sido historicamente a cirurgia inicial, seguida por quimiorradioterapia adjuvante (conforme descrito no estudo Intergroup 0116) para aqueles pacientes com tumores de alto risco (T3/4, linfonodo positivo, tipo pouco coesivo). 6 No entanto, apenas 64% dos pacientes neste estudo puderam receber a quimiorradioterapia pós-operatória conforme planejado, e muitos favorecem a quimioterapia perioperatória para esses pacientes, conforme descrito no estudo MAGIC conduzido pelo British Medical Research Council. Neste estudo, os pacientes foram randomizados para receber quimioterapia perioperatória (três ciclos de epirrubicina, cisplatina e 5-fluorouracil (ECF) no pré e pós-operatório) e cirurgia ou cirurgia isolada. As taxas de sobrevida em cinco anos foram superiores no grupo de quimioterapia perioperatória em comparação com o grupo de cirurgia isolada (36% vs. 23%). 7 Embora apenas ~ 40% dos pacientes completem toda a terapia recomendada com esta abordagem de tratamento, mais de 85% dos pacientes recebem todos os 3 ciclos planejados de quimioterapia pré-operatória e todos os pacientes recebem pelo menos um ciclo de quimioterapia. A administração de pelo menos alguns ciclos de terapia sistêmica antes da cirurgia para pacientes com tumores de alto risco confere várias vantagens: (1) permite o tratamento precoce de possível doença micrometastática; (2) pode-se monitorar a resposta do tumor in vivo à terapia, como com imagens de PET-CT; e (3) pode-se selecionar para aqueles pacientes com biologia tumoral particularmente ruim que desenvolvem doença metastática precoce e que, portanto, não obteriam nenhum benefício de sobrevida da gastrectomia. 7
Uma ressecção completa com margem negativa (R0) continua sendo o único tratamento potencialmente curativo para o adenocarcinoma gástrico. A escolha da operação depende da localização do tumor, bem como do estágio da doença. Os cânceres gástricos superficialmente invasivos (T1a) de grau histológico favorável podem ser tratados por ressecção endoscópica da mucosa ou excisão em cunha com ou sem biópsia concomitante do linfonodo sentinela. Tais procedimentos têm sido amplamente descritos por nossos colegas cirúrgicos do Japão, onde os cânceres gástricos são frequentemente diagnosticados em estágio inicial, dada a prevalência de exames endoscópicos de rastreamento naquele país. Como a maioria dos pacientes nos Estados Unidos apresenta tumores sintomáticos e locorregionalmente avançados, a principal questão cirúrgica é qual procedimento oferece a maior chance de cura com morbidade e mortalidade aceitáveis. Muitos pacientes não são candidatos a nenhum procedimento cirúrgico, seja porque são clinicamente inaptos ou devido à presença de doença metastática observada em estudos de imagem pré-operatórios ou no momento da laparoscopia. Para os pacientes candidatos à ressecção gástrica, as opções incluem gastrectomia total, proximal e distal. Há uma experiência mundial crescente na realização desses procedimentos por laparoscopia, com melhores resultados de curto prazo e rendimentos nodais e resultados de sobrevida que estão no mesmo nível dos procedimentos abertos tradicionais. No entanto, a grande maioria das ressecções para câncer gástrico nos Estados Unidos ainda é realizada por via aberta.
Os pacientes que devem ser considerados para ressecção cirúrgica imediata incluem aqueles com câncer gástrico em estágio inicial (T1/T2 N0) e aqueles que necessitam de paliação imediata de sangramento ou obstrução luminal associada a tumor de alto grau. No entanto, as taxas de morbidade e mortalidade perioperatórias nesta última população de pacientes são significativas e devem ser cuidadosamente ponderadas em relação aos prováveis benefícios da ressecção. Pacientes com câncer gástrico locorregionalmente avançado são bons candidatos para quimioterapia pré-operatória ou quimiorradioterapia.
Como esse paciente tinha um tumor em estágio relativamente inicial (uT2N0) e estava com uma saúde notavelmente boa para sua idade, ele recebeu uma cirurgia inicial com uma gastrectomia distal. Sentimos que uma gastrectomia distal aberta limitava o risco de tratamento excessivo com quimioterapia neoadjuvante para um câncer potencialmente de baixo risco, enquanto nos deixava a opção de oferecer a ele terapia adjuvante se o relatório final da patologia revelasse um câncer mais avançado (por exemplo, T3+/N+).
A extensão da ressecção gástrica é determinada pela localização e extensão do tumor primário. Ensaios prospectivos randomizados não conseguiram demonstrar uma vantagem de sobrevida para a gastrectomia total em relação à gastrectomia distal e subtotal para pacientes com tumores do estômago distal. 8 Portanto, para aqueles pacientes nos quais uma margem de 5 a 6 cm do tumor pode ser obtida mantendo um remanescente gástrico de tamanho razoável, uma ressecção gástrica mais conservadora deve ser realizada, pois isso confere uma taxa de sobrevida equivalente com menor morbidade e melhor qualidade de vida do que uma gastrectomia total. 8 No entanto, uma gastrectomia total deve ser realizada se necessário para obter uma ressecção R0, pois margens de ressecção positivas (ressecções R1) levam a uma sobrevida muito baixa. No ensaio clínico holandês de câncer gástrico, 10% dos pacientes tiveram uma margem de ressecção positiva e uma sobrevida de 3 anos correspondentemente inferior (18% vs. 63%) em comparação com aqueles que tiveram uma margem de ressecção negativa. 9 No entanto, as margens microscopicamente envolvidas parecem afetar a sobrevida a longo prazo apenas naqueles pacientes com cinco ou menos metástases linfonodais. Para cânceres gástricos proximais, muitos cirurgiões preferem uma gastrectomia total a uma gastrectomia proximal devido às sequelas a longo prazo do refluxo ácido sintomático com o último procedimento.
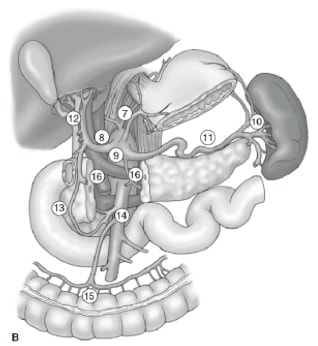
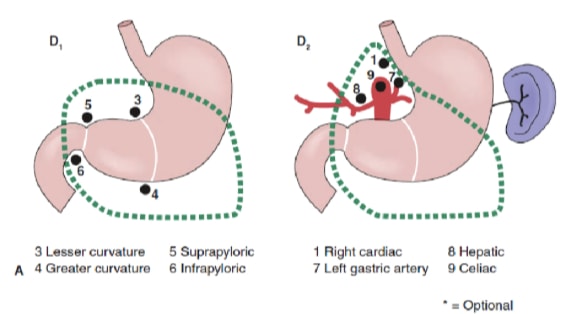
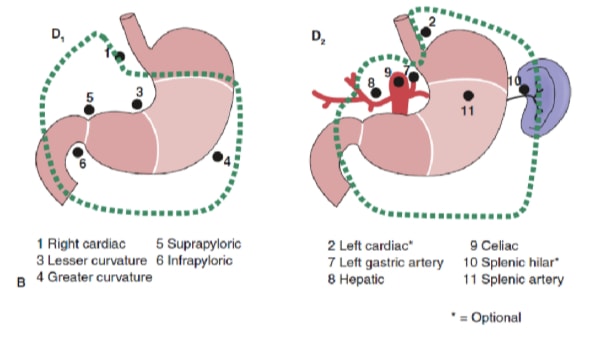
A extensão da dissecção linfonodal é uma das questões mais controversas no tratamento do câncer gástrico. Relatórios do Registro de Câncer Gástrico e outros estudos retrospectivos tornaram a gastrectomia radical com linfadenectomia estendida (D2) o padrão de tratamento para o tratamento do câncer gástrico curável no Japão. 10,11 A Sociedade Japonesa de Pesquisa para o Câncer Gástrico categoriza as bacias linfonodais de drenagem do estômago em 16 estações, incluindo 6 estações perigástricas (Figura 2a) e 10 estações regionais ao longo dos vasos principais e adjacentes ao pâncreas (Figura 2b). A extensão da dissecção dos linfonodos é indicada pela designação D. Uma dissecção D1 inclui apenas os linfonodos perigástricos (estações 1 a 6); uma dissecção D2 inclui os linfonodos ao longo das artérias hepática comum, gástrica esquerda, celíaca e esplênica (estações 7 a 11); e uma dissecção D3 inclui linfonodos adicionais dentro da porta hepatis e adjacentes à aorta (estações 12 a 16) (Figura 3).
Dois grandes ensaios clínicos prospectivos randomizados comparando os resultados da dissecção D1 com os da dissecção D2 foram conduzidos em pacientes ocidentais. O acompanhamento de quinze anos do maior desses dois estudos, a saber, o Dutch Gastric Cancer Group Trial, não demonstrou nenhum benefício de sobrevida global a longo prazo com a dissecção de linfonodos D2 (29%% vs 21%, P = 0,34), mas mostrou uma taxa de mortalidade relacionada ao câncer gástrico significativamente diminuída (37% vs 48%, P = 0,01) e uma taxa de recorrência locorregional mais baixa do que a cirurgia D1. 9 No entanto, houve taxas significativamente maiores de morbidade pós-operatória (43% vs 25%) e mortalidade (10% vs 4%) nos pacientes submetidos à linfadenectomia D2 mais extensa, em grande parte resultante do maior número de esplenectomias e pancreatectomias realizadas nesse grupo para obter uma dissecção completa do linfonodo. 9 Da mesma forma, o estudo British Cooperative conduzido pelo Medical Research Council relatou um aumento da morbidade, associado a altas taxas de esplenectomia e pancreatectomia concomitantes, sem benefício na sobrevida global ou livre de recorrência nos pacientes randomizados para uma dissecção D2. 12
Apesar dos resultados desses dois estudos, os pesquisadores argumentaram que, se a taxa de complicações após uma dissecção estendida de linfonodos D2 pudesse ser diminuída, o benefício de sobrevida conferido por uma dissecção D2, conforme relatado por centros experientes na Ásia, poderia ser traduzido para pacientes ocidentais com câncer gástrico. 13 Assim, o Grupo Italiano de Estudo do Câncer Gástrico conduziu um estudo de fase III randomizando pacientes para uma linfadenectomia D2 com preservação do pâncreas ou uma linfadenectomia D1 em centros de alto volume por cirurgiões que concluíram um treinamento rigoroso na técnica por meio da observação de cirurgiões mestres no Japão. Eles relataram taxas de morbidade (17,9%) e mortalidade (3,0%) impressionantemente baixas em pacientes submetidos à dissecção D2, nos quais uma pancreatectomia ou esplenectomia foi realizada apenas para invasão direta do tumor. 14 No entanto, eles não encontraram diferença na sobrevida global de 5 anos entre os grupos D1 e D2 (66,5% vs 64,2%; P = 0,695), embora as análises de subgrupos tenham sugerido que uma linfadenectomia D2 pode ser benéfica para pacientes com tumores T2-T4 e/ou positivos para linfonodos. 14
Ainda não está claro se uma dissecção de linfonodos D2 é simplesmente um procedimento de estadiamento completo ou se pode haver um benefício terapêutico para certos subconjuntos de pacientes (p. ex., pacientes com doença N2). Deve-se notar que o estadiamento preciso de pacientes com câncer gástrico, de acordo com a sétima edição mais recente do American Joint Committee on Cancer (AJCC) Staging Manual, exige a avaliação de pelo menos 15 linfonodos. 15 O estadiamento nodal é então baseado no número de nós positivos com as categorias N1 (1 a 2 nós positivos), N2 (3 a 6 nós positivos), N3a (7 a 15 nós positivos) e N3b (16+ nós positivos). Estudos mostraram uma correlação entre a melhora da sobrevida do paciente e o maior número de linfonodos examinados na amostra. 16 Claro, isso pode simplesmente refletir um estadiamento mais preciso em oposição a um benefício terapêutico do procedimento. No entanto, há evidências indiretas de que linfadenectomias mais extensas resultam em taxas mais baixas de recorrência locorregional, e isso pode se traduzir em um benefício de sobrevida. De fato, um estudo randomizado conduzido em um único centro em Taiwan identificou uma vantagem de sobrevida global de 5 anos para os pacientes submetidos a uma dissecção D3 (59.5%) em comparação com aqueles submetidos a uma dissecção D1 (53.6%). 13
Para pacientes tratados no MGH na última década, relatamos taxas de morbidade e mortalidade após gastrectomia e linfadenectomia D2 de 17% e 0%, respectivamente, e nosso rendimento médio de linfonodos com dissecção ex vivo da amostra aumentou para 40 linfonodos. O tempo médio de internação para gastrectomia subtotal e total nos Estados Unidos é em média de 9 a 10 dias, embora muitos pacientes recebam alta em 7 dias. As complicações em longo prazo da gastrectomia subtotal e total incluem deficiências de vitaminas e minerais, particularmente de vitamina B12, vitamina D, ferro e cálcio, e as síndromes clássicas pós-gastrectomia, como gastrite de refluxo alcalino, síndrome de dumping, síndrome de estase de Roux e síndrome do membro aferente.
A cirurgia é a única terapia potencialmente curativa para o câncer gástrico localizado, mas mesmo para os pacientes nos quais uma ressecção R0 é possível, apenas 35% a 40% de sobrevida em 5 anos é alcançada com quimioterapia perioperatória ou quimiorradioterapia pós-operatória. O progresso futuro no tratamento do câncer gástrico depende do desenvolvimento de melhores terapias sistêmicas, bem como técnicas para diagnóstico precoce.
A. RESSECÇÃO DO ESTÔMAGO DISTAL:
Adenocarcinoma gástrico, tipo tubular, expressão de proteína de reparo de incompatibilidade instável. (Veja o relatório sinótico).
B. BIÓPSIA DE LINFONODO, ESTAÇÃO 8:
Não há evidência de malignidade em quatro linfonodos (0/4).
C. BIÓPSIA DE LINFONODO, ESTAÇÃO 11:
Não há evidência de malignidade em dois linfonodos (0/2).
D. BIÓPSIA DE LINFONODO, ESTAÇÃO 7:
Não há evidência de malignidade em dois linfonodos (0/2).
E. BIÓPSIA DE LINFONODO, ESTAÇÃO 3:
Não há evidência de malignidade em um linfonodo (0/1).
RELATÓRIO SINÓTICO:
RESUMO DO ESTÁGIO TUMORAL: pT1bN0.
SÍTIO ESPECÍFICO: Antro gástrico.
TAMANHO DO TUMOR (maior dimensão): 0,3 cm (medido na lâmina).
CLASSIFICAÇÃO DA OMS: Adenocarcinoma tubular.
GRAU HISTOLÓGICO: G1 (Bem diferenciado)
EXTENSÃO DA INVASÃO: pT1b (O tumor invade a submucosa).
INVASÃO DE PEQUENOS VASOS (SANGUE/LINFÁTICO): Ausente.
INVASÃO DE GRANDES VASOS (VENOSOS): Ausente.
INVASÃO PERINEURAL: Ausente.
MARGEM GÁSTRICA PROXIMAL: Não envolvida por carcinoma invasivo.
MARGEM DUODENAL DISTAL: Não envolvido por carcinoma invasivo. (folga = 0,4 cm).
LINFONODOS REGIONAIS: pN0 (sem metástase linfonodal regional): 31 linfonodos examinados.
*O total de linfonodos inclui todas as partes da amostra. O espécime principal (espécime A) continha 22 linfonodos.
IMUNO-HISTOQUÍMICA HER2: Sua pontuação 2 0/negativa (sem reatividade ou coloração membranosa muito fraca em < 10% das células tumorais).
Estudos adicionais:
MLH1 e PMS perdidos.
MSH2 e MSH6 intactos.
Descobertas adicionais:
Mucosa antral gástrica com metaplasia intestinal e displasia de alto grau.
Pólipo da glândula fúndica.
O RNA codificado pelo vírus Epstein-Barr (EBER) é negativo.
Nosso paciente evoluiu bem da cirurgia e recebeu alta no 5º dia de pós-operatório. Seu relatório final de patologia classificou seu tumor como T1bN0, e as margens de ressecção foram negativas. Alcançamos uma excelente colheita nodal (31 linfonodos), por isso podemos confiar na precisão dessa atribuição de estágio. Como tal, ele não requer terapia adjuvante e seu prognóstico a longo prazo é excelente.
Um sistema afastador de parede abdominal fixo pode ser muito útil para esta operação; usamos o Bookwalter, mas outras opções incluem os sistemas retratores Thompson e Omni. O duodeno e o estômago são seccionados com grampeadores - neste caso, um grampeador Endo-GIA. Um dispositivo de vedação de vasos, como um dispositivo LigaSure ou bisturi harmônico, é bastante útil no controle eficiente de pequenos vasos sanguíneos. Vasos maiores, como a artéria gástrica esquerda, podem ser divididos com um grampeador vascular ou controlados por ligadura de sutura tradicional.
Os autores não têm conflitos a divulgar.
O paciente referido neste artigo de vídeo deu seu consentimento informado para ser filmado e está ciente de que suas informações pessoais de saúde serão publicadas online de forma não identificada.
References
- Rede de Pesquisa do Atlas do Genoma do Câncer. Caracterização molecular abrangente do adenocarcinoma gástrico. Natureza. 2014; 513(7517):202-209. DOI:10.1038/nature13480.
- Câncer gástrico. In: Fischer J, ed. Domínio da Cirurgia. 7ª ed. Filadélfia, PA: Lippincott Williams & Wilkins; 2017.
- Yoon SS, DJ do parque. Adenocarcinoma gástrico. In: Cameron JL, Cameron AM, eds. Terapia Cirúrgica Atual. 11ª ed. Filadélfia, PA: Saunders, 2014: 87-95.
- Yun M. Imagem do metabolismo do câncer gástrico usando 18 F-FDG PET / CT. J Câncer Gástrico. 2014; 14(1):1-6. DOI:10.5230/jgc.2014.14.1.1.
- Ikoma N, Blum M, Chiang YJ, et al. Rendimento da laparoscopia de estadiamento e citologia de lavagem para carcinomatose peritoneal radiologicamente oculta do câncer gástrico. Ann Surg Oncol. 2016; 23(13):4332-4337. DOI:10.1245/S10434-016-5409-7.
- Macdonald JS, Smalley SR, Benedetti J, et al. Quimiorradioterapia após a cirurgia em comparação com cirurgia isolada para adenocarcinoma do estômago ou junção gastroesofágica. N Engl J Med. 2001; 345(10):725-730. DOI:10.1056/NEJMoa010187.
- Cunningham D, Allum WH, Stenning SP, et al. Quimioterapia perioperatória versus cirurgia isolada para câncer gastroesofágico ressecável. N Engl J Med. 2006; 355(1):11-20. DOI:10.1056/NEJMoa055531.
- Bozzetti F, Marubini E, Bonfanti G, Miceli R, Piano C, Gennari L; Grupo Italiano de Estudo de Tumores Gastrointestinais. Gastrectomia subtotal versus total para câncer gástrico: taxas de sobrevida em cinco anos em um estudo italiano randomizado multicêntrico. Ann Surg. 1999; 230(2):170-178. DOI:10.1097/00000658-199908000-00006.
- Bonenkamp JJ, Hermans J, Sasako M, et al; Grupo Holandês de Câncer Gástrico. Dissecção estendida de linfonodos para câncer gástrico. N Engl J Med. 1999; 340(12):908-914. DOI:10.1056/NEJM199903253401202.
- Maruyama K, Okabayashi K, Kinoshita T. Progresso na cirurgia gástrica no Japão e seus limites de radicalidade. Mundo J Surg. 1987; 11(4):418-425. DOI:10.1007/BF01655804.
- Sasako M, McCulloch P, Kinoshita T, Maruyama K. Novo método para avaliar o valor terapêutico da dissecção linfonodal para câncer gástrico. Br J Surg. 1995; 82(3):346-351. DOI:10.1002/bjs.1800820321.
- Cuschieri A, Weeden S, Fielding J, et al; Grupo Cooperativo Cirúrgico. Sobrevida do paciente após ressecções D1 e D2 para câncer gástrico: resultados a longo prazo do ensaio cirúrgico randomizado MRC. Br J Câncer. 1999; 79(9-10):1522-1530. DOI:10.1038/sj.bjc.6690243..
- Wu CW, Hsiung CA, Lo SS, et al. Dissecção nodal para pacientes com câncer gástrico: um estudo de controle randomizado. Lanceta Oncol. 2006; 7(4):309-315. DOI:10.1016/S1470-2045(06)70623-4.
- Degiuli M, Sasako M, Ponti A; Grupo Italiano de Estudos do Câncer Gástrico. Morbidade e mortalidade no ensaio clínico randomizado do Grupo Italiano de Estudo do Câncer Gástrico de ressecção D1 versus D2 para câncer gástrico. Br J Surg. 2010; 97(5):643-649. DOI:10.1002/bjs.6936.
- Edge SB, Byrd DR, Compton CC, Fritz AG, Greene F, Trotti A, eds. Manual de Estadiamento do Câncer AJCC. 7ª ed. Nova York, NY: Springer; 2010.
- Smith DD, Schwarz RR, Schwarz RE. Impacto da contagem total de linfonodos no estadiamento e sobrevida após gastrectomia para câncer gástrico: dados de um grande banco de dados da população dos EUA. J Clin Oncol. 2005; 23(28):7114-7124. DOI:10.1200/JCO.2005.14.621.
Cite this article
Merrill AL, Mullen JT. Gastrectomia distal aberta. J Med Insight. 2024; 2024(191). DOI:10.24296/jomi/191.


.jpg&w=3840&q=75&dpl=dpl_Ca7gcJXjbQN6bK8aruk8U4KsAWv7)
.jpg&w=3840&q=75&dpl=dpl_Ca7gcJXjbQN6bK8aruk8U4KsAWv7)