開放遠位胃切除術
Main Text
Table of Contents
完全マージン陰性(R0)切除術は、胃腺癌の唯一の治癒可能な治療法として残っています。手術の選択は腫瘍の位置や病変の進行期によって異なります。この患者は症状性貧血を訴え、検査では胃炎と遠位胃に小さな腫瘍が認められました。生検により腺癌が確認され、内視鏡超音波(EUS)でこの腫瘍はT2 N0と診断されました。病期検査では遠隔転移の兆候は見つかりませんでした。この患者は比較的早期の腫瘍だったため、前期手術を選択し、今回は遠位胃切除術を含みました。このビデオは、経験豊富な胃外科医による開腹末位胃切除術と「拡張」D1リンパ節郭清を行う技術を示しています。
アメリカ合衆国における胃がんの発生率は過去数十年で劇的に減少しましたが、胃がんは依然としてがん関連死の重要な原因となっています。病期調整、外科的治療、周術期ケアにおいて大きな改善があったにもかかわらず、胃がん患者の多くは依然として悪いままです。これは主に、このがんの攻撃的な生物学的特徴と、多くの患者が臨床医に受診する進行期の病気によるものです。リスク要因には 、ヘリコバクター・ピロリ およびエプスタイン・バーウイルス(EBV)感染、悪性貧血、過去の胃切除、喫煙、高塩分摂取が含まれます。胃がんの約10%は遺伝性がん症候群に起因しており、その中にはE-カデリン(CDH1)遺伝子の生殖細胞変異を特徴とする遺伝性びまま性胃がん(HDGC)や、DNAミスマッチ修復遺伝子の生殖細胞変異を特徴とする遺伝性非ポリポーシス大腸がん(HNPCC)症候群が含まれます。最近、胃がんの包括的な分子評価により、EBV感染腫瘍(9%)、マイクロサテライト不安定(MSI-high)腫瘍(22%)、ゲノム安定腫瘍(20%)、染色体不安定腫瘍(50%)の4つの主要なゲノムサブタイプとその発生頻度を定義する分類体系が確立されました。1
胃がんの診断を示す典型的な症状はほとんど、あるいは全くなく、そのためこのがんは進行期に診断されることが多いのです。胃窩痛、消化不良、逆流性食道炎などの初期症状は非常に非特異的であるため、多くの患者はさらなる検査なしに単に制酸剤で経験的に治療されています。病気が進行するにつれて、症状はより顕著で不吉になり、嚥下障害、吐き気、嘔吐、早期満腹感、拒食症、疲労、体重減少などの訴えが含まれます。胃がんの位置や組織学的タイプは症状の複合体を左右することが多い。近位腫瘍の嚥下障害から、遠位閉塞性腫瘍の嘔吐、びまん性(リンニティス・プラスカ)腫瘍の早期満腹感と体重減少まで。2,3
この患者は84歳の男性で、胃炎の既往歴と慢性的な胃食道接合部の狭窄があり、疲労感と息切れの症状でかかりつけ医に受診しました。全血球検査の結果、患者は貧血であることが判明しました。腹痛、吐き気、嘔吐、排便習慣の変化、食事困難、体重減少を否定しました。
胃がん患者の身体検査は通常、上腹部圧痛や、より稀に感じられる胃上部腫瘤を除いて特に異常はありません。ヴィルショウの結節、シスター・メアリー・ジョセフの周縁結節、ブルーマーの棚のような古典的な身体的所見はまれに見られますが、見たときには進行した転移性疾患を示しています。同様に、胃がん患者に悪液質、黄疸、腹水、肝腫大が見られることは、通常、治療不可能な転移性疾患を示します。患者さんは良好な様子で、検査では腹部が柔らかく、触診できる腫瘤はありませんでした。
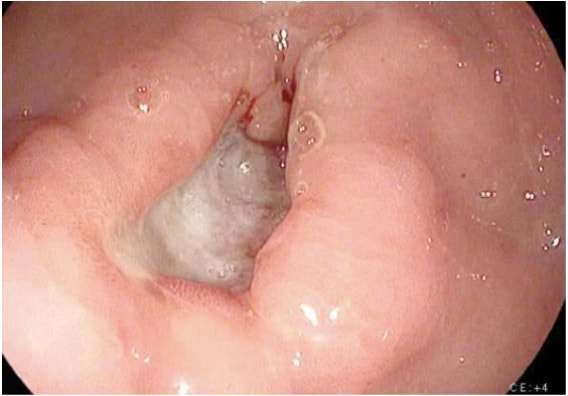
胃がんの検査のための画像検査にはさまざまな研究が含まれます。胃がんの診断は通常、生検を伴う内視鏡検査によって容易に確定します(図1)。内視鏡検査は胃内の腫瘍の位置と範囲を特定し、内視鏡超音波(EUS)と組み合わせることで腫瘍浸潤の深さ(T段階)を正確に推定できます。EUSは胃がんのTステージを決定する際に最も感度の高いモダリティであり、EUSは地域リンパ節の評価や疑わしいリンパ節の針生検によるリンパ節の関与確認(Nステージ)を可能にします。胸部、腹部、骨盤のCTスキャンを行い、切除視野外の肺、肝臓、腹膜、リンパ節など遠方転移の有無を評価する必要があります。さらに、CTスキャンは腹膜腫瘍の転移を示す可能性のある少量の腹水でも検出でき、画像誘導による細胞学的検査のために採取可能です。PETやPET–CTスキャンは胃がんの術前病期診断には通常推奨されませんが、追加で有益な情報を提供する可能性があります。PETは特に早期およびびまん性胃がんにおいて原発腫瘍の検出感度が低いですが、局所リンパ節転移の検出においてCTよりも特異性が高く(90%対60%)、肝臓、肺、遠隔リンパ節の転移にも適度な感度を持っています。4 さらに、PETは早期段階で治療反応者を正確に検出するため、腫瘍応答のモニタリングにも用いられます。これにより、臨床医は患者を可能な限り活発な化学療法のレジメンに維持できます。
局所進行がん(T3+/N+)の患者は腹腔鏡検査による追加病期評価が検討されます。期期腹腔鏡検査は、計画された開腹手術直前または術前治療を検討している患者に対して事前処置として行うことができます。腹腔鏡のステージングは、放射線検査による潜伏性腹膜および肝臓転移の特定と陽性細胞学的特徴により、30%以上の患者を上回ります。5
胃がんは通常リンパ節や血液性転移で、肝臓、肺、腹膜に転移することが多いです。また、膵臓や横結腸など隣接する臓器に直接広がることもあります。胃がんに対する唯一の治癒可能な治療法は手術です。完全なマージン陰性切除術と(新)補助療法を行っても、5年生存率は~40%と低めのままです。
アメリカ合衆国における胃がんの最も一般的な治療パラダイムは、歴史的に初期手術であり、その後、高リスク(T3/4、リンパ節陽性、凝集性の低いタイプ)腫瘍患者に対して、Intergroup 0116試験で記述されたように補助化学放射線療法が行われてきました。6 しかし、この試験に参加した患者の64%のみが計画通り術後化学放射線療法を受けることができ、そのため多くの患者は英国医学研究評議会が実施したMAGIC試験で説明されたように、術前期化学療法を推奨しています。本試験では、患者は術前・術後でエピルビシン、シスプラチン、5-フルオウラシル(ECF)を3サイクルずつ投与)および手術または単独手術のいずれかを受けるかに無作為に割り当てられました。5年間生存率は、周術期化学療法群で手術単独群を上回り(36%対23%)優れていました。7 この治療法で推奨されるすべての治療を完了する患者はわずか40%ですが、85%以上の患者は術前化学療法の計画された3サイクルすべてを受け、 すべての 患者は少なくとも1サイクルの化学療法を受けています。高リスク腫瘍患者に対して、手術前に少なくとも数サイクルの全身療法を実施することで、いくつかの利点があります:(1) 微小転移性疾患の早期治療を可能にすること;(2) PET–CT画像検査などで治療に対する 生体内 腫瘍反応を監視できること;(3) 特に腫瘍生物学が悪く早期転移性疾患を発症し、胃切除術による生存利益が得られない患者を選択できる。7
完全マージン陰性(R0)切除術は、胃腺癌の唯一の治癒可能な治療法として残っています。手術の選択は腫瘍の位置や病変の進行期によって異なります。表面浸潤性(T1a)胃がんで組織学的に良好なグレードは、内視鏡下粘膜切除術または楔形切除術で治療可能です。伴うセンチネルリンパ節生検の有無にかかわらず。このような手術は、日本の外科同僚によって広く説明されており、胃がんは内視鏡検査の普及により早期に診断されることが多いです。アメリカでは、患者の大多数が症状を伴う局所進行腫瘍を抱えているため、主な外科的課題は、どの手術が許容される罹患率と死亡率で治癒の可能性が最も高いかということです。多くの患者は、医学的に不適格な場合や、術前画像検査や腹腔鏡検査時に転移性疾患が確認されているため、手術を受ける資格がありません。胃切除の候補者には、全胃切除術、近位胃切除術、遠位胃切除術の選択肢があります。これらの手術を腹腔鏡下で行う経験が世界的に増加しており、短期的な予帰やリンパ節収量の向上、生存率は従来の開放手術と同等の水準となっています。しかし、アメリカ合衆国における胃がんの切除の大多数は依然としてオープンアプローチで行われています。
即時の外科的切除を検討すべき患者には、初期段階(T1/T2 N0)の胃がん患者や、出血や高度腫瘍関連の管腔閉塞の即時緩和が必要な患者が含まれます。しかし、この後者の患者集団における周術期の罹患率および死亡率は有意であり、切除の見込み利益と慎重に比較検討する必要があります。局所進行の胃がん患者は術前化学療法や化学放射線療法の適した候補者です。
この患者は比較的早期の腫瘍(uT2N0)で、年齢の割に非常に健康であったため、前期手術と遠位胃切除術が提案されました。開口末位胃切除術は、潜在的に低リスクのがんに対するネオアジュバント化学療法の過剰治療リスクを抑えつつ、最終病理報告でより進行した(例:T3+/N+)がんが判明した場合はアジュバント療法を提供する選択肢を残すと考えました。
胃切除の範囲は原発腫瘍の位置と範囲によって決まります。前向きのランダム化試験では、遠位胃腫瘍患者において全胃切除術が遠位・亜全胃切除術よりも生存率優位性を示すことは認められませんでした。したがって 、腫瘍から5〜6cmのマージンを確保しつつ、適度な大きさの胃残存物を維持できる患者には、より保守的な胃切除を行うべきであり、これにより全胃切除術よりも同等の生存率、低罹患率、より良い生活の質が得られます。8 それでも、R0切除を達成するためには全胃切除術を行うべきであり、陽性切除マージン(R1切除)は非常に生存率が低いためです。オランダの胃がん試験では、10%の患者が陽性切除マージンを持ち、陰性切除マージンの患者と比べて3年生存率が18%対63%で劣っていました。しかし 、顕微鏡的に関与する縁辺は、リンパ節転移が5つ以下である患者にのみ長期生存に影響を与えるようです。近位胃がんの場合、多くの外科医は近位胃切除術よりも全胃切除術を好みます。これは後者の手術で症状を伴う酸逆流の長期的な後遺症があるためです。
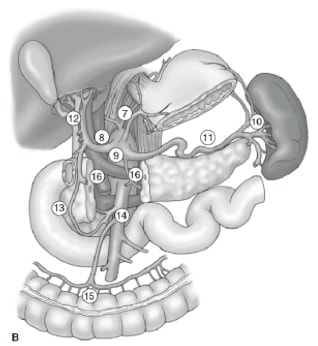
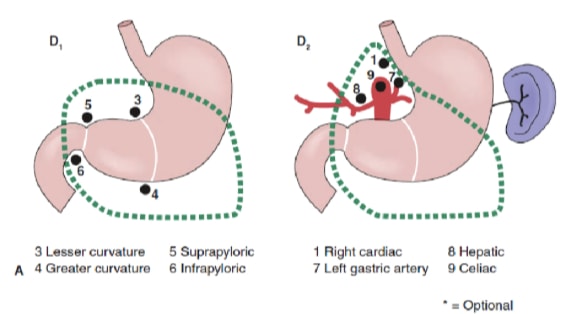
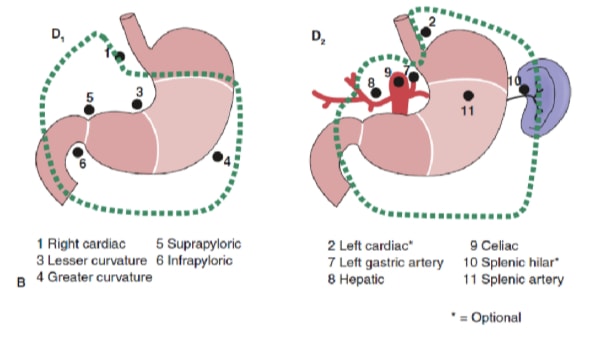
リンパ節郭清の範囲は、胃がんの管理において最も議論の多い問題の一つです。胃がん登録制度やその他の回顧的研究の報告により、日本における治癒可能な胃がん治療の標準治療として、根治的胃切除術と拡張(D2)リンパ節摘出術が標準治療となっている。10,11 日本胃がん研究会は、胃の排水リンパ節盆地を16のステーションに分類しており、そのうち6つは腹周部のステーション(図2a)と、主要血管沿いおよび膵臓に隣接する10の地域ステーション(図2b)です。リンパ節郭清の範囲はDの指定で示されます。D1解離は腹周結節(ステーション1から6)のみを含みます。D2解離には、総肝、左胃、セリアック、脾臓の各リンパ節(ステーション7から11)に沿ったリンパ節が含まれます。D3剥離には肝門内および大動脈に隣接する追加の結節(ステーション12から16)が含まれます(図3)。
西洋患者を対象に、D1解離とD2解離の結果を比較した2つの大規模前向き無作為化試験が実施されています。これら2つの大研究のうち、オランダ胃がん群試験の15年間の追跡調査では、D2リンパ節郭清では長期的な生存期間の利益は認められませんでした(29%対21%、 P = .34)が、胃がん関連死亡率は有意に減少し(37% vs 48%、 P = 0.01)、D1手術よりも局所地域の再発率が低いことが示されました。しかし 、より広範なD2リンパ節摘出術を受けた患者では、術後罹患率(43%対25%)および死亡率(10%対4%)が有意に高かった。これは、この群で全リンパ節郭清を達成するために脾臓切除術および膵臓切除術がより多く行われたことが主な要因である。同様に 、英国医学研究評議会(Medical Research Council)が実施した英国協同試験では、D2解離に無作為化された患者において、伴う脾摘出術および膵切除術の高い合併率と関連した罹患率の増加が報告されました。12
これら2つの研究結果にもかかわらず、研究者たちは、長期にわたるD2リンパ節郭清後の合併症率を低減できれば、アジアの経験豊富なセンターが報告したD2解離による生存率の利益が、西洋の胃がん患者にも反映される可能性があると主張しています。13 そこで、イタリア胃がん研究グループは、患者を膵臓保存型D2リンパ節摘出術またはD1リンパ節摘出術のいずれかに無作為に割り当てる第III相試験を実施し、日本の熟練外科医の観察を通じて厳格な技術訓練を修了した外科医によって、膵臓保存型D2リンパ節摘出術またはD1リンパ節摘出術のいずれかを大量の治療施設で無作為に割り当てました。彼らは、D2解離を受けた患者の罹患率(17.9%)と死亡率(3.0%)が非常に低いと報告しました。この手術では、膵臓切除術または脾摘出術は直接的な腫瘍浸潤のみで行われました。14 しかし、D1群とD2群の間で5年生存期間の差は見られませんでした(66.5% 対 64.2%; P = 0.695)を含みますが、サブグループ解析ではD2リンパデンクト摘出術がT2–T4および/またはリンパ節陽性腫瘍の患者に有益である可能性が示唆されました。14
D2リンパ節郭清が単なる徹底的な病期診断手術なのか、それとも特定の患者群(例:N2患者)に対して治療効果があるのかは依然として不明です。米国がん合同委員会(AJCC)の最新第7版の病期管理マニュアルによると、胃がん患者の正確な病期評価には少なくとも15個のリンパ節の評価が必要です。15 ノードステージングは、N1(1〜2の正ノード)、N2(3〜6の正のノード)、N3a(7〜15の正のノード)、N3b(16+正のノード)のカテゴリを持つ正ノードの数に基づいています。研究では、患者の生存率の改善と標本で検査されたリンパ節の数の増加と相関関係が示されています。もちろん 、これは治療効果というより正確な病期調整を反映しているだけかもしれません。しかし、より広範なリンパ節摘出術が局所性再発率を低減させるという間接的な証拠があり、これが生存率向上につながる可能性があります。実際、台湾の単一施設で実施されたランダム化試験では、D3解離を受けた患者(59.5%)に対し、D1解離を受けた患者(53.6%)に対し、全体的な5年間生存率の優位性が認められました。13
過去10年間にMGHで治療を受けた患者では、胃切除術とD2リンパ節摘出術後の罹患率と死亡率がそれぞれ17%と0%と報告されており、標本の体外解剖による中央値リンパ節の収量は40個に増加しました。アメリカ合衆国におけるサブガトルおよび全胃切除術の中央値入院期間は平均9〜10日ですが、多くの患者は7日以内に退院します。サブホールおよび全胃切除術の長期的な合併症には、ビタミンB12、ビタミンD、鉄、カルシウムのビタミン・ミネラル欠乏、そしてアルカリ性逆流性胃炎、ダンピング症候群、ルー・スタシス症候群、求心性肢症候群などの典型的な胃切除後症候群が含まれます。
局所性胃がんに対する唯一の治癒可能な治療法は手術ですが、R0切除が可能な患者でも、周術化学療法または術後化学放射線療法で5年生存率は35%から40%にとどまります。胃がん治療の将来の進展は、より良い全身療法の開発と早期診断のための技術の開発にかかっています。
A. 遠位胃切除術:
胃腺癌、卵管型、不一致修復タンパク質発現不安定。(総観報告を参照)
B. リンパ節生検、ステーション8:
4つのリンパ節に悪性腫瘍の証拠はありません(0/4)。
C. リンパ節生検、ステーション11:
2つのリンパ節に悪性腫瘍の証拠はありません(0/2)。
D. リンパ節生検、ステーション7:
2つのリンパ節に悪性腫瘍の証拠はありません(0/2)。
E. リンパ節生検、ステーション3:
1つのリンパ節に悪性腫瘍の証拠はありません(0/1)。
総括報告:
腫瘍病期概要:pT1bN0。
特定部位:胃の前骨。
腫瘍の大きさ(最大寸法):0.3 cm(スライドで測定)。
WHO分類:管状腺癌。
組織学的評価:G1(十分に区別がつき)
浸潤の程度:pT1b(腫瘍が粘膜下に侵入)。
小血管(血液/リンパ)浸潤:欠如。
大血管(静脈)浸潤:欠如。
ペリニューラル侵入:欠席。
近位胃縁:浸潤性癌は関与していない。
遠位十二指腸縁:浸潤性癌による関与なし。(クリアランス=0.4 cm)
局所リンパ節:pN0(局所リンパ節転移なし):31個のリンパ節を検査。
*リンパ節の総数はすべての検体部位を含むものです。主標本(標本A)には22個のリンパ節が含まれていました。
HER2免疫組織化学:彼女の2スコアは0/陰性(腫瘍細胞の10%で反応性や非常に薄い膜染色なし<)。
追加研究:
MLH1とPMSは敗北。
MSH2とMSH6は無傷です。
追加調査:
腸の化生および高度の異形成を伴う胃の肛門粘膜。
根底底腺ポリープ。
エプスタイン・バーウイルスコードRNA(EBER)は陰性です。
患者さんは手術から順調に回復し、術後5日目に退院しました。最終病理報告では腫瘍はT1bN0と診断され、切除縁は陰性でした。優れたリンパ節収穫(31個)を実現したため、この段階割り当ての正確性に自信を持っています。そのため、補助療法は不要で、長期的な予後も良好です。
固定式腹壁リトラクターシステムはこの手術に非常に役立ちます。私たちはBookwalterを使いましたが、他の選択肢としてはThompsonやOmniのリトラクターシステムがあります。十二指腸と胃はホチキスで切断されます。この場合は内膜GIAステープラーです。LigaSureやハーモニックメスなどの血管封閉装置は、小さな血管の効率的な制御に非常に役立ちます。左胃動脈のような大きな血管は、血管ステープラーで分割したり、従来の縫合結紮で制御したりできます。
著者側には開示すべき利益相反はありません。
この動画で言及されている患者は、撮影に十分な情報を持って同意しており、自身の健康情報が匿名の形でオンラインで公開されることを認識しています。
References
- がんゲノムアトラス研究ネットワーク。胃腺癌の包括的な分子特性解析。 自然。 2014;513(7517):202-209. doi:10.1038/nature13480。
- マレン JT. 胃がん。フィッシャー・J編『 外科の修士』第 7版フィラデルフィア(ペンシルベニア州):リッピンコット・ウィリアムズ&ウィルキンス;2017.
- ユンSS、パクDJ。胃腺癌です。収録:キャメロンJL、キャメロンAM編『 現在の外科的治療』第 11版。フィラデルフィア、ペンシルベニア州:ソーンダース、2014年:87-95。
- Yun M. 18 F-FDG PET/CT.を用いた胃がん代謝のイメージング。2014年;14(1):1-6.doi:10.5230/JGC.2014.14.1.1.
- イコマN、ブルムM、チャンYJら。胃がんの放射線隠匿性腹膜癌に対する期末期腹腔鏡および洗浄細胞学の成果。 アン外科腫瘍外科。 2016;23(13):4332-4337. DOI:10.1245/S10434-016-5409-7。
- マクドナルドJS、スモーリーSR、ベネデッティJ他。胃または胃食道接合部の腺癌に対する手術後の化学放射線療法と単独手術の比較。 N Engl J Med. 2001;345(10):725-730. doi:10.1056/NEJMoa010187。
- カニンガムD、アラムWH、ステニングSP他。切除可能な胃食道がんに対する術前期化学療法と手術単独の比較。 N Engl J Med. 2006;355(1):11-20. doi:10.1056/NEJMoa055531。
- ボゼッティF、丸ビニE、ボンファンティG、ミチェリR、ピアノC、ジェンナリL;イタリア消化管腫瘍研究グループ。胃がんに対する小総胃切除術と全胃切除術:イタリアの多施設無作為化試験における5年生存率。 アン・サージ。 1999;230(2):170-178. DOI:10.1097/00000658-199908000-00006。
- ボネンカンプ JJ、ハーマンズ J、佐佐子 M 他;オランダ胃がんグループ。胃がんのための拡張リンパ節郭清。 N Engl J Med. 1999;340(12):908-914. DOI:10.1056/NEJM199903253401202。
- 丸山K、岡林K、木下T. 日本の胃外科の進展とその根治性の限界。 ワールド・ジャーナル・サージ。 1987;11(4):418-425. doi:10.1007/BF01655804。
- 佐佐子 M、マッカロック P、木下 T、丸山 K.胃がんに対するリンパ節郭清の治療的価値を評価する新しい方法。 Br J サージ。 1995;82(3):346-351. doi:10.1002/bjs.1800820321。
- クッシェリA、ウィーデンS、フィールディングJら;外科協同組合グループ。胃がんのD1 およびD2 切除後の患者生存率:MRCランダム化手術試験の長期結果。 Br J がん。 1999;79(9-10):1522-1530. DOI:10.1038/SJ.BJC.6690243..
- ウー・CW、ション・CA、ロ・SSら。胃がん患者のリンダーハリクリー:ランダム化比較試験。 ランセット・オンコール。 2006;7(4):309-315. doi:10.1016/S1470-2045(06)70623-4。
- デジュリM、佐佐子M、ポンティA;イタリア胃がん研究グループ。イタリア胃がん研究グループにおけるD1とD2の切除術のランダム化臨床試験における罹患率および死亡率。 Br J サージ。 2010;97(5):643-649. doi:10.1002/BJS.6936。
- エッジSB、バード博士、コンプトンCC、フリッツAG、グリーンF、トロッティA編。 AJCCがんステージハンドブック。 第7版。ニューヨーク州ニューヨーク:スプリンガー;2010.
- スミス、シュワルツRR、シュワルツRE。胃がんの胃切除術後の病期分類および生存率に対するリンパ節数の総リンパ節数の影響:米国の大規模なデータベースからのデータ。 J クリン・オンコール。 2005;23(28):7114-7124. doi:10.1200/JCO.2005.14.621.
Cite this article
メリル、アラバマ州、マレン、JT。開腹末位胃切除術。 J Med Insight。 2024;2024(191). doi:10.24296/jomi/191。


.jpg&w=3840&q=75&dpl=dpl_Ca7gcJXjbQN6bK8aruk8U4KsAWv7)
.jpg&w=3840&q=75&dpl=dpl_Ca7gcJXjbQN6bK8aruk8U4KsAWv7)