Gastrectomie distale ouverte
Main Text
Table of Contents
Une résection complète à marge négative (R0) reste le seul traitement potentiellement curatif de l’adénocarcinome gastrique. Le choix de l’opération dépend de la localisation de la tumeur ainsi que du stade de la maladie. Ce patient présentait une anémie symptomatique et le bilan a montré une gastrite et une petite tumeur dans l’estomac distal. Des biopsies ont confirmé un adénocarcinome et une échographie endoscopique (EUS) a permis de définir cette tumeur comme T2 N0. Les scintigraphies de stadification n’ont montré aucun signe de maladie métastatique à distance. Étant donné que ce patient avait une tumeur à un stade relativement précoce, nous avons choisi de procéder à une intervention chirurgicale initiale, qui dans ce cas impliquait une gastrectomie distale. Cette vidéo montre la technique d’un chirurgien gastrique expérimenté pour effectuer une gastrectomie distale ouverte avec un curage ganglionnaire D1 « étendu ».
Bien que l’incidence du cancer gastrique aux États-Unis ait considérablement diminué au cours des dernières décennies, le cancer gastrique reste une cause importante de décès liés au cancer. Malgré des améliorations significatives dans les modalités de stadification, le traitement chirurgical et les soins périopératoires, le pronostic de la plupart des patients atteints d’un cancer gastrique reste mauvais. Cela est en grande partie le résultat de la biologie agressive de ce cancer ainsi que du stade avancé de la maladie auquel la plupart des patients se présentent au clinicien. Les facteurs de risque comprennent l’infection à Helicobacter pylori et au virus d’Epstein-Barr (EBV), l’anémie pernicieuse, une résection gastrique antérieure, le tabagisme et une consommation élevée de sel. Environ 10 % des cancers gastriques sont dus à des syndromes de cancer héréditaire, y compris le cancer gastrique diffus héréditaire (HDGC), caractérisé par des mutations germinales du gène E-cadhérine (CDH1), et le syndrome du cancer colorectal héréditaire sans polypose (HNPCC), caractérisé par des mutations germinales dans les gènes de réparation des mésappariements de l’ADN. Récemment, une évaluation moléculaire complète du cancer gastrique a conduit à un schéma de classification qui définit 4 sous-types génomiques majeurs et leurs fréquences approximatives : tumeurs infectées par l’EBV (9 %), tumeurs instables par microsatellites (MSI-high) (22 %), tumeurs génomiquement stables (20 %) et tumeurs chromosomiquement instables (50 %). 1
Il y a peu de symptômes classiques, voire aucun, évocateurs d’un diagnostic de cancer de l’estomac, ce qui explique pourquoi ce cancer est souvent diagnostiqué à un stade avancé. Les premiers symptômes, tels que la douleur épigastrique, la dyspepsie et le reflux acide, sont si peu spécifiques que la plupart des patients sont simplement traités empiriquement avec des antiacides sans autre investigation. Au fur et à mesure que la maladie progresse, les symptômes deviennent plus importants et plus inquiétants et comprennent des plaintes telles que la dysphagie, les nausées, les vomissements, la satiété précoce, l’anorexie, la fatigue et la perte de poids. L’emplacement et le type histologique du cancer gastrique dictent souvent le complexe des symptômes, de la dysphagie pour les tumeurs proximales aux vomissements pour les tumeurs distales obstructives, en passant par la satiété précoce et la perte de poids pour les tumeurs de type diffus (linitis plastica). 2,3
Ce patient est un homme de 84 ans ayant des antécédents de gastrite et un rétrécissement chronique de la jonction gastro-œsophagienne qui s’est présenté à son médecin traitant avec des symptômes de fatigue et d’essoufflement. Une formule sanguine complète a été obtenue et a montré que le patient était anémique. Il a nié les douleurs abdominales, les nausées, les vomissements, les changements dans les habitudes intestinales, les difficultés à manger ou la perte de poids.
L’examen physique d’un patient atteint d’un cancer gastrique est généralement banal, à l’exception peut-être d’une sensibilité abdominale épigastrique et, moins probable, d’une masse épigastrique palpable. Les signes physiques éponymes classiques tels que le ganglion de Virchow, le nœud périumbilical de Sœur Mary Joseph et la tablette de Blumer sont rarement présents, mais lorsqu’ils sont vus, ils indiquent une maladie métastatique avancée. De même, la présence de cachexie, de jaunisse, d’ascite et d’hépatomégalie chez un patient atteint d’un cancer gastrique signifie généralement une maladie métastatique incurable. Notre malade paraissait bien portant, et à l’examen, il avait un abdomen mou et aucune masse palpable.
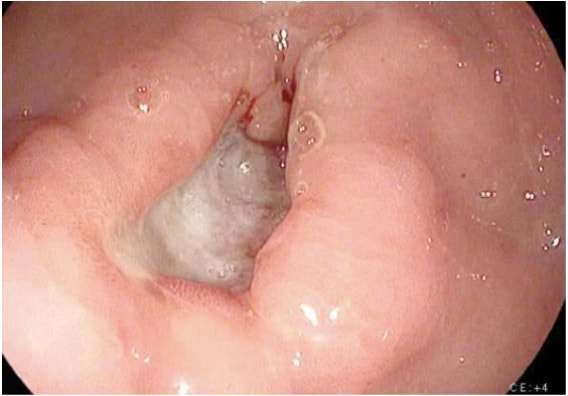
L’imagerie pour le dépistage du cancer gastrique comprend une variété d’études. Le diagnostic du cancer gastrique est généralement facilement établi par endoscopie avec biopsie (Fig. 1). L’endoscopie définit l’emplacement et l’étendue de la tumeur dans l’estomac et, lorsqu’elle est combinée à l’échographie endoscopique (EUS), permet une estimation précise de la profondeur de l’invasion tumorale (stade T). L’EUS est la modalité la plus sensible pour établir le stade T d’un cancer gastrique, et l’EUS permet une évaluation des ganglions lymphatiques régionaux et une biopsie à l’aiguille des ganglions suspects pour confirmer l’atteinte ganglionnaire (stade N). Une tomodensitométrie du thorax, de l’abdomen et du bassin doit être effectuée pour évaluer la propagation métastatique à distance, par exemple aux poumons, au foie, au péritoine ou aux ganglions lymphatiques en dehors du champ de résection. De plus, une tomodensitométrie est sensible pour détecter même de petites quantités d’ascite qui peuvent représenter une propagation tumorale péritonéale et qui peuvent être échantillonnées par des moyens guidés par l’image pour l’examen cytologique. Bien que la TEP et la TEP-TDM ne soient pas systématiquement recommandées dans la stadification préopératoire du cancer gastrique, elles peuvent certainement fournir des informations utiles supplémentaires. La TEP a une faible sensibilité dans la détection de la tumeur primaire, en particulier dans les cancers gastriques précoces et de type diffus, mais la TEP a une spécificité plus élevée que la TDM (90 % contre 60 %) dans la détection des métastases ganglionnaires régionales et a une sensibilité raisonnable pour la détection des métastases hépatiques, pulmonaires et ganglionnaires distantes. 4 De plus, la TEP peut être utilisée pour surveiller la réponse tumorale à la chimiothérapie néoadjuvante, car elle détecte avec précision les répondeurs au traitement à un stade précoce, permettant ainsi au clinicien de maintenir les patients sous un régime de chimiothérapie aussi actif que possible.
Les patients atteints de cancers locorégionaux avancés (T3+/N+) sont considérés pour une stadification supplémentaire par laparoscopie. La laparoscopie de stadification peut être effectuée immédiatement avant la laparotomie planifiée ou comme procédure de prétraitement effectuée chez les patients envisageant un traitement préopératoire. La laparoscopie de stadification surpasse plus de 30 % des patients grâce à l’identification de métastases péritonéales et hépatiques occultes par radiographie et à une cytologie positive. 5
Le cancer gastrique se propage généralement par les ganglions lymphatiques ou par métastases hématogènes et se métastase généralement au foie, aux poumons ou au péritoine. Il peut également se propager directement pour impliquer des organes adjacents, tels que le pancréas et le côlon transverse. La seule thérapie curative potentielle pour le cancer gastrique est la chirurgie. Même avec une résection complète, à marge négative et un traitement (néo)adjuvant, le taux de survie à 5 ans reste faible à ~40 %.
Le paradigme de traitement le plus courant pour le cancer gastrique aux États-Unis a toujours été la chirurgie initiale, suivie d’une chimioradiothérapie adjuvante (telle que décrite dans l’essai Intergroup 0116) pour les patients atteints de tumeurs à haut risque (T3/4, ganglions positifs, de type peu cohésif). 6 Cependant, seulement 64 % des patients de cet essai ont pu recevoir la chimioradiothérapie postopératoire comme prévu, et beaucoup sont en faveur de la chimiothérapie périopératoire pour ces patients, comme décrit dans l’essai MAGIC mené par le British Medical Research Council. Dans cet essai, les patients ont été randomisés pour recevoir soit une chimiothérapie périopératoire (trois cycles d’épirubicine, de cisplatine et de 5-fluorouracile (ECF) préopératoire et postopératoire) et une intervention chirurgicale ou une intervention chirurgicale seule. Les taux de survie à cinq ans étaient supérieurs dans le groupe de chimiothérapie périopératoire par rapport au groupe de chimiothérapie seule (36 % contre 23 %). 7 Bien que seulement ~ 40 % des patients terminent tout le traitement recommandé avec cette approche de traitement, plus de 85 % des patients reçoivent les 3 cycles prévus de chimiothérapie préopératoire, et tous les patients reçoivent au moins un cycle de chimiothérapie. L’administration d’au moins quelques cycles de thérapie systémique avant la chirurgie pour les patients atteints de tumeurs à haut risque confère plusieurs avantages : (1) elle permet un traitement précoce d’une éventuelle maladie micrométastatique ; (2) on peut surveiller la réponse tumorale in vivo à la thérapie, comme avec l’imagerie TEP-CT ; et (3) on peut sélectionner pour les patients présentant une biologie tumorale particulièrement mauvaise qui développent une maladie métastatique précoce et qui ne tireraient donc aucun avantage de survie de la gastrectomie. 7
Une résection complète à marge négative (R0) reste le seul traitement potentiellement curatif de l’adénocarcinome gastrique. Le choix de l’opération dépend de la localisation de la tumeur ainsi que du stade de la maladie. Les cancers gastriques superficiellement invasifs (T1a) de grade histologique favorable peuvent être traités par résection muqueuse endoscopique ou exérèse cunéiforme avec ou sans biopsie concomitante du ganglion sentinelle. De telles procédures ont été largement décrites par nos collègues chirurgiens du Japon, où les cancers gastriques sont fréquemment diagnostiqués à un stade précoce compte tenu de la prévalence des examens endoscopiques de dépistage dans ce pays. Étant donné que la majorité des patients aux États-Unis présentent des tumeurs symptomatiques et locorégionales avancées, la principale question chirurgicale est de savoir quelle procédure offre les meilleures chances de guérison avec une morbidité et une mortalité acceptables. De nombreux patients ne sont candidats à aucune intervention chirurgicale, soit parce qu’ils sont médicalement inaptes, soit en raison de la présence d’une maladie métastatique observée lors des études d’imagerie préopératoires ou au moment de la laparoscopie. Pour les patients candidats à la résection gastrique, les options comprennent la gastrectomie totale, proximale et distale. Il existe une expérience mondiale croissante dans la réalisation de ces procédures par laparoscopie, avec de meilleurs résultats à court terme et des rendements ganglionnaires, et des résultats de survie comparables à ceux des procédures ouvertes traditionnelles. Cependant, la grande majorité des résections du cancer gastrique aux États-Unis sont encore réalisées via l’approche ouverte.
Les patients qui devraient être envisagés pour une résection chirurgicale immédiate comprennent ceux atteints de cancers gastriques à un stade précoce (T1/T2 N0) et ceux qui nécessitent une palliation immédiate d’un saignement ou d’une obstruction luminale associée à une tumeur de haut grade. Cependant, les taux de morbidité et de mortalité périopératoires dans cette dernière population de patients sont significatifs et doivent être soigneusement mis en balance avec les avantages probables de la résection. Les patients atteints de cancers gastriques avancés locorégionaux sont de bons candidats pour la chimiothérapie préopératoire ou la chimioradiothérapie.
Parce que ce patient avait une tumeur à un stade relativement précoce (uT2N0) et qu’il était en remarquablement bonne santé pour son âge, on lui a proposé une intervention chirurgicale initiale avec une gastrectomie distale. Nous avons estimé qu’une gastrectomie distale ouverte limitait le risque de surtraitement par chimiothérapie néoadjuvante pour un cancer potentiellement à faible risque, tout en nous laissant la possibilité de lui proposer un traitement adjuvant si le rapport final de pathologie révélait un cancer plus avancé (p. ex., T3+/N+).
L’étendue de la résection gastrique est déterminée par l’emplacement et l’étendue de la tumeur primaire. Les essais prospectifs randomisés n’ont pas réussi à démontrer un avantage de survie pour la gastrectomie totale par rapport à la gastrectomie distale et subtotale chez les patients atteints de tumeurs de l’estomac distal. 8 Par conséquent, pour les patients chez qui une marge de 5 à 6 cm de la tumeur peut être obtenue tout en maintenant un reste gastrique de taille raisonnable, une résection gastrique plus conservatrice doit être effectuée, car elle confère un taux de survie équivalent avec moins de morbidité et une meilleure qualité de vie qu’une gastrectomie totale. 8 Néanmoins, une gastrectomie totale doit être réalisée si nécessaire pour obtenir une résection R0, car les marges de résection positives (résections R1) conduisent à une très faible survie. Dans l’essai néerlandais sur le cancer gastrique, 10 % des patients avaient une marge de résection positive et une survie à 3 ans inférieure (18 % contre 63 %) par rapport à ceux qui avaient une marge de résection négative. 9 Cependant, les marges microscopiques impliquées semblent affecter la survie à long terme uniquement chez les patients présentant cinq métastases ganglionnaires ou moins. Pour les cancers gastriques proximaux, de nombreux chirurgiens préfèrent une gastrectomie totale à une gastrectomie proximale en raison des séquelles à long terme du reflux acide symptomatique avec cette dernière procédure.
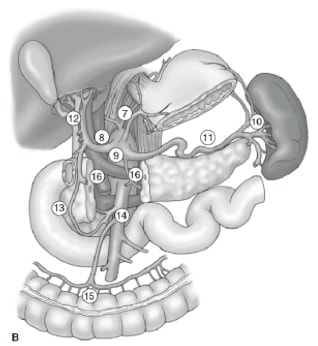
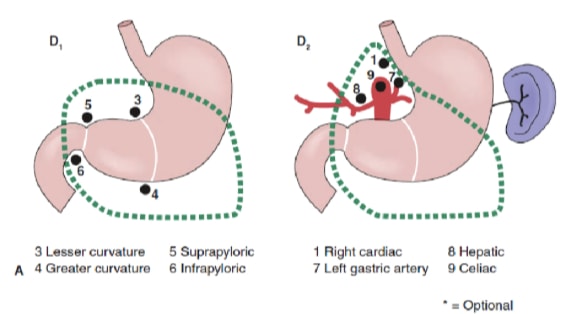
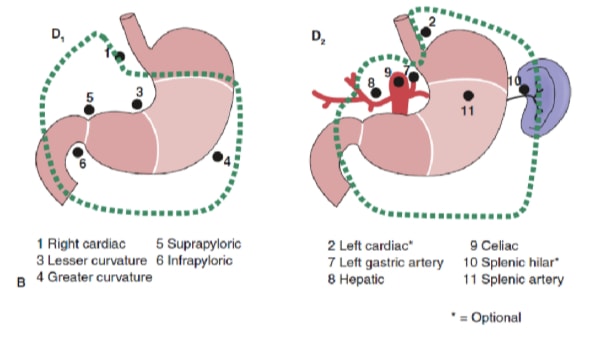
L’étendue du curage ganglionnaire est l’une des questions les plus controversées dans la prise en charge du cancer gastrique. Les rapports du registre du cancer gastrique et d’autres études rétrospectives ont fait de la gastrectomie radicale avec lymphadénectomie étendue (D2) la norme de soins pour le traitement du cancer gastrique curable au Japon. 10,11 La Société japonaise de recherche sur le cancer gastrique classe les bassins lymphatiques drainants de l’estomac en 16 stations, dont 6 stations périgastriques (Figure 2a) et 10 stations régionales le long des principaux vaisseaux et adjacents au pancréas (Figure 2b). L’étendue du curage ganglionnaire est indiquée par la désignation D. Une dissection D1 ne comprend que les ganglions périgastriques (stations 1 à 6) ; un curage ganglionnaire D2 comprend les ganglions lymphatiques le long des artères hépatiques, gastriques gauches, cœliaques et spléniques communes (stations 7 à 11) ; et une dissection D3 comprend des ganglions supplémentaires à l’intérieur de la porte hépatique et adjacents à l’aorte (stations 12 à 16) (Figure 3).
Deux grands essais randomisés prospectifs comparant les résultats de la dissection D1 à ceux de la dissection D2 ont été menés chez des patients occidentaux. Le suivi de quinze ans de la plus grande de ces deux études, à savoir l’essai du groupe néerlandais sur le cancer gastrique, n’a montré aucun avantage en termes de survie globale à long terme avec le curage ganglionnaire D2 (29 % contre 21 %, P = 0,34), mais a montré une diminution significative du taux de mortalité liée au cancer gastrique (37 % contre 48 %, P = 0,01) et un taux de récidive locorégional inférieur à celui de la chirurgie D1. 9 Cependant, les taux de morbidité postopératoire (43 % contre 25 %) et de mortalité (10 % contre 4 %) étaient significativement plus élevés chez les patients subissant une lymphadénectomie D2 plus étendue, en grande partie en raison du plus grand nombre de splénectomies et de pancréatectomies pratiquées dans ce groupe afin d’obtenir un curage ganglionnaire complet. 9 De même, l’essai coopératif britannique mené par le Medical Research Council a fait état d’une morbidité accrue, associée à des taux élevés de splénectomie et de pancréatectomie concomitantes, sans bénéfice en termes de survie globale ou sans récidive chez les patients randomisés pour une dissection D2. 12
Malgré les résultats de ces deux études, les chercheurs ont fait valoir que si le taux de complications après un curage ganglionnaire D2 prolongé pouvait être diminué, le bénéfice de survie conféré par un curage ganglionnaire D2, tel que rapporté par des centres expérimentés en Asie, pourrait être transposé aux patients occidentaux atteints de cancer gastrique. 13 Ainsi, le groupe italien d’étude du cancer gastrique a mené un essai de phase III randomisant des patients pour une lymphadénectomie D2 préservant le pancréas ou une lymphadénectomie D1 dans des centres à haut volume par des chirurgiens qui ont suivi une formation rigoureuse à la technique en observant des chirurgiens maîtres au Japon. Ils ont rapporté des taux de morbidité (17,9 %) et de mortalité (3,0 %) incroyablement bas chez les patients subissant la dissection D2, chez laquelle une pancréatectomie ou une splénectomie n’a été pratiquée que pour une invasion tumorale directe. 14 Cependant, ils n’ont trouvé aucune différence dans la survie globale à 5 ans entre les groupes D1 et D2 (66,5 % contre 64,2 % ; P = 0,695), bien que les analyses de sous-groupes aient suggéré qu’une lymphadénectomie D2 pourrait être bénéfique pour les patients atteints de tumeurs T2-T4 et/ou ganglionnaires. 14
Il n’est pas clair si un curage ganglionnaire D2 est simplement une procédure de stadification approfondie ou s’il peut y avoir un bénéfice thérapeutique pour certains sous-groupes de patients (par exemple, les patients atteints de la maladie N2). Il convient de noter que la stadification précise des patients atteints d’un cancer gastrique, selon la septième édition la plus récente du manuel de stadification de l’American Joint Committee on Cancer (AJCC), exige l’évaluation d’au moins 15 ganglions lymphatiques. 15 La stadification nodale est ensuite basée sur le nombre de nœuds positifs avec les catégories N1 (1 à 2 nœuds positifs), N2 (3 à 6 nœuds positifs), N3a (7 à 15 nœuds positifs) et N3b (16+ nœuds positifs). Des études ont montré une corrélation entre l’amélioration de la survie des patients et un plus grand nombre de ganglions lymphatiques examinés dans l’échantillon. 16 Bien sûr, il se peut qu’il s’agisse simplement d’une stadification plus précise plutôt que d’un avantage thérapeutique de l’intervention. Cependant, il existe des preuves indirectes que des lymphadénectomies plus étendues entraînent des taux plus faibles de récidive locorégionale, ce qui peut se traduire par un avantage en termes de survie. En effet, un essai randomisé mené dans un seul centre à Taïwan a identifié un avantage global de survie à 5 ans pour les patients subissant une dissection D3 (59,5 %) par rapport à ceux subissant une dissection D1 (53,6 %). 13
Pour les patients traités à l’HGM au cours de la dernière décennie, nous avons signalé des taux de morbidité et de mortalité après gastrectomie et lymphadénectomie D2 de 17 % et 0 %, respectivement, et notre rendement médian de ganglions lymphatiques avec dissection ex vivo de l’échantillon a augmenté à 40 ganglions. La durée médiane du séjour pour la gastrectomie subtotale et totale aux États-Unis est en moyenne de 9 à 10 jours, bien que de nombreux patients sortent de l’hôpital dans les 7 jours. Les complications à long terme de la gastrectomie subtotale et totale comprennent des carences en vitamines et minéraux, en particulier en vitamine B12, en vitamine D, en fer et en calcium, et les syndromes post-gastrectomie classiques, tels que la gastrite par reflux alcalin, le syndrome de chasse, le syndrome de stase de Roux et le syndrome des membres afférents.
La chirurgie est le seul traitement potentiellement curatif du cancer gastrique localisé, mais même pour les patients chez qui une résection R0 est possible, seulement 35 % à 40 % de survie à 5 ans est obtenue avec une chimiothérapie périopératoire ou une chimioradiothérapie postopératoire. Les progrès futurs dans le traitement du cancer gastrique dépendent du développement de meilleures thérapies systémiques ainsi que de techniques de diagnostic plus précoce.
A. RÉSECTION DISTALE DE L’ESTOMAC :
Adénocarcinome gastrique, de type tubulaire, expression de la protéine de réparation des mésappariements instable. (Voir rapport synoptique).
B. BIOPSIE DES GANGLIONS LYMPHATIQUES, STATION 8 :
Il n’y a aucun signe de malignité dans quatre ganglions lymphatiques (0/4).
C. BIOPSIE DES GANGLIONS LYMPHATIQUES, STATION 11 :
Il n’y a aucun signe de malignité dans deux ganglions lymphatiques (0/2).
D. BIOPSIE DES GANGLIONS LYMPHATIQUES, STATION 7 :
Il n’y a aucun signe de malignité dans deux ganglions lymphatiques (0/2).
E. BIOPSIE DES GANGLIONS LYMPHATIQUES, STATION 3 :
Il n’y a aucun signe de malignité dans un ganglion lymphatique (0/1).
RAPPORT SYNOPTIQUE :
RÉSUMÉ DU STADE DE LA TUMEUR : pT1bN0.
SITE SPÉCIFIQUE : Antrique gastrique.
TAILLE DE LA TUMEUR (plus grande dimension) : 0,3 cm (mesurée sur la lame).
CLASSIFICATION DE L’OMS : Adénocarcinome tubulaire.
GRADE HISTOLOGIQUE : G1 (Bien différencié)
ÉTENDUE DE L’INVASION : pT1b (La tumeur envahit la sous-muqueuse).
INVASION DES PETITS VAISSEAUX (SANGUINS/LYMPHATIQUES) : Absente.
INVASION DE GROS VAISSEAUX (VEINEUX) : Absente.
INVASION PÉRINEURALE : Absente.
MARGE GASTRIQUE PROXIMALE : Non touchée par le carcinome invasif.
MARGE DUODÉNALE DISTALE : Non impliquée par un carcinome invasif. (dégagement = 0,4 cm).
GANGLIONS LYMPHATIQUES RÉGIONAUX : pN0 (pas de métastases ganglionnaires régionales) : 31 ganglions lymphatiques examinés.
*Le total des ganglions lymphatiques comprend toutes les parties de l’échantillon. L’échantillon principal (échantillon A) contenait 22 ganglions lymphatiques.
IMMUNOHISTOCHIMIE HER2 : Son score 2 0/négatif (Pas de réactivité ou très faible coloration membraneuse dans < 10 % des cellules tumorales).
Études complémentaires :
MLH1 et PMS ont perdu.
MSH2 et MSH6 intacts.
Autres constatations :
Muqueuse antrale gastrique avec métaplasie intestinale et dysplasie de haut grade.
Polype de la glande fundique.
L’ARN codé par le virus d’Epstein-Barr (EBER) est négatif.
Notre patient s’est bien rétabli de l’opération et a reçu son congé le 5e jour postopératoire. Son rapport final de pathologie a révélé que sa tumeur était T1bN0 et que les marges de résection étaient négatives. Nous avons obtenu une excellente récolte ganglionnaire (31 ganglions lymphatiques), nous pouvons donc être confiants dans la précision de cette attribution d’étape. En tant que tel, il n’a pas besoin de traitement adjuvant et son pronostic à long terme est excellent.
Un système d’écarteur de paroi abdominale fixe peut être très utile pour cette opération ; nous avons utilisé le Bookwalter, mais d’autres options incluent les systèmes d’écarteur Thompson et Omni. Le duodénum et l’estomac sont coupés à l’aide d’agrafeuses, dans ce cas-ci, une agrafeuse Endo-GIA. Un dispositif d’étanchéité des vaisseaux, tel qu’un appareil LigaSure ou un scalpel Harmonic, est très utile pour le contrôle efficace des petits vaisseaux sanguins. Les gros vaisseaux, tels que l’artère gastrique gauche, peuvent être divisés à l’aide d’une agrafeuse vasculaire ou contrôlés par une ligature de suture traditionnelle.
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Le patient dont il est question dans cet article vidéo a donné son consentement éclairé pour être filmé et sait que ses informations personnelles de santé seront publiées en ligne de manière non identifiée.
References
- Réseau de recherche sur l’atlas du génome du cancer. Caractérisation moléculaire complète de l’adénocarcinome gastrique. Nature. 2014; 513(7517):202-209. doi :10.1038/nature13480.
- Mullen JT. Cancer gastrique. Dans : Fischer J, ed. Mastery of Surgery. 7e éd. Philadelphie, Pennsylvanie : Lippincott Williams et Wilkins ; 2017.
- Yoon SS, DJ du parc. Adénocarcinome gastrique. Dans : Cameron JL, Cameron AM, eds. Thérapie chirurgicale actuelle. 11e éd. Philadelphie, Pennsylvanie : Saunders, 2014 : 87-95.
- Yun M. Imagerie du métabolisme du cancer gastrique à l’aide du 18 F-FDG PET/CT. J Cancer gastrique. 2014 ; 14(1):1-6. doi :10.5230/jgc.2014.14.1.1.
- Ikoma N, Blum M, Chiang YJ, et al. Rendement de la laparoscopie de stadification et de la cytologie de lavage pour la carcinose péritonéale radiologiquement occulte du cancer gastrique. Ann Surg Oncol. 2016; 23(13):4332-4337. doi :10.1245/s10434-016-5409-7.
- Macdonald JS, Smalley SR, Benedetti J, et al. La chimioradiothérapie après la chirurgie comparée à la chirurgie seule pour l’adénocarcinome de l’estomac ou de la jonction gastro-œsophagienne. N Engl J Med. 2001; 345(10):725-730. doi :10.1056/NEJMoa010187.
- Cunningham D, Allum WH, Stenning SP, et al. Chimiothérapie périopératoire par rapport à la chirurgie seule pour le cancer gastro-œsophagien résécable. N Engl J Med. 2006; 355(1):11-20. doi :10.1056/NEJMoa055531.
- Bozzetti F, Marubini E, Bonfanti G, Miceli R, Piano C, Gennari L ; Groupe italien d’étude des tumeurs gastro-intestinales. Gastrectomie subtotale versus gastrectomie totale pour le cancer gastrique : taux de survie à cinq ans dans un essai italien randomisé multicentrique. Ann Surg. 1999; 230(2):170-178. doi :10.1097/00000658-199908000-00006.
- les juges Bonenkamp, Hermans J, Sasako M, et al ; Groupe néerlandais du cancer gastrique. Curage ganglionnaire prolongé pour le cancer gastrique. N Engl J Med. 1999; 340(12):908-914. doi :10.1056/NEJM199903253401202.
- Maruyama K, Okabayashi K, Kinoshita T. Les progrès de la chirurgie gastrique au Japon et ses limites de radicalité. Monde J Surg. 1987; 11(4):418-425. doi :10.1007/BF01655804.
- Sasako M, McCulloch P, Kinoshita T, Maruyama K. Nouvelle méthode pour évaluer la valeur thérapeutique du curage ganglionnaire pour le cancer gastrique. Br J Surg. 1995; 82(3):346-351. doi :10.1002/bjs.1800820321.
- Cuschieri A, Weeden S, Fielding J, et al ; Groupe coopératif chirurgical. Survie des patients après résections enJ1 et J2 pour le cancer de l’estomac : résultats à long terme de l’essai chirurgical randomisé MRC. Br J Cancer. 1999; 79(9-10):1522-1530. doi :10.1038/sj.bjc.6690243..
- Wu CW, Hsiung CA, Lo SS, et al. Dissection ganglionnaire chez les patients atteints d’un cancer gastrique : un essai contrôlé randomisé. Lancet Oncol. 2006; 7(4):309-315. doi :10.1016/S1470-2045(06)70623-4.
- Degiuli M, Sasako M, Ponti A ; Groupe italien d’étude du cancer gastrique. Morbidité et mortalité dans l’essai clinique randomisé du groupe d’étude italien sur le cancer gastrique de la résection D1 par rapport à la résection D2 pour le cancer gastrique. Br J Surg. 2010; 97(5):643-649. doi :10.1002/bjs.6936.
- Edge SB, Byrd DR, Compton CC, Fritz AG, Greene F, Trotti A, eds. AJCC Cancer Staging Handbook. 7e éd. New York, NY : Springer ; 2010.
- Smith DD, Schwarz RR, Schwarz RE. Impact du nombre total de ganglions lymphatiques sur la stadification et la survie après une gastrectomie pour le cancer gastrique : données d’une grande base de données de la population américaine. J Clin Oncol. 2005; 23(28):7114-7124. doi :10.1200/JCO.2005.14.621.
Cite this article
Merrill AL, Mullen JT. Gastrectomie distale ouverte. J Med Insight. 2024; 2024(191). doi :10.24296/jomi/191.


.jpg&w=3840&q=75&dpl=dpl_Ca7gcJXjbQN6bK8aruk8U4KsAWv7)
.jpg&w=3840&q=75&dpl=dpl_Ca7gcJXjbQN6bK8aruk8U4KsAWv7)