Gastrectomía distal abierta
Main Text
Table of Contents
Una resección completa con margen negativo (R0) sigue siendo el único tratamiento potencialmente curativo para el adenocarcinoma gástrico. La elección de la operación depende de la ubicación del tumor, así como del estadio de la enfermedad. Este paciente presentó anemia sintomática y el estudio mostró gastritis y un pequeño tumor en el estómago distal. Las biopsias confirmaron adenocarcinoma y una ecografía endoscópica (EUS) estadificó este tumor como T2 N0. Las exploraciones de estadificación no mostraron evidencia de enfermedad metastásica a distancia. Dado que este paciente tenía un tumor en estadio relativamente temprano, se optó por proceder a la cirugía inicial, que en este caso implicó una gastrectomía distal. Este video muestra la técnica de un cirujano gástrico experimentado para realizar una gastrectomía distal abierta con una disección "extendida" de los ganglios linfáticos D1.
Aunque la incidencia del cáncer gástrico en los Estados Unidos ha disminuido drásticamente durante las últimas décadas, el cáncer gástrico sigue siendo una causa importante de muerte relacionada con el cáncer. A pesar de las mejoras significativas en las modalidades de estadificación, el tratamiento quirúrgico y la atención perioperatoria, el pronóstico de la mayoría de los pacientes con cáncer gástrico sigue siendo precario. Esto se debe en gran medida a la biología agresiva de este cáncer, así como a la etapa avanzada de la enfermedad en la que la mayoría de los pacientes acuden al médico. Los factores de riesgo incluyen la infección por Helicobacter pylori y el virus de Epstein-Barr (VEB), la anemia perniciosa, la resección gástrica previa, el tabaquismo y el alto consumo de sal. Aproximadamente el 10 % de los cánceres gástricos se deben a síndromes de cáncer hereditario, como el cáncer gástrico difuso hereditario (HDGC), caracterizado por mutaciones de la línea germinal en el gen E-cadherina (CDH1), y el síndrome de cáncer colorrectal hereditario sin poliposis (HNPCC), caracterizado por mutaciones de la línea germinal en los genes de reparación de errores de emparejamiento del ADN. Recientemente, una evaluación molecular integral del cáncer gástrico ha dado lugar a un esquema de clasificación que define 4 subtipos genómicos principales y sus frecuencias aproximadas: tumores infectados por el VEB (9%), tumores inestables por microsatélites (MSI-alto) (22%), tumores genómicamente estables (20%) y tumores cromosómicamente inestables (50%). 1
Hay pocos síntomas clásicos, si es que hay alguno, que sugieran un diagnóstico de cáncer de estómago, lo que explica por qué este cáncer se diagnostica con frecuencia en una etapa avanzada. Los primeros síntomas, como el dolor epigástrico, la dispepsia y el reflujo ácido, son tan inespecíficos que la mayoría de los pacientes simplemente son tratados empíricamente con antiácidos sin más investigación. A medida que la enfermedad progresa, los síntomas se vuelven más prominentes y más ominosos e incluyen quejas como disfagia, náuseas, vómitos, saciedad temprana, anorexia, fatiga y pérdida de peso. La ubicación y el tipo histológico del cáncer gástrico a menudo determinan el complejo de síntomas, desde la disfagia para los tumores proximales hasta los vómitos para los tumores distales obstructivos, la saciedad temprana y la pérdida de peso para los tumores de tipo difuso (linitis plástica). 2,3
Se trata de un paciente de 84 años de edad, con antecedentes de gastritis y estenosis crónica de la unión gastroesofágica, que acudió a su médico de atención primaria con síntomas de fatiga y dificultad para respirar. Se obtuvo un hemograma completo que mostró que el paciente estaba anémico. Negó dolor abdominal, náuseas, vómitos, cambios en los hábitos intestinales, dificultad para comer o pérdida de peso.
Por lo general, el examen físico de un paciente con cáncer gástrico no presenta presentaciones, con la excepción de dolor a la palpación abdominal epigástrica y, menos probable, de una masa epigástrica palpable. Los hallazgos físicos epónimos clásicos, como el ganglio de Virchow, el ganglio periumbilical de la hermana Mary Joseph y la plataforma de Blumer, rara vez están presentes, pero cuando se ven indican una enfermedad metastásica avanzada. De manera similar, la presencia de caquexia, ictericia, ascitis y hepatomegalia en un paciente con cáncer gástrico generalmente significa enfermedad metastásica incurable. Nuestro paciente presentaba buen aspecto, y a la exploración presentaba abdomen blando y sin masas palpables.
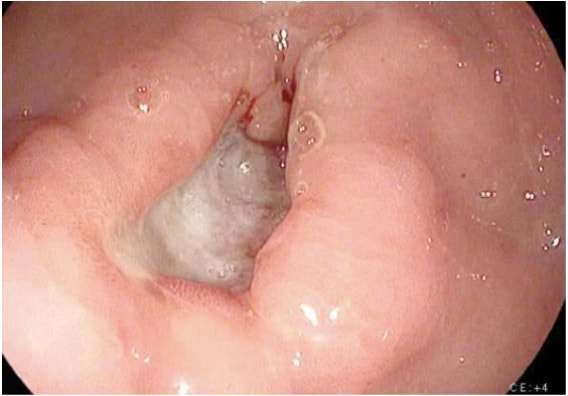
Las pruebas de diagnóstico por imágenes para el diagnóstico del cáncer gástrico incluyen una variedad de estudios. El diagnóstico de cáncer gástrico suele establecerse fácilmente mediante endoscopia con biopsia (Fig. 1). La endoscopia define la ubicación y la extensión del tumor dentro del estómago y, cuando se combina con la ecografía endoscópica (EUS), permite estimar con precisión la profundidad de la invasión tumoral (estadio T). La USE es la modalidad más sensible para establecer el estadio T de un cáncer gástrico, y la USE permite una evaluación de los ganglios linfáticos regionales y la biopsia con aguja de los ganglios sospechosos para confirmar la afectación ganglionar (estadio N). Se debe realizar una tomografía computarizada del tórax, el abdomen y la pelvis para evaluar si hay diseminación metastásica a distancia, como a los pulmones, el hígado, el peritoneo o los ganglios linfáticos fuera del campo de resección. Además, una tomografía computarizada es sensible para detectar incluso pequeñas cantidades de ascitis que pueden representar la diseminación del tumor peritoneal y que se pueden muestrear por medios guiados por imágenes para el examen citológico. Aunque la TEP y la TEP-TC no se recomiendan de forma rutinaria en la estadificación preoperatoria del cáncer gástrico, sin duda pueden proporcionar información útil adicional. La PET tiene una baja sensibilidad en la detección del tumor primario, especialmente en cánceres gástricos tempranos y difusos, pero la PET tiene una mayor especificidad que la TC (90% vs. 60%) en la detección de metástasis en los ganglios linfáticos regionales y tiene una sensibilidad razonable para la detección de metástasis en hígado, pulmón y ganglios linfáticos distantes. 4 Además, la PET se puede utilizar para monitorizar la respuesta tumoral a la quimioterapia neoadyuvante, ya que detecta con precisión a los pacientes que responden a la terapia en una etapa temprana, lo que permite al médico mantener a los pacientes en un régimen de quimioterapia lo más activo posible.
Los pacientes con cánceres locorregionalmente avanzados (T3+/N+) se consideran para estadificación adicional mediante laparoscopia. La laparoscopia de estadificación se puede realizar inmediatamente antes de la laparotomía planificada o como un procedimiento previo al tratamiento que se realiza en pacientes que están considerando la terapia preoperatoria. La estadificación de la laparoscopia supera a más del 30 % de los pacientes mediante la identificación de metástasis peritoneales y hepáticas radiográficamente ocultas y la citología positiva. 5
Por lo general, el cáncer gástrico se disemina a través de los ganglios linfáticos o de forma hematógena y comúnmente hace metástasis al hígado, los pulmones o el peritoneo. También puede propagarse directamente para afectar a los órganos adyacentes, como el páncreas y el colon transverso. La única terapia curativa potencial para el cáncer gástrico es la cirugía. Incluso con una resección completa con margen negativo y una terapia (neo)adyuvante, la tasa de supervivencia a 5 años sigue siendo baja, de ~40%.
Históricamente, el paradigma de tratamiento más común para el cáncer gástrico en los Estados Unidos ha sido la cirugía inicial, seguida de quimiorradioterapia adyuvante (como se describe en el ensayo Intergroup 0116) para aquellos pacientes con tumores de riesgo alto (T3/4, ganglios positivos, tipo poco cohesivo). 6 Sin embargo, solo el 64% de los pacientes de este ensayo pudieron recibir la quimiorradioterapia postoperatoria según lo planeado, por lo que muchos están a favor de la quimioterapia perioperatoria para dichos pacientes, como se describe en el ensayo MAGIC realizado por el British Medical Research Council. En este ensayo, los pacientes se asignaron al azar para recibir quimioterapia perioperatoria (tres ciclos de epirrubicina, cisplatino y 5-fluorouracilo (ECF) antes y después de la operación) y cirugía o cirugía sola. Las tasas de supervivencia a cinco años fueron superiores en el grupo de quimioterapia perioperatoria en comparación con el grupo de cirugía sola (36 vs. 23 %). 7 Aunque solo ~ 40% de los pacientes completan toda la terapia recomendada con este enfoque de tratamiento, más del 85% de los pacientes reciben los 3 ciclos planificados de quimioterapia preoperatoria, y todos los pacientes reciben al menos un ciclo de quimioterapia. La administración de al menos unos pocos ciclos de terapia sistémica antes de la cirugía para pacientes con tumores de riesgo alto confiere varias ventajas: (1) permite el tratamiento temprano de una posible enfermedad micrometastásica; (2) se puede monitorizar la respuesta tumoral in vivo a la terapia, como en el caso de las imágenes de PET-TC; y (3) se puede seleccionar a aquellos pacientes con una biología tumoral particularmente mala que desarrollan enfermedad metastásica temprana y que, por lo tanto, no obtendrían ningún beneficio de supervivencia de la gastrectomía. 7
Una resección completa con margen negativo (R0) sigue siendo el único tratamiento potencialmente curativo para el adenocarcinoma gástrico. La elección de la operación depende de la ubicación del tumor, así como del estadio de la enfermedad. Los cánceres gástricos superficialmente invasivos (T1a) de grado histológico favorable se pueden tratar mediante resección endoscópica de la mucosa o escisión en cuña con biopsia de ganglio linfático centinela o sin esta. Estos procedimientos han sido ampliamente descritos por nuestros colegas cirujanos de Japón, donde los cánceres gástricos se diagnostican con frecuencia en una etapa temprana dada la prevalencia de exámenes endoscópicos de detección en ese país. Debido a que la mayoría de los pacientes en los Estados Unidos presentan tumores sintomáticos locorregionalmente avanzados, la pregunta quirúrgica principal es qué procedimiento ofrece la mayor probabilidad de curación con una morbilidad y mortalidad aceptables. Muchos pacientes no son candidatos para ningún procedimiento quirúrgico, ya sea porque no son aptos desde el punto de vista médico o debido a la presencia de enfermedad metastásica observada en los estudios de imagen preoperatorios o en el momento de la laparoscopia. Para aquellos pacientes que son candidatos para la resección gástrica, las opciones incluyen gastrectomía total, proximal y distal. Existe una creciente experiencia mundial en la realización de estos procedimientos por vía laparoscópica, con mejores resultados a corto plazo y rendimientos ganglionares, y resultados de supervivencia que están a la par con los procedimientos abiertos tradicionales. Sin embargo, la gran mayoría de las resecciones para el cáncer gástrico en los Estados Unidos todavía se realizan a través del abordaje abierto.
Los pacientes que se deben considerar para una resección quirúrgica inmediata son aquellos con cánceres gástricos en estadio temprano (T1/T2 N0) y aquellos que requieren paliación inmediata de la hemorragia o la obstrucción luminal asociada al tumor de grado alto. Sin embargo, las tasas de morbilidad y mortalidad perioperatorias en esta última población de pacientes son significativas y deben sopesarse cuidadosamente en comparación con los beneficios probables de la resección. Los pacientes con cánceres gástricos locorregionalmente avanzados son buenos candidatos para la quimioterapia o la quimiorradioterapia preoperatorias.
Debido a que este paciente tenía un tumor en etapa relativamente temprana (uT2N0) y gozaba de una salud notablemente buena para su edad, se le ofreció una cirugía inicial con una gastrectomía distal. Consideramos que una gastrectomía distal abierta limitaba el riesgo de sobretratamiento con quimioterapia neoadyuvante para un cáncer potencialmente de bajo riesgo, al tiempo que nos dejaba la opción de ofrecerle terapia adyuvante si el informe final de patología revelaba un cáncer más avanzado (p. ej., T3+/N+).
La extensión de la resección gástrica está determinada por la ubicación y la extensión del tumor primario. Los ensayos aleatorizados prospectivos no lograron demostrar una ventaja de supervivencia para la gastrectomía total sobre la gastrectomía distal y subtotal para los pacientes con tumores de estómago distal. 8 Por lo tanto, para aquellos pacientes en los que se puede obtener un margen de 5 a 6 cm del tumor manteniendo un remanente gástrico de tamaño razonable, se debe realizar una resección gástrica más conservadora, ya que esto confiere una tasa de supervivencia equivalente con menos morbilidad y una mejor calidad de vida que una gastrectomía total. 8 No obstante, se debe realizar una gastrectomía total si es necesario para lograr una resección R0, ya que los márgenes de resección positivos (resecciones R1) conducen a una supervivencia muy pobre. En el ensayo holandés de cáncer gástrico, el 10 % de los pacientes tuvieron un margen de resección positivo y una supervivencia a 3 años correspondientemente inferior (18 vs. 63 %) en comparación con aquellos que tuvieron un margen de resección negativo. 9 Sin embargo, los márgenes microscópicos parecen afectar la supervivencia a largo plazo solo en aquellos pacientes con metástasis en cinco o menos ganglios linfáticos. Para los cánceres gástricos proximales, muchos cirujanos prefieren una gastrectomía total en lugar de una gastrectomía proximal debido a las secuelas a largo plazo del reflujo ácido sintomático con este último procedimiento.
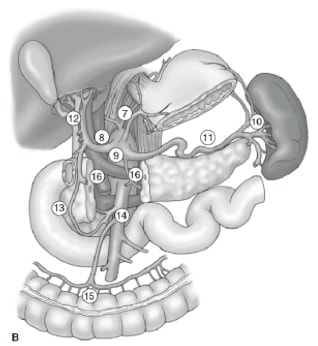
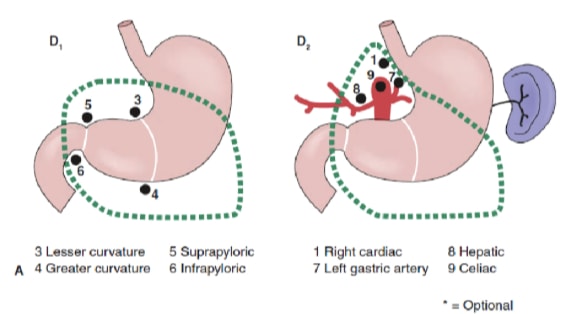
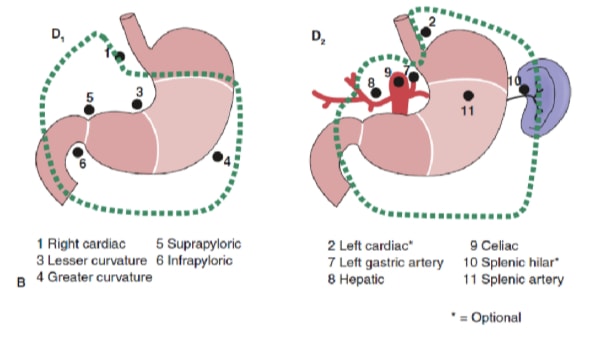
La extensión de la disección de ganglios linfáticos es uno de los temas más controvertidos en el tratamiento del cáncer gástrico. Los informes del Gastric Cancer Registry y otros estudios retrospectivos han hecho que la gastrectomía radical con linfadenectomía extendida (D2) sea el estándar de atención para el tratamiento del cáncer gástrico curable en Japón. 10,11 La Sociedad Japonesa de Investigación del Cáncer Gástrico clasifica las cuencas de los ganglios linfáticos de drenaje del estómago en 16 estaciones, incluidas 6 estaciones perigástricas (Figura 2a) y 10 estaciones regionales a lo largo de los vasos principales y adyacentes al páncreas (Figura 2b). La extensión de la disección de los ganglios linfáticos se indica con la designación D. Una disección D1 incluye solo los ganglios perigástricos (estaciones 1 a 6); una disección D2 incluye los ganglios linfáticos a lo largo de las arterias hepáticas comunes, gástricas izquierdas, celíacas y esplénicas (estaciones 7 a 11); y una disección D3 incluye ganglios adicionales dentro de la porta hepatis y adyacentes a la aorta (estaciones 12 a 16) (Figura 3).
Se han llevado a cabo dos ensayos aleatorizados prospectivos de gran tamaño que compararon los resultados de la disección D1 con los de la disección D2 en pacientes occidentales. En el seguimiento a quince años del mayor de estos dos estudios, a saber, el Dutch Gastric Cancer Group Trial, no se demostró ningún beneficio de supervivencia general a largo plazo con la disección de ganglios linfáticos D2 (29 % frente a 21 %, P = 0,34), pero sí se observó una disminución significativa de la tasa de mortalidad relacionada con el cáncer gástrico (37 % frente a 48 %, P = 0,01) y una tasa de recidiva locorregional más baja que la cirugía D1. 9 Sin embargo, hubo tasas significativamente más altas de morbilidad postoperatoria (43% vs 25%) y mortalidad (10% vs 4%) en aquellos pacientes sometidos a la linfadenectomía D2 más extensa, en gran parte como resultado del mayor número de esplenectomías y pancreatectomías realizadas en este grupo para lograr una disección ganglionar completa. 9 De manera similar, el ensayo British Cooperative realizado por el Medical Research Council informó un aumento de la morbilidad, asociado con altas tasas de esplenectomía y pancreatectomía concomitantes, sin un beneficio en la supervivencia general o libre de recurrencia en aquellos pacientes aleatorizados a una disección D2. 12
A pesar de los hallazgos de estos dos estudios, los investigadores han argumentado que si la tasa de complicaciones después de una disección prolongada de los ganglios linfáticos D2 pudiera disminuir, el beneficio de supervivencia conferido por una disección D2, según lo informado por centros experimentados en Asia, podría traducirse a los pacientes occidentales con cáncer gástrico. 13 Por lo tanto, el Grupo Italiano de Estudio del Cáncer Gástrico llevó a cabo un ensayo de fase III en el que se aleatorizó a los pacientes a una linfadenectomía D2 con preservación del páncreas o a una linfadenectomía D1 en centros de alto volumen por cirujanos que completaron un entrenamiento riguroso en la técnica a través de la observación de cirujanos maestros en Japón. Informaron tasas de morbilidad (17,9 %) y mortalidad (3,0 %) impresionantemente bajas en los pacientes sometidos a la disección D2, en la que se realizó una pancreatectomía o esplenectomía solo para la invasión tumoral directa. 14 Sin embargo, no encontraron diferencias en la supervivencia global a 5 años entre los grupos D1 y D2 (66,5% vs 64,2%; P = 0,695), aunque los análisis de subgrupos indicaron que una linfadenectomía D2 puede ser beneficiosa para los pacientes con tumores T2–T4 o con ganglios linfáticos. 14
Aún no está claro si la disección de ganglios linfáticos D2 es simplemente un procedimiento de estadificación completo o si puede haber un beneficio terapéutico para ciertos subgrupos de pacientes (p. ej., pacientes con enfermedad N2). Cabe señalar que la estadificación precisa de los pacientes con cáncer gástrico, según la séptima edición más reciente del Manual de estadificación del American Joint Committee on Cancer (AJCC), exige la evaluación de al menos 15 ganglios linfáticos. 15 La estadificación ganglionar se basa en el número de ganglios positivos con las categorías N1 (1 a 2 ganglios positivos), N2 (3 a 6 ganglios positivos), N3a (7 a 15 ganglios positivos) y N3b (16+ ganglios positivos). Los estudios han demostrado una correlación entre la mejora de la supervivencia del paciente y un mayor número de ganglios linfáticos examinados en la muestra. 16 Por supuesto, esto puede simplemente reflejar una estadificación más precisa en lugar de un beneficio terapéutico del procedimiento. Sin embargo, hay pruebas indirectas de que las linfadenectomías más extensas producen tasas más bajas de recidiva locorregional, y esto puede traducirse en un beneficio de supervivencia. De hecho, un ensayo aleatorizado realizado en un solo centro en Taiwán identificó una ventaja general de supervivencia a 5 años para los pacientes que se sometieron a una disección D3 (59,5%) en comparación con los que se sometieron a una disección D1 (53,6%). 13
Para los pacientes tratados con MGH durante la última década, hemos informado tasas de morbilidad y mortalidad después de la gastrectomía y la linfadenectomía D2 del 17% y el 0%, respectivamente, y nuestra mediana de rendimiento ganglionar con disección ex vivo de la muestra ha aumentado a 40 ganglios. La mediana de estadía para la gastrectomía total y subtotal en los Estados Unidos es de 9 a 10 días en promedio, aunque muchos pacientes son dados de alta dentro de los 7 días. Las complicaciones a largo plazo de la gastrectomía subtotal y total incluyen deficiencias de vitaminas y minerales, particularmente de vitamina B12, vitamina D, hierro y calcio, y los síndromes clásicos posteriores a la gastrectomía, como la gastritis por reflujo alcalino, el síndrome de evacuación gástrica rápida, el síndrome de estasis de Roux y el síndrome de las extremidades aferentes.
La cirugía es el único tratamiento potencialmente curativo para el cáncer gástrico localizado, sin embargo, incluso para aquellos pacientes en los que es posible una resección R0, solo se logra una supervivencia a 5 años del 35 % al 40 % con quimioterapia perioperatoria o quimiorradioterapia posoperatoria. El progreso futuro en el tratamiento del cáncer gástrico depende del desarrollo de mejores terapias sistémicas, así como de técnicas para un diagnóstico más precoz.
A. RESECCIÓN DISTAL DEL ESTÓMAGO:
Adenocarcinoma gástrico, tipo tubular, expresión de proteínas de reparación de desajustes inestable. (Ver informe sinóptico).
B. BIOPSIA DE GANGLIOS LINFÁTICOS, ESTACIÓN 8:
No hay evidencia de malignidad en cuatro ganglios linfáticos (0/4).
C. BIOPSIA DE GANGLIOS LINFÁTICOS, ESTACIÓN 11:
No hay evidencia de malignidad en dos ganglios linfáticos (0/2).
D. BIOPSIA DE GANGLIOS LINFÁTICOS, ESTACIÓN 7:
No hay evidencia de malignidad en dos ganglios linfáticos (0/2).
E. BIOPSIA DE GANGLIOS LINFÁTICOS, ESTACIÓN 3:
No hay evidencia de neoplasia maligna en un ganglio linfático (0/1).
INFORME SINÓPTICO:
RESUMEN DEL ESTADIO TUMORAL: pT1bN0.
SITIO ESPECÍFICO: Antro gástrico.
TAMAÑO DEL TUMOR (mayor dimensión): 0,3 cm (medido en el portaobjetos).
CLASIFICACIÓN DE LA OMS: Adenocarcinoma tubular.
GRADO HISTOLÓGICO: G1 (Bien diferenciado)
GRADO DE INVASIÓN: pT1b (Tumor invade submucosa).
INVASIÓN DE VASOS PEQUEÑOS (SANGRE/LINFÁTICOS): Ausente.
INVASIÓN DE VASOS GRANDES (VENOSOS): Ausente.
INVASIÓN PERINEURAL: Ausente.
MARGEN GÁSTRICO PROXIMAL: No afectado por carcinoma invasivo.
MARGEN DUODENAL DISTAL: No afectado por carcinoma invasivo. (espacio libre = 0,4 cm).
GANGLIOS LINFÁTICOS REGIONALES: pN0 (sin metástasis en ganglios linfáticos regionales): 31 ganglios linfáticos examinados.
*El total de ganglios linfáticos incluye todas las partes de la muestra. El espécimen principal (espécimen A) contenía 22 ganglios linfáticos.
INMUNOHISTOQUÍMICA HER2: Puntuación HER 2 0/negativa (sin reactividad o tinción membranosa muy tenue en < 10% de las células tumorales).
Estudios adicionales:
MLH1 y PMS perdidos.
MSH2 y MSH6 intactos.
Hallazgos adicionales:
Mucosa antral gástrica con metaplasia intestinal y displasia de alto grado.
Pólipo de la glándula fúndica.
El ARN codificado por el virus de Epstein-Barr (EBER) es negativo.
Nuestro paciente se recuperó bien de la cirugía y fue dado de alta el día 5 del postoperatorio. Su informe anatomopatológico final estadificó su tumor como T1bN0 y los márgenes de resección fueron negativos. Logramos una excelente cosecha ganglionar (31 ganglios linfáticos), por lo que podemos confiar en la precisión de esta asignación de etapas. Como tal, no requiere terapia adyuvante y su pronóstico a largo plazo es excelente.
Un sistema retractor fijo de la pared abdominal puede ser muy útil para esta operación; usamos el Bookwalter, pero otras opciones incluyen los sistemas retractores Thompson y Omni. El duodeno y el estómago se seccionan con grapadoras, en este caso una grapadora Endo-GIA. Un dispositivo de sellado de vasos, como un dispositivo LigaSure o un bisturí armónico, son muy útiles en el control eficiente de los vasos sanguíneos pequeños. Los vasos más grandes, como la arteria gástrica izquierda, pueden dividirse con una grapadora vascular o controlarse mediante una ligadura de sutura tradicional.
Los autores no tienen conflictos que revelar.
El paciente al que se hace referencia en este artículo de video ha dado su consentimiento informado para ser filmado y es consciente de que su información personal de salud se publicará en línea de manera no identificada.
Citations
- Red de Investigación del Atlas del Genoma del Cáncer. Caracterización molecular integral del adenocarcinoma gástrico. Naturaleza. 2014; 513(7517):202-209. doi:10.1038/nature13480.
- Mullen JT. Cáncer gástrico. En: Fischer J, ed. Maestría en Cirugía. 7ª ed. Filadelfia, Pensilvania: Lippincott Williams & Wilkins; 2017.
- Yoon SS, DJ del parque. Adenocarcinoma gástrico. En: Cameron JL, Cameron AM, eds. Current Surgical Therapy. 11ª ed. Filadelfia, PA: Saunders, 2014: 87-95.
- Yun M. Imágenes del metabolismo del cáncer gástrico utilizando 18 F-FDG PET/CT. J Cáncer gástrico. 2014; 14(1):1-6. doi:10.5230/jgc.2014.14.1.1.
- Ikoma N, Blum M, Chiang YJ, et al. Rendimiento de la estadificación de la laparoscopia y la citología de lavado para la carcinomatosis peritoneal radiológicamente oculta del cáncer gástrico. Ann Surg Oncol. 2016; 23(13):4332-4337. doi:10.1245/s10434-016-5409-7.
- Macdonald JS, Smalley SR, Benedetti J, et al. Quimiorradioterapia después de la cirugía comparada con la cirugía sola para el adenocarcinoma de estómago o de la unión gastroesofágica. N Engl J Med. 2001; 345(10):725-730. doi:10.1056/NEJMoa010187.
- Cunningham D, Allum WH, Stenning SP, et al. Quimioterapia perioperatoria versus cirugía sola para el cáncer gastroesofágico resecable. N Engl J Med. 2006; 355(1):11-20. doi:10.1056/NEJMoa055531.
- Bozzetti F, Marubini E, Bonfanti G, Miceli R, Piano C, Gennari L; Grupo Italiano de Estudio de Tumores Gastrointestinales. Gastrectomía subtotal versus total para el cáncer gástrico: tasas de supervivencia a cinco años en un ensayo aleatorizado multicéntrico italiano. Ann Surg. 1999; 230(2):170-178. doi:10.1097/00000658-199908000-00006.
- Bonenkamp JJ, Hermans J, Sasako M, et al; Grupo Holandés de Cáncer Gástrico. Disección ampliada de ganglios linfáticos para el cáncer gástrico. N Engl J Med. 1999; 340(12):908-914. doi:10.1056/NEJM199903253401202.
- Maruyama K, Okabayashi K, Kinoshita T. Progreso de la cirugía gástrica en Japón y sus límites de radicalidad. Mundo J Surg. 1987; 11(4):418-425. doi:10.1007/BF01655804.
- Sasako M, McCulloch P, Kinoshita T, Maruyama K. Nuevo método para evaluar el valor terapéutico de la disección de ganglios linfáticos para el cáncer gástrico. Hno. J Surg. 1995; 82(3):346-351. doi:10.1002/bjs.1800820321.
- Cuschieri A, Weeden S, Fielding J, et al; Grupo Cooperativo Quirúrgico. Supervivencia de los pacientes después de las resecciones D1 y D2 para el cáncer gástrico: resultados a largo plazo del ensayo quirúrgico aleatorizado del MRC. Hno. J Cáncer. 1999; 79(9-10):1522-1530. doi:10.1038/sj.bjc.6690243..
- Wu CW, Hsiung CA, Lo SS, et al. Disección ganglionar para pacientes con cáncer gástrico: un ensayo controlado aleatorizado. Lancet Oncol. 2006; 7(4):309-315. doi:10.1016/S1470-2045(06)70623-4.
- Degiuli M, Sasako M, Ponti A; Grupo Italiano de Estudio del Cáncer Gástrico. Morbilidad y mortalidad en el ensayo clínico aleatorizado del Grupo Italiano de Estudio del Cáncer Gástrico de la resección D1 versus D2 para el cáncer gástrico. Hno. J Surg. 2010; 97(5):643-649. doi:10.1002/bjs.6936.
- Edge SB, Byrd DR, Compton CC, Fritz AG, Greene F, Trotti A, eds. Manual de estadificación del cáncer del AJCC. 7ª ed. Nueva York, NY: Springer; 2010.
- Smith DD, Schwarz RR, Schwarz RE. Impacto del recuento total de ganglios linfáticos en la estadificación y la supervivencia después de la gastrectomía por cáncer gástrico: datos de una gran base de datos de población de EE. UU. J Clin Oncol. 2005; 23(28):7114-7124. doi:10.1200/JCO.2005.14.621.
Cite this article
Merrill AL, Mullen JT. Gastrectomía distal abierta. J Med Insight. 2024; 2024(191). doi:10.24296/jomi/191.


.jpg&w=3840&q=75)
.jpg&w=3840&q=75)