Offene distale Gastrektomie
Main Text
Table of Contents
Eine vollständige randnegative (R0) Resektion bleibt die einzige potenziell heilende Behandlung für das Adenokarzinom des Magens. Die Wahl der Operation hängt von der Lage des Tumors sowie dem Krankheitsstadium ab. Dieser Patient stellte sich mit symptomatischer Anämie vor, und die Aufarbeitung zeigte eine Gastritis und einen kleinen Tumor im distalen Magen. Biopsien bestätigten ein Adenokarzinom, und ein endoskopischer Ultraschall (EUS) stufte diesen Tumor als T2 N0 ein. Staging-Scans zeigten keine Hinweise auf eine fernmetastasierende Erkrankung. Da dieser Patient einen relativ frühen Tumor hatte, entschieden wir uns für eine Voraboperation, die in diesem Fall eine distale Gastrektomie beinhaltete. Dieses Video zeigt die Technik eines erfahrenen Magenchirurgen zur Durchführung einer offenen distalen Gastrektomie mit einer "verlängerten" D1-Lymphknotendissektion.
Obwohl die Inzidenz von Magenkrebs in den Vereinigten Staaten in den letzten Jahrzehnten dramatisch zurückgegangen ist, bleibt Magenkrebs eine wichtige Ursache für krebsbedingte Todesfälle. Trotz signifikanter Verbesserungen bei den Staging-Modalitäten, der chirurgischen Therapie und der perioperativen Versorgung bleibt die Prognose der meisten Patienten mit Magenkrebs schlecht. Dies ist weitgehend auf die aggressive Biologie dieses Krebses sowie auf das fortgeschrittene Krankheitsstadium zurückzuführen, in dem sich die meisten Patienten dem Arzt vorstellen. Zu den Risikofaktoren gehören eine Infektion mit Helicobacter pylori und dem Epstein-Barr-Virus (EBV), perniziöse Anämie, vorherige Magenresektion, Rauchen und eine hohe Salzaufnahme. Ungefähr 10 % der Magenkrebserkrankungen sind auf erbliche Krebssyndrome zurückzuführen, einschließlich des hereditären diffusen Magenkrebses (HDGC), der durch Keimbahnmutationen im E-Cadherin (CDH1)-Gen gekennzeichnet ist, und des hereditären Nonpolyposis-Darmkrebssyndroms (HNPCC), das durch Keimbahnmutationen in DNA-Mismatch-Reparaturgenen gekennzeichnet ist. Kürzlich hat eine umfassende molekulare Bewertung von Magenkrebs zu einem Klassifikationsschema geführt, das 4 wichtige genomische Subtypen und ihre ungefähre Häufigkeit definiert: EBV-infizierte Tumoren (9 %), mikrosatelliteninstabile (MSI-hohe) Tumoren (22 %), genomisch stabile Tumoren (20 %) und chromosomal instabile Tumoren (50 %). 1
Es gibt nur wenige, wenn überhaupt, klassische Symptome, die auf eine Diagnose von Magenkrebs hindeuten, was erklärt, warum dieser Krebs häufig in einem fortgeschrittenen Stadium diagnostiziert wird. Frühe Symptome wie Magenschmerzen, Dyspepsie und saurer Reflux sind so unspezifisch, dass die meisten Patienten ohne weitere Untersuchung einfach empirisch mit Antazida behandelt werden. Mit fortschreitender Krankheit werden die Symptome deutlicher und bedrohlicher und umfassen Beschwerden wie Dysphagie, Übelkeit, Erbrechen, frühes Sättigungsgefühl, Anorexie, Müdigkeit und Gewichtsverlust. Die Lokalisation und der histologische Typ des Magenkrebses bestimmen oft den Symptomkomplex, von Dysphagie bei proximalen Tumoren über Erbrechen zur Obstruktion distaler Tumoren bis hin zu frühem Sättigungsgefühl und Gewichtsverlust bei diffusen Tumoren (Linitis plastica). 2,3
Dieser Patient ist ein 84-jähriger Herr mit einer Vorgeschichte von Gastritis und einer chronischen Striktur des gastroösophagealen Übergangs, der sich mit Symptomen von Müdigkeit und Kurzatmigkeit bei seinem Hausarzt vorstellte. Ein vollständiges Blutbild wurde erstellt und zeigte, dass der Patient anämisch war. Er leugnete Bauchschmerzen, Übelkeit, Erbrechen, veränderte Stuhlgewohnheiten, Schwierigkeiten beim Essen oder Gewichtsverlust.
Die körperliche Untersuchung eines Patienten mit Magenkrebs ist in der Regel unauffällig, vielleicht mit Ausnahme von epigastrischer Bauchspannen und, weniger wahrscheinlich, einer tastbaren epigastrischen Masse. Klassische namensgebende körperliche Befunde wie der Virchow-Knoten, der periumbilikale Knoten von Schwester Mary Joseph und das Blumer-Regal sind selten vorhanden, deuten aber auf eine fortgeschrittene metastasierende Erkrankung hin. In ähnlicher Weise bedeutet das Vorhandensein von Kachexie, Gelbsucht, Aszites und Hepatomegalie bei einem Magenkrebspatienten typischerweise eine unheilbare metastasierende Erkrankung. Unser Patient sah gut aus, und bei der Untersuchung hatte er einen weichen Bauch und keine tastbaren Massen.
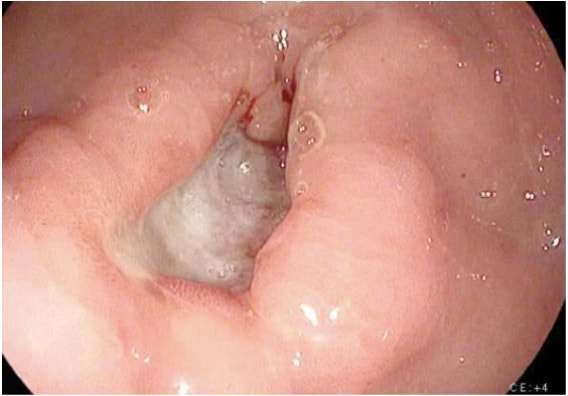
Die Bildgebung zur Abklärung von Magenkrebs umfasst eine Vielzahl von Studien. Die Diagnose Magenkrebs lässt sich in der Regel durch Endoskopie mit Biopsie stellen (Abb. 1). Die Endoskopie definiert die Lage und Ausdehnung des Tumors im Magen und ermöglicht in Kombination mit endoskopischem Ultraschall (EUS) eine genaue Abschätzung der Tiefe der Tumorinvasion (T-Stadium). EUS ist die empfindlichste Modalität bei der Bestimmung des T-Stadiums eines Magenkrebses, und EUS ermöglicht eine Beurteilung der regionalen Lymphknoten und eine Nadelbiopsie von verdächtigen Knoten, um eine Knotenbeteiligung (N-Stadium) zu bestätigen. Ein CT-Scan des Brustkorbs, des Bauches und des Beckens sollte durchgeführt werden, um eine Fernmetastasierung zu untersuchen, z. B. auf Lunge, Leber, Bauchfell oder Lymphknoten außerhalb des Resektionsfeldes. Darüber hinaus ist ein CT-Scan empfindlich bei der Erkennung selbst kleiner Mengen von Aszites, die eine Ausbreitung des Peritonealtumors darstellen können und die mit bildgesteuerten Mitteln für die zytologische Untersuchung entnommen werden können. Obwohl PET- und PET-CT-Scans beim präoperativen Staging von Magenkrebs nicht routinemäßig empfohlen werden, können sie sicherlich zusätzliche nützliche Informationen liefern. Die PET hat eine geringe Sensitivität bei der Erkennung des Primärtumors, insbesondere bei Magenkrebs im Frühstadium und beim diffusen Typ, aber die PET hat eine höhere Spezifität als die CT (90% vs. 60%) bei der Erkennung regionaler Lymphknotenmetastasen und eine angemessene Sensitivität für die Erkennung von Leber-, Lungen- und Fernlymphknotenmetastasen. 4 Darüber hinaus kann die PET zur Überwachung des Tumoransprechens auf eine neoadjuvante Chemotherapie verwendet werden, da sie das Ansprechen auf die Therapie in einem frühen Stadium genau erkennt und es dem Arzt so ermöglicht, die Patienten mit einem möglichst aktiven Chemotherapieschema aufrechtzuerhalten.
Patienten mit lokoregional fortgeschrittenen Krebserkrankungen (T3+/N+) werden für ein zusätzliches Staging durch Laparoskopie in Betracht gezogen. Die Staging-Laparoskopie kann unmittelbar vor der geplanten Laparotomie oder als Vorbehandlungsverfahren bei Patienten durchgeführt werden, die eine präoperative Therapie in Betracht ziehen. Die Staging-Laparoskopie überlagert mehr als 30 % der Patienten durch die Identifizierung röntgenologisch okkulter Peritoneal- und Lebermetastasen und eine positive Zytologie. 5
Magenkrebs breitet sich typischerweise über die Lymphknoten oder hämatogen aus und metastasiert häufig in Leber, Lunge oder Bauchfell. Es kann sich auch direkt ausbreiten, um benachbarte Organe wie die Bauchspeicheldrüse und den Querdarm zu betreffen. Die einzige mögliche kurative Therapie für Magenkrebs ist eine Operation. Selbst bei kompletter, randnegativer Resektion und (neo)adjuvanter Therapie bleibt die 5-Jahres-Überlebensrate mit ~40% niedrig.
Das häufigste Behandlungsparadigma für Magenkrebs in den Vereinigten Staaten war in der Vergangenheit die Voraboperation, gefolgt von einer adjuvanten Radiochemotherapie (wie in der Intergroup 0116-Studie beschrieben) für Patienten mit Hochrisikotumoren (T3/4, knotenpositiv, schlecht kohäsiver Typ). 6 Allerdings konnten nur 64 % der Patienten in dieser Studie die postoperative Radiochemotherapie wie geplant erhalten, und so viele bevorzugen eine perioperative Chemotherapie für solche Patienten, wie in der vom British Medical Research Council durchgeführten MAGIC-Studie beschrieben. In dieser Studie wurden die Patienten randomisiert und erhielten entweder eine perioperative Chemotherapie (drei Zyklen Epirubicin, Cisplatin und 5-Fluorouracil (ECF) präoperativ und postoperativ) oder eine Operation oder eine Operation allein. Die Fünf-Jahres-Überlebensraten waren in der perioperativen Chemotherapie-Gruppe im Vergleich zur Gruppe mit chirurgischer Einzeloperation überlegen (36 % vs. 23 %). 7 Obwohl nur ~ 40% der Patienten die gesamte empfohlene Therapie mit diesem Behandlungsansatz abschließen, erhalten mehr als 85% der Patienten alle 3 geplanten Zyklen der präoperativen Chemotherapie und alle Patienten erhalten mindestens einen Zyklus der Chemotherapie. Die Verabreichung von mindestens einigen Zyklen systemischer Therapie vor der Operation bei Patienten mit Hochrisikotumoren bringt mehrere Vorteile mit sich: (1) es ermöglicht eine frühzeitige Behandlung möglicher mikrometastasierender Erkrankungen; (2) man kann das Ansprechen des Tumors in vivo auf die Therapie überwachen, z. B. mit PET-CT-Scan-Bildgebung; und (3) man kann diejenigen Patienten mit besonders schlechter Tumorbiologie auswählen, die eine frühe metastasierende Erkrankung entwickeln und daher keinen Überlebensvorteil aus der Gastrektomie ziehen würden. 7
Eine vollständige randnegative (R0) Resektion bleibt die einzige potenziell heilende Behandlung für das Adenokarzinom des Magens. Die Wahl der Operation hängt von der Lage des Tumors sowie dem Krankheitsstadium ab. Oberflächlich invasiver (T1a) Magenkrebs mit günstigem histologischem Grad kann durch endoskopische Schleimhautresektion oder Keilexzision mit oder ohne begleitende Sentinel-Lymphknotenbiopsie behandelt werden. Solche Verfahren wurden von unseren chirurgischen Kollegen aus Japan ausführlich beschrieben, wo Magenkrebs aufgrund der Prävalenz endoskopischer Screening-Untersuchungen in diesem Land häufig in einem frühen Stadium diagnostiziert wird. Da die Mehrheit der Patienten in den Vereinigten Staaten symptomatische, lokoregional fortgeschrittene Tumoren aufweist, ist die primäre chirurgische Frage, welches Verfahren die größten Heilungschancen bei akzeptabler Morbidität und Mortalität bietet. Viele Patienten sind keine Kandidaten für einen chirurgischen Eingriff, entweder weil sie medizinisch ungeeignet sind oder weil bei präoperativen Bildgebungsstudien oder zum Zeitpunkt der Laparoskopie eine metastasierende Erkrankung vorliegt. Für Patienten, die für eine Magenresektion in Frage kommen, umfassen die Optionen eine totale, proximale und distale Gastrektomie. Es gibt weltweit eine zunehmende Erfahrung mit der laparoskopischen Durchführung dieser Eingriffe, mit verbesserten kurzfristigen Ergebnissen und Knotenausbeuten sowie Überlebensergebnissen, die den traditionellen offenen Verfahren entsprechen. Die überwiegende Mehrheit der Resektionen bei Magenkrebs in den Vereinigten Staaten wird jedoch immer noch über den offenen Ansatz durchgeführt.
Zu den Patienten, die für eine sofortige chirurgische Resektion in Betracht gezogen werden sollten, gehören Patienten mit Magenkrebs im Frühstadium (T1/T2 N0) und Patienten, die eine sofortige Linderung von Blutungen oder hochgradigen tumorassoziierten luminalen Obstruktionen benötigen. Die perioperativen Morbiditäts- und Mortalitätsraten in dieser letztgenannten Patientenpopulation sind jedoch signifikant und müssen sorgfältig gegen den wahrscheinlichen Nutzen der Resektion abgewogen werden. Patienten mit lokoregional fortgeschrittenem Magenkrebs sind gute Kandidaten für eine präoperative Chemotherapie oder Radiochemotherapie.
Da dieser Patient einen relativ frühen Tumor (uT2N0) hatte und für sein Alter bemerkenswert gesund war, wurde ihm eine Voraboperation mit einer distalen Gastrektomie angeboten. Wir waren der Meinung, dass eine offene distale Gastrektomie das Risiko einer Überbehandlung mit neoadjuvanter Chemotherapie für einen potenziell risikoarmen Krebs begrenzte, während wir ihm die Möglichkeit ließen, ihm eine adjuvante Therapie anzubieten, wenn der endgültige pathologische Bericht einen fortgeschritteneren Krebs (z. B. T3+/N+) ergab.
Das Ausmaß der Magenresektion wird durch die Lage und Ausdehnung des Primärtumors bestimmt. Prospektive, randomisierte Studien konnten bei Patienten mit Tumoren des distalen Magens keinen Überlebensvorteil für die totale Gastrektomie gegenüber der distalen, subtotalen Gastrektomie nachweisen. 8 Daher sollte bei Patienten, bei denen ein Rand von 5 bis 6 cm vom Tumor erhalten werden kann, während immer noch ein angemessen großer Magenrest erhalten bleibt, eine konservativere Magenresektion durchgeführt werden, da dies eine gleichwertige Überlebensrate mit geringerer Morbidität und einer besseren Lebensqualität als eine vollständige Gastrektomie bietet. 8 Dennoch sollte bei Bedarf eine totale Gastrektomie durchgeführt werden, um eine R0-Resektion zu erreichen, da positive Resektionsränder (R1-Resektionen) zu einem sehr schlechten Überleben führen. In der niederländischen Magenkrebsstudie hatten 10 % der Patienten einen positiven Resektionsrand und ein entsprechend schlechteres 3-Jahres-Überleben (18 % vs. 63 %) im Vergleich zu denjenigen, die einen negativen Resektionsrand hatten. 9 Mikroskopisch beteiligte Ränder scheinen das Langzeitüberleben jedoch nur bei Patienten mit fünf oder weniger Lymphknotenmetastasen zu beeinflussen. Bei proximalem Magenkrebs bevorzugen viele Chirurgen eine totale Gastrektomie gegenüber einer proximalen Gastrektomie, da bei letzterem Verfahren langfristige Folgen eines symptomatischen sauren Refluxes auftreten.
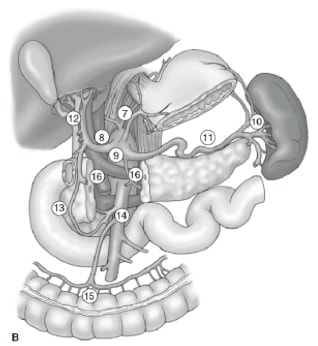
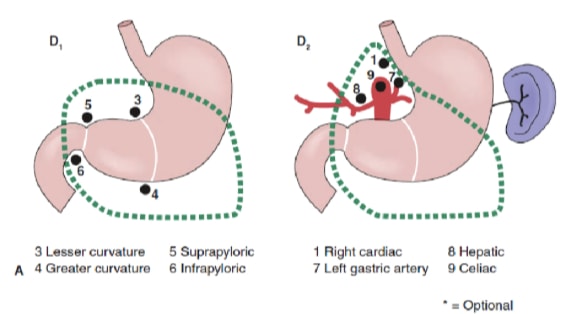
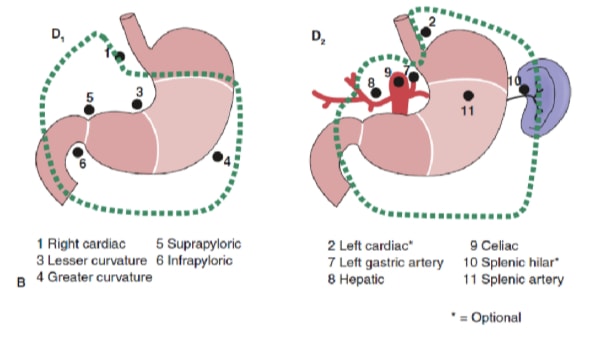
Das Ausmaß der Lymphknotendissektion ist eines der umstrittensten Themen bei der Behandlung von Magenkrebs. Berichte aus dem Magenkrebsregister und andere retrospektive Studien haben die radikale Gastrektomie mit erweiterter (D2) Lymphadenektomie zum Behandlungsstandard für die Behandlung von heilbarem Magenkrebs in Japan gemacht. 10,11 Die japanische Forschungsgesellschaft für Magenkrebs kategorisiert die drainierenden Lymphknotenbecken des Magens in 16 Stationen, darunter 6 perigastrische Stationen (Abbildung 2a) und 10 regionale Stationen entlang der großen Gefäße und neben der Bauchspeicheldrüse (Abbildung 2b). Das Ausmaß der Lymphknotendissektion wird durch die Bezeichnung D angegeben. Eine D1-Dissektion umfasst nur die perigastrischen Knoten (Stationen 1 bis 6); eine D2-Dissektion umfasst die Lymphknoten entlang der Arteria brepatic, linker Magen, Zöliakie und Milz (Stationen 7 bis 11); und eine D3-Dissektion umfasst zusätzliche Knoten innerhalb der Porta hepatis und neben der Aorta (Stationen 12 bis 16) (Abbildung 3).
Zwei große, prospektive randomisierte Studien, in denen die Ergebnisse der D1-Dissektion mit denen der D2-Dissektion verglichen wurden, wurden an westlichen Patienten durchgeführt. Die fünfzehnjährige Nachbeobachtung der größeren dieser beiden Studien, nämlich der Dutch Gastric Cancer Group Trial, zeigte keinen langfristigen Gesamtüberlebensvorteil mit der D2-Lymphknotendissektion (29 % vs. 21 %, P = 0,34), zeigte jedoch eine signifikant verringerte magenkrebsbedingte Sterblichkeitsrate (37 % vs. 48 %, P = 0,01) und eine niedrigere lokoregionäre Rezidivrate als eine D1-Operation. 9 Es gab jedoch signifikant höhere postoperative Morbiditätsraten (43 % vs. 25 %) und Mortalität (10 % vs. 4 %) bei Patienten, die sich der umfangreicheren D2-Lymphadenektomie unterzogen, was zum großen Teil auf die größere Anzahl von Splenektomien und Pankreatektomien zurückzuführen ist, die in dieser Gruppe durchgeführt wurden, um eine vollständige Knotendissektion zu erreichen. 9 In ähnlicher Weise berichtete die vom Medical Research Council durchgeführte British Cooperative Trial über eine erhöhte Morbidität, die mit hohen Raten von gleichzeitiger Splenektomie und Pankreatektomie einherging, ohne einen Nutzen für das Gesamt- oder rezidivfreie Überleben bei den Patienten, die auf eine D2-Dissektion randomisiert wurden. 12
Trotz der Ergebnisse dieser beiden Studien haben die Forscher argumentiert, dass, wenn die Komplikationsrate nach einer ausgedehnten D2-Lymphknotendissektion verringert werden könnte, der Überlebensvorteil einer D2-Dissektion, wie von erfahrenen Zentren in Asien berichtet, auf westliche Patienten mit Magenkrebs übertragen werden könnte. 13 So führte die italienische Magenkrebs-Studiengruppe eine Phase-III-Studie durch, in der Patienten entweder einer pankreaserhaltenden D2-Lymphadenektomie oder einer D1-Lymphadenektomie in Zentren mit hohem Volumen von Chirurgen zugeführt wurden, die eine strenge Ausbildung in dieser Technik durch Beobachtung von Meisterchirurgen in Japan absolvierten. Sie berichteten über beeindruckend niedrige Morbiditäts- (17,9 %) und Mortalitätsraten (3,0 %) bei Patienten, die sich der D2-Dissektion unterzogen, bei der eine Pankreatektomie oder Splenektomie nur für eine direkte Tumorinvasion durchgeführt wurde. 14 Sie fanden jedoch keinen Unterschied im 5-Jahres-Gesamtüberleben zwischen den Gruppen D1 und D2 (66,5 % vs. 64,2 %; P = 0,695), obwohl Subgruppenanalysen darauf hindeuteten, dass eine D2-Lymphadenektomie für Patienten mit T2-T4- und/oder nodal-positiven Tumoren von Vorteil sein könnte. 14
Es bleibt unklar, ob eine D2-Lymphknotendissektion einfach ein gründliches Staging-Verfahren ist oder ob es für bestimmte Untergruppen von Patienten (z. B. Patienten mit N2-Krankheit) einen therapeutischen Nutzen geben kann. Es sollte beachtet werden, dass das genaue Staging von Patienten mit Magenkrebs gemäß der neuesten siebten Ausgabe des American Joint Committee on Cancer (AJCC) Staging Manual die Bewertung von mindestens 15 Lymphknoten erfordert. 15 Das Knoten-Staging basiert dann auf der Anzahl der positiven Knoten mit den Kategorien N1 (1 bis 2 positive Knoten), N2 (3 bis 6 positive Knoten), N3a (7 bis 15 positive Knoten) und N3b (16+ positive Knoten). Studien haben einen Zusammenhang zwischen einem verbesserten Überleben der Patienten und einer größeren Anzahl von Lymphknoten gezeigt, die in der Probe untersucht wurden. 16 Natürlich kann dies einfach eine genauere Inszenierung im Gegensatz zu einem therapeutischen Nutzen des Verfahrens widerspiegeln. Es gibt jedoch indirekte Hinweise darauf, dass umfangreichere Lymphadenektomien zu niedrigeren lokoregionären Rezidivraten führen, was sich in einem Überlebensvorteil niederschlagen kann. Tatsächlich ergab eine randomisierte Studie, die an einem einzigen Zentrum in Taiwan durchgeführt wurde, einen 5-Jahres-Überlebensvorteil für Patienten, die sich einer D3-Dissektion unterziehen (59,5 %) im Vergleich zu Patienten, die sich einer D1-Dissektion unterziehen (53,6 %). 13
Für Patienten, die in den letzten zehn Jahren im MGH behandelt wurden, haben wir Morbiditäts- und Mortalitätsraten nach Gastrektomie und D2-Lymphadenektomie von 17 % bzw. 0 % gemeldet, und unsere mediane Lymphknotenausbeute mit Ex-vivo-Dissektion der Probe ist auf 40 Knoten gestiegen. Die mittlere Aufenthaltsdauer für die subtotale und totale Gastrektomie in den Vereinigten Staaten beträgt durchschnittlich 9–10 Tage, obwohl viele Patienten innerhalb von 7 Tagen entlassen werden. Zu den Langzeitkomplikationen der subtotalen und totalen Gastrektomie gehören Vitamin- und Mineralstoffmangel, insbesondere von Vitamin B12, Vitamin D, Eisen und Kalzium, sowie die klassischen Postgastrektomiesyndrome wie alkalische Refluxgastritis, Dumping-Syndrom, Roux-Stasis-Syndrom und afferentes Extremitätensyndrom.
Die Operation ist die einzige potenziell kurative Therapie für lokalisierten Magenkrebs, aber selbst bei Patienten, bei denen eine R0-Resektion möglich ist, wird mit perioperativer Chemotherapie oder postoperativer Radiochemotherapie nur ein 5-Jahres-Überleben von 35 % bis 40 % erreicht. Zukünftige Fortschritte in der Behandlung von Magenkrebs hängen von der Entwicklung besserer systemischer Therapien sowie Techniken für eine frühere Diagnose ab.
A. DISTALE MAGENRESEKTION:
Magenadenokarzinom, tubulärer Typ, Mismatch-Reparaturproteinexpression instabil. (Siehe zusammenfassender Bericht).
B. LYMPHKNOTENBIOPSIE, STATION 8:
Es gibt keine Hinweise auf eine Malignität in vier Lymphknoten (0/4).
C. LYMPHKNOTENBIOPSIE, STATION 11:
Es gibt keine Hinweise auf eine Malignität in zwei Lymphknoten (0/2).
D. LYMPHKNOTENBIOPSIE, STATION 7:
Es gibt keine Hinweise auf eine Malignität in zwei Lymphknoten (0/2).
E. LYMPHKNOTENBIOPSIE, STATION 3:
Es gibt keine Hinweise auf eine Malignität in einem Lymphknoten (0/1).
SYNOPTISCHER BERICHT:
ZUSAMMENFASSUNG DES TUMORSTADIUMS: pT1bN0.
SPEZIFISCHE STELLE: Magenantrum.
TUMOR GRÖSSE (Größte Dimension): 0,3 cm (gemessen auf dem Objektträger).
WHO-KLASSIFIKATION: Tubuläres Adenokarzinom.
HISTOLOGISCHER GRAD: G1 (gut differenziert)
AUSMASS DER INVASION: pT1b (Tumor dringt in die Submukosa ein).
INVASION KLEINER GEFÄSSE (BLUT/LYMPHE): Nicht vorhanden.
INVASION GROSSER GEFÄSSE (VENÖS): Nicht vorhanden.
PERINEURALE INVASION: Abwesend.
PROXIMALER MAGENRAND: Nicht betroffen von invasivem Karzinom.
DISTALER ZWÖLFFINGERDARMRAND: Unbeteiligt an invasivem Karzinom. (Durchfahrtshöhe = 0,4 cm).
REGIONALE LYMPHKNOTEN: pN0 (keine regionalen Lymphknotenmetastasen): 31 untersuchte Lymphknoten.
*Die Lymphknotensumme umfasst alle Probenteile. Die Hauptprobe (Probe A) enthielt 22 Lymphknoten.
HER2-IMMUNHISTOCHEMIE: Her 2 Score 0/negativ (Keine Reaktivität oder sehr schwache membranöse Färbung bei < 10% der Tumorzellen).
Zusätzliche Studien:
MLH1 und PMS verloren.
MSH2 und MSH6 intakt.
Weitere Ergebnisse:
Magenantralschleimhaut mit Darmmetaplasie und hochgradiger Dysplasie.
Fundischer Drüsenpolyp.
Die Epstein-Barr-Virus-kodierte RNA (EBER) ist negativ.
Unser Patient erholte sich gut von der Operation und wurde am 5. postoperativen Tag entlassen. Sein abschließender pathologischer Bericht stufte seinen Tumor als T1bN0 ein, und die Resektionsränder waren negativ. Wir haben eine hervorragende Knotenernte (31 Lymphknoten) erzielt, so dass wir uns auf die Genauigkeit dieser Phasenzuordnung verlassen können. Daher benötigt er keine adjuvante Therapie und seine Langzeitprognose ist ausgezeichnet.
Ein feststehendes Bauchwand-Retraktorsystem kann für diese Operation sehr hilfreich sein; Wir haben den Bookwalter verwendet, aber andere Optionen sind die Thompson- und Omni-Retraktorsysteme. Der Zwölffingerdarm und der Magen werden mit Staplern durchtrennt – in diesem Fall einem Endo-GIA-Stapler. Ein Gefäßverschließgerät, wie z. B. ein LigaSure-Gerät oder ein Harmonic-Skalpell, ist sehr hilfreich bei der effizienten Kontrolle kleiner Blutgefäße. Größere Gefäße, wie z. B. die linke Magenarterie, können mit einem Gefäßstapler geteilt oder durch traditionelle Nahtligatur kontrolliert werden.
Die Autoren haben keine Konflikte offenzulegen.
Der Patient, auf den sich dieser Videoartikel bezieht, hat seine informierte Zustimmung gegeben, gefilmt zu werden, und ist sich bewusst, dass seine persönlichen Gesundheitsdaten auf nicht identifizierte Weise online veröffentlicht werden.
References
- Krebsgenomatlas-Forschungsnetzwerk. Umfassende molekulare Charakterisierung des Adenokarzinoms des Magens. Natur. 2014; 513(7517):202-209. doi:10.1038/nature13480.
- Mullen JT. Magenkrebs. In: Fischer J, Hrsg. Beherrschung der Chirurgie. 7. Aufl. Philadelphia, PA: Lippincott Williams & Wilkins; 2017.
- Yoon SS, Park-DJ. Magen-Adenokarzinom. In: Cameron JL, Cameron AM, Hrsg. Aktuelle chirurgische Therapie. 11. Aufl. Philadelphia, PA: Saunders, 2014:87-95.
- Yun M. Bildgebung des Magenkrebsstoffwechsels mit 18 F-FDG PET/CT. J Magenkrebs. 2014; 14(1):1-6. doi:10.5230/jgc.2014.14.1.1.
- Ikoma N, Blum M, Chiang YJ, et al. Ausbeute der Staging-Laparoskopie und Lavage-Zytologie bei radiologisch okkulter Peritonealkarzinomatose von Magenkrebs. Ann Surg Oncol. 2016; 23(13):4332-4337. doi:10.1245/s10434-016-5409-7.
- Macdonald JS, Smalley SR, Benedetti J, et al. Radiochemotherapie nach der Operation im Vergleich zur alleinigen Operation bei Adenokarzinom des Magens oder des gastroösophagealen Übergangs. N Engl J Med. 2001; 345(10):725-730. doi:10.1056/NEJMoa010187.
- Cunningham D, Allum WH, Stenning SP et al. Perioperative Chemotherapie im Vergleich zur alleinigen Operation bei resezierbarem gastroösophagealem Krebs. N Engl J Med. 2006; 355(1):11-20. doi:10.1056/NEJMoa055531.
- Bozzetti F, Marubini E, Bonfanti G, Miceli R, Klavier C, Gennari L; Italienische Studiengruppe für gastrointestinale Tumore. Zwischensumme versus Gesamtgastrektomie bei Magenkrebs: Fünf-Jahres-Überlebensraten in einer multizentrischen randomisierten italienischen Studie. Ann Surg. 1999; 230(2):170-178. doi:10.1097/00000658-199908000-00006.
- Bonenkamp JJ, Hermans J, Sasako M, et al; Niederländische Magenkrebsgruppe. Erweiterte Lymphknotendissektion bei Magenkrebs. N Engl J Med. 1999; 340(12):908-914. doi:10.1056/NEJM199903253401202.
- Maruyama K, Okabayashi K, Kinoshita T. Fortschritte in der Magenchirurgie in Japan und ihre Grenzen der Radikalität. Welt J Surg. 1987; 11(4):418-425. doi:10.1007/BF01655804.
- Sasako M, McCulloch P, Kinoshita T, Maruyama K. Neue Methode zur Bewertung des therapeutischen Wertes der Lymphknotendissektion bei Magenkrebs. Br J Surg. 1995; 82(3):346-351. doi:10.1002/bjs.1800820321.
- Cuschieri A, Weeden S, Fielding J, et al; Chirurgische Genossenschaftsgruppe. Patientenüberleben nach D1- und D 2-Resektionen bei Magenkrebs: Langzeitergebnisse der randomisierten chirurgischen MRC-Studie. Br J Krebs. 1999; 79(9-10):1522-1530. doi:10.1038/sj.bjc.6690243..
- Wu CW, Hsiung CA, Lo SS et al. Knotendissektion für Patienten mit Magenkrebs: eine randomisierte Kontrollstudie. Lancet Oncol. 2006; 7(4):309-315. doi:10.1016/S1470-2045(06)70623-4.
- Degiuli M, Sasako M, Ponti A; Italienische Magenkrebs-Studiengruppe. Morbidität und Mortalität in der randomisierten klinischen Studie der italienischen Magenkrebs-Studiengruppe zur Resektion D1 versus D2 bei Magenkrebs. Br J Surg. 2010; 97(5):643-649. doi:10.1002/bjs.6936.
- Edge SB, Byrd DR, Compton CC, Fritz AG, Greene F, Trotti A, Hrsg. AJCC Cancer Staging Handbook. 7. Auflage. New York, NY: Springer; 2010.
- Smith DD, Schwarz RR, Schwarz RE. Einfluss der Gesamtzahl der Lymphknoten auf das Staging und das Überleben nach Gastrektomie bei Magenkrebs: Daten aus einer großen US-Bevölkerungsdatenbank. J Clin Oncol. 2005; 23(28):7114-7124. doi:10.1200/JCO.2005.14.621.
Cite this article
Merrill AL, Mullen JT. Offene distale Gastrektomie. J Med Einblick. 2024; 2024(191). doi:10.24296/jomi/191.


.jpg&w=3840&q=75)
.jpg&w=3840&q=75)