Kombinierte Thymektomie und Lungenkeilresektion des rechten Unterlappens durch Thorakoskopie
Main Text
Table of Contents
Mit dem zunehmenden Einsatz der Computertomographie (CT) für das Screening und die diagnostische Abklärung werden immer mehr Patienten mit Lungenknoten festgestellt. Der Patient stellte sich in diesem Fall mit Sehstörungen, Nackenschwäche und Dysphagie vor. Die Aufarbeitung ergab eine nicht-thymomatöse Myasthenia gravis sowie einen zufälligen Lungenknoten im rechten Unterlappen, der aufgrund von Bildgebungsmerkmalen, Intervallwachstum und Brustkrebs in der Vorgeschichte auf Malignität verdächtig war. Sie benötigte eine Lungenresektion zu diagnostischen und therapeutischen Zwecken. Zusätzlich war eine Thymektomie indiziert, um ihre Myasthenia gravis-Symptome zu kontrollieren. Folglich wurde ein kombinierter Ansatz verfolgt.
Myasthenia gravis (MG) ist eine Autoimmunerkrankung, bei der Autoantikörper, die gegen Komponenten in der postsynaptischen Membran der neuromuskulären Verbindung (Acetylcholinrezeptoren oder Rezeptor-assoziierte Proteine) gerichtet sind, zu einer ermüdenden Schwäche der Augen-, Bulbus-, Gliedmaßen- oder Atemmuskulatur führen. Die meisten Patienten haben nachweisbare Antikörper gegen den Acetylcholinrezeptor oder den muskelspezifischen Tyrosinkinase-Rezeptor.
Patienten mit MG weisen eine schwankende Skelettmuskelschwäche auf, die sich später am Tag oder nach dem Training verschlimmert. Ptosis und/oder Diplopie ist das Erstbild bei 50% der Patienten. Ein kleinerer Teil der Patienten zeigt bulbäre Symptome wie Dysarthrie, Dysphagie und ermüdbares Kauen und seltener eine Schwäche der proximalen Gliedmaßen. Wenn eine Atemmuskelschwäche zu Atemversagen führt, wird dies als "myasthenische Krise" bezeichnet und ist eine lebensbedrohliche Situation. Eine myasthenische Krise kann durch viele Faktoren ausgelöst werden, darunter Medikamente, Operationen oder Entzündungen/Infektionen.
Dies ist eine 69-jährige Frau mit einer Vorgeschichte von Myasthenia gravis, Bluthochdruck, Diabetes, linkem Brustkrebs, der mit Lumpektomie, adjuvanter Bestrahlung und Hormontherapie behandelt wurde und sich mit einem gespickten Lungenknoten im rechten Unterlappen vorstellte. Der Patient begann etwa 1 Jahr vor der Vorstellung Myasthenie-Symptome zu haben. Sie hatte Diplopie, hängenden Kopf, unsicheren Gang und Dysphagie.
Bei der Untersuchung zeigen die Patienten schwache Augenbewegungen mit intakter Pupillenfunktion. Sie können aufgrund der Beteiligung der Gesichtsmuskeln ausdruckslos erscheinen und einen "abgesenkten Kopf" durch schwache hintere Nackenmuskeln haben. Dieser Patient hatte in diesem Szenario beidseitig klare Lungengeräusche. Sie hatte eine ermüdende bilaterale Ptosis, rechts größer als links. Sie hatte eine ermüdende linke Hyperopie bei extraokularen Bewegungen. Sie hatte eine verminderte Nackenbeugekraft. Der Rest der neurologischen Untersuchung war unauffällig.
Die Diagnose von MG kann durch serologische Tests auf Autoantikörper und elektromyographische Untersuchungen bestätigt werden. Der Edrophoniumchlorid (Tensilon)-Test ist empfindlich, hat aber eine signifikante Falsch-Positiv-Rate. Ein Thorax-CT oder MRT sollte durchgeführt werden, um das Fehlen eines Thymoms nachzuweisen. Etwa 60–70% der MG-Patienten haben eine Thymushyperplasie und 10–15% der Patienten haben ein zugrunde liegendes Thymom.
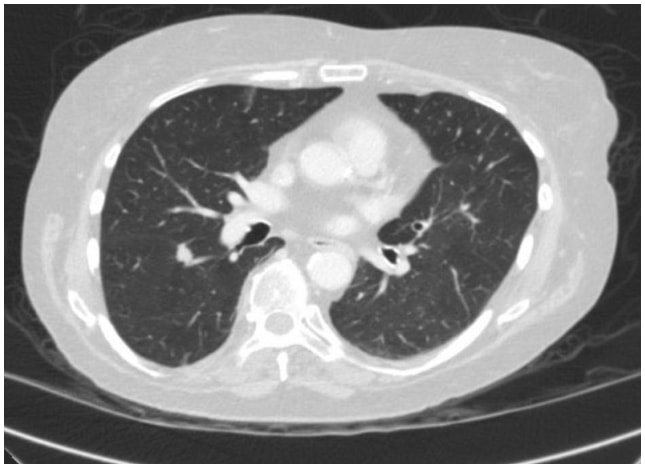
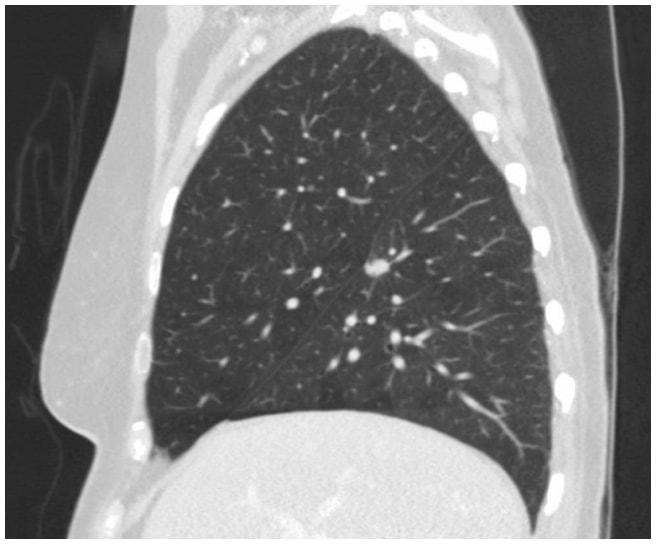
In diesem Fall ergab ein Thorax-CT eine spikulierte 1,3 cm große Läsion an der Spaltfläche des oberen Segments im rechten Unterlappen, die sehr verdächtig für ein Lungenkarzinom war (Abbildung 1). Anschließend wurde ein PET/CT angefertigt, das eine FDG-Avidität zeigte, die für Malignität verdächtig war.
Der natürliche Verlauf von MG ist der von immer kürzeren symptomfreien Intervallen, die innerhalb von 2 bis 3 Jahren nach Ausbruch der Krankheit ihren Höhepunkt erreichen. Es vergeht dann eine Zeitspanne, in der Patienten typischerweise eine anhaltende, stabile Krankheit haben, die sich im Rahmen von Infektionen, Medikamenten oder anderen klinischen Veränderungen verschlimmern kann. Es kann eine dritte Phase folgen, in der etwa 10–20% der Patienten eine Spontanremission haben können.
Die medizinische Behandlung von MG umfasst die Symptomkontrolle (Anticholinesterase) und die Immunmodulation (Steroide, Immunsuppression, Plasmaaustausch, intravenöses Immunglobulin). Patienten mit nicht-thymomatöser MG können von einer Thymektomie profitieren, um die Symptome zu verbessern oder die Wahrscheinlichkeit einer Remission der Krankheit zu erhöhen. Die Klassifizierung des MG-Schweregrads durch die Myasthenia Gravis Foundation of America (MGFA) legt nahe, dass Patienten mit nur okulärer MG (MGFA I) keinen Nutzen aus der Thymektomie ziehen, während Patienten mit generalisierter MG (MGFA >II) eine Symptomverbesserung feststellen können. 1 Ein wichtiger Vorbehalt ist, dass ein hoher Prozentsatz (50-70%) der Patienten mit okulärer MG in den ersten 2 bis 3 Jahren nach der Diagnose zu generalisierter MG fortschreiten; Daher kann eine frühe Thymektomie einen Teil dieser Population "retten".
Dieser Patient hatte einen Lungenknoten im rechten Unterlappen, der auf Malignität und nicht-thymomatöse Myasthenia gravis verdächtig war. Sie benötigte eine Lungenresektion zu diagnostischen und therapeutischen Zwecken sowie eine Thymektomie, um ihre Myasthenia-gravis-Symptome zu kontrollieren. Folglich wurde ein kombinierter Ansatz verfolgt.
Die transzervikale Thymektomie ist der am wenigsten invasive offene Zugang; eine vollständige Resektion des perithymischen Gewebes ist jedoch begrenzt. Dies ist wichtig, da sich der Thymus über seine anatomischen Grenzen hinaus erstrecken kann (Vene innominatus superior und Nervus phrenicus lateral) und etwa 75% der Patienten ektopisches Thymusgewebe im gesamten vorderen Mediastinum aufweisen. Minimalinvasive Techniken wie die videoassistierte Thorakokopie (VATS) oder die robotergestützte Thymektomie führen zu einer verbesserten Visualisierung und Vollständigkeit der Resektion. Sie werden entweder von der linken oder der rechten Brust aus durchgeführt, je nach Präferenz des Chirurgen und Tumorlateralität.
Der Chirurg sollte mit dem Neurologen zusammenarbeiten, um den Patienten präoperativ zu optimieren, um eine postoperative myasthenische Krise zu verhindern und Atemversagen zu vermeiden. Die forcierte Vitalkapazität und die maximale Atemkapazität (Frequenz multipliziert mit dem Atemvolumen in 1 Minute) sollten gemessen werden, um die Atemschwäche zu beurteilen. MG-Symptome müssen vor der Operation mit Cholinesterasehemmern, Immunsuppression, Plasmapherese oder intravenöser Immunglobulinbehandlung gut kontrolliert werden.
Die präoperative Planung mit dem Anästhesieteam ist von entscheidender Bedeutung. Eine neuromuskuläre Blockade wird vollständig vermieden, da Patienten mit MG resistent gegen Succinylcholin und hochempfindlich und unvorhersehbar empfindlich gegenüber nichtdepolarisierenden Mitteln sind. Beruhigungsmittel und Anästhetika sollten kurz wirken, um die Atemdepression beim Verlassen der Anästhesie zu minimieren. Häufig wird eine Kombination aus Inhalations- und intravenöser Anästhesie angewendet. Andere Medikamente, von denen bekannt ist, dass sie die neuromuskuläre Übertragung stören, sollten vermieden werden.
Eine Verbesserung oder Remission der MG-Symptome nach einer Thymektomie kann mehrere Jahre nach der Thymektomie beobachtet werden.
Angesichts der Erwartung einer verlängerten immunsuppressiven Therapie für MG ist die Diagnose eines solitären Lungenknotens wünschenswert, um eine spezifische Infektion und eine aggressive neoplastische Erkrankung auszuschließen.
A. LUNGENKEILBIOPSIE, RECHTER UNTERLAPPEN:
Karzinoidtumor, typisch.
Ein Lymphknoten in der Keilresektion ist von einem Karzinoidtumor betroffen.
HINWEIS: Die Tumorzellen sind diffus Synaptophysin- und Chromogranin-positiv. Ein Fleck für ER ist negativ. Ki-67 färbt 1% der Tumorzellen. Ein winziger mikroskopischer Fokus der zellulären Degeneration ist vorhanden. Die zytologische Atypie ist minimal. Es werden keine Mitosen festgestellt.
Tumorinseln sind in einigen Alveolen neben dem Tumorknoten vorhanden. Es gibt eine begrenzte lymphangitische Ausbreitung des Tumors, jedoch nicht am Resektionsrand. Die Ränder der Exzision sind frei von Tumoren. Ein Teil des Karzinoidtumors ist dicht sklerotisch.
Einige der histologischen Merkmale sind ungewöhnlich, aber die Befunde stellen keine Diagnose eines atypischen Karzinoidtumors dar. Ausgewählte Folien wurden in der Konferenz überprüft.
B. STATION 12 GROSSE SPALTE:
Es gibt keine Hinweise auf eine Malignität in einem Lymphknoten (0/1).
C. STATION 12 LYMPHKNOTENBIOPSIE:
Metastasierender Karzinoidtumor in einem Lymphknoten (1/1).
D. STATION 7 LYMPHKNOTENBIOPSIE:
Es gibt keine Hinweise auf eine Malignität in zwei Lymphknoten (0/2).
E. THYMUS-RESEKTION:
Fettersatz. Es wird kein Thymusgewebe identifiziert.
Die Thymektomie für MG wurde erstmals 1939 von Alfred Blalock im Fall einer jungen Frau mit einem Thymom beschrieben, deren myasthenische Symptome nach der Thymektomie in Remission gingen. 2 1941 zeigte er weiter, dass eine Symptomverbesserung auch bei Patienten mit nicht-thymomatöser MG erreicht werden konnte, die sich einer Thymektomie unterzogen. 3 Die Thymektomie bei MG wurde nach der Veröffentlichung einer Längsschnittstudie mit 1.355 Patienten aus dem Mount Sinai und dem Massachusetts General Hospital zu einem etablierten Behandlungsparadigma. 4 Diese Studie zeigte, dass Frauen unter 40 Jahren mit mittelschwerer bis schwerer generalisierter nicht-thymomatöser MG, die sich einer Thymektomie unterzogen, einen signifikanten (38% Gesamtremission, 51% Verbesserung der Symptome) und anhaltenden Nutzen hatten. 4
Die einzige kontrollierte randomisierte Thymektomie-Studie wurde kürzlich im Jahr 2016 veröffentlicht. Dies war eine multizentrische Studie, die transsternale Thymektomie plus Prednison mit Prednison allein verglich. 5 126 Patienten wurden unter den folgenden Kriterien eingeschlossen: Alter 18–65, nicht-thymomatöse MG, Krankheitsdauer < 5 Jahre, MGFA-Klasse II–IV und erhöhter Serum-Acetylcholinrezeptor-Antikörper. Die Thymektomiegruppe zeigte eine höhere Verbesserung der quantitativen Myasthenia Gravis-Scores und einen geringeren Immunsuppressionsbedarf über eine 3-Jahres-Nachbeobachtung. Noch zu beantwortende Fragen sind, ob diese Vorteile über längere Zeiträume anhalten, ob weniger invasive chirurgische Ansätze die gleichen Vorteile bieten und ob diese Vorteile ohne gleichzeitige Behandlung mit längeren hochdosierten Steroiden gesehen werden können.
Die operative Morbidität und Mortalität für die Thymektomie beträgt 20 % bzw. 1 %. 6,7 Der Bedarf an postoperativer Beatmung betrug in einer Vergleichsstudie 4% nach VATS-Thymektomie und 16% nach transsternaler Thymektomie. 8 Die neuesten internationalen Konsensusrichtlinien für die Behandlung von MG empfehlen, dass9 (1) bei Patienten mit nicht-thymomomatöser, generalisierter MG eine vollständige Thymektomie als elektives Verfahren durchgeführt wird, um eine immunsuppressive Behandlung zu vermeiden oder zu minimieren; (2) alle Patienten mit thymomatöser MG sollten sich einer vollständigen Thymektomie unterziehen, und unvollständig resezierte Thymome sollten mit adjuvanter Chemotherapie und/oder Bestrahlung behandelt werden; (3) Weniger invasive Ansätze zur Thymektomie (Thorakoskopie, Roboter) scheinen ähnliche Ergebnisse zu liefern wie aggressivere Ansätze, obwohl dies in randomisierten kontrollierten Studien nicht gezeigt wurde.
Der Patient hatte in diesem Fall postoperative Blutungen und wurde am postoperativen Tag 1 zur Untersuchung zurück in den Operationssaal gebracht. Nachdem eine angemessene Überwachung, ein angemessener Zugang und eine angemessene Wiederbelebung eingerichtet waren, wurde der Patient mit einem doppellumigen Endotrachealtubus intubiert und in die linke laterale Dekubitusposition gebracht. Der rechte Brustkorb wurde über die vorherigen Thorakotomieschnitte erreicht. Etwa 1 l Hämatom wurde evakuiert. Blutungen wurden an der sternalen Seite der inneren Brustvene festgestellt. Dies wurde mit einer Nahtligatur kontrolliert. Der Rest des postoperativen Verlaufs der Patientin war unauffällig. Sie entwöhnt sich derzeit von Steroiden und hat eine verbesserte Muskelkraft. Die endgültige Pathologie zeigte einen typischen Karzinoidtumor mit 1 positiven Station 12 Lymphknoten. Die Thymusprobe wies einen Fettersatz auf, ohne dass Thymusgewebe identifiziert wurde.
Die Thymektomie ist letztendlich die attraktivste Form der MG-Behandlung, da sie die Notwendigkeit einer langfristigen Verpflichtung zu Immunsuppression oder Steroiden vermeidet. Fortschritte bei Immunsuppressiva und neue Anwendungen von Techniken wie der hämatopoetischen Stammzelltransplantation könnten in Zukunft Teil der MG-Behandlung sein. 10
Die Behandlung typischer Karzinoidtumoren besteht aus einer vollständigen Resektion und einer Lymphknotenentnahme. Ein Lymphknoten in der Fissur zeigte einen metastasierten Karzinoidtumor. Angesichts ihrer Komorbidität ist das Ausmaß der chirurgischen Resektion ausreichend. Eine radikale Lymphknotendissektion könnte eine Option für einen gesünderen Patienten gewesen sein. Die Beobachtung mittels Computertomographie ist für unsere Patientin ein zufriedenstellendes Management.
Wir haben nichts offenzulegen.
Der in diesem Videoartikel erwähnte Patient hat seine informierte Zustimmung gegeben, gefilmt zu werden, und ist sich bewusst, dass Informationen und Bilder online veröffentlicht werden.
References
- Jaretzki A III, Barohn RJ, Ernstoff RM et al; Task Force des medizinisch-wissenschaftlichen Beirats der Myasthenia gravis Foundation of America. Myasthenia gravis: Empfehlungen für klinische Forschungsstandards. Ann Thorac Surg. 2000; 70(1):327-334. doi:10.1016/S0003-4975(00)01595-2.
- Blalock A, Mason MF, Morgan HJ, Riven SS. Myasthenia gravis und Tumoren der Thymusregion: Bericht über einen Fall, in dem der Tumor entfernt wurde. Ann Surg. 1939; 110(4):544-561. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1391425/.
- Kirschner, PA. Alfred Blalock und Thymektomie bei Myasthenia gravis. Ann Thorac Surg. 1987; 43(3):348-349. doi:10.1016/S0003-4975(10)60635-2.
- Perlo VP, Poskanzer DC, Schwab RS, Viets HR, Osserman KE, Genkins G. Myasthenia gravis: Bewertung der Behandlung bei 1.355 Patienten. Neurologie. 1966; 16(5):431-439. doi:10.1212/WNL.16.5.431.
- Wolfe GI, Kaminski HJ, Aban IB et al. Randomisierte Studie zur Thymektomie bei Myasthenia gravis. N Engl J Med. 2016; 375(6):511-522. doi:10.1056/NEJMoa1602489.
- Bachmann K, Burkhardt D, Schreiter I, et al. Langzeitergebnis und Lebensqualität nach offener und thorakoskopischer Thymektomie bei Myasthenia gravis: Analyse von 131 Patienten. Surg Endosc. 2008; 22(11):2470-2477. doi:10.1007/s00464-008-9794-2.
- Gronseth GS, Barohn RJ. Praxisparameter: Thymektomie bei autoimmuner Myasthenia gravis (eine evidenzbasierte Übersichtsarbeit). Neurologie. 2000; 55(1):7-15. doi:10.1212/WNL.55.1.7.
- Meyer DM, Herbert MA, Sobhani NC, et al. Vergleichende klinische Ergebnisse der Thymektomie bei Myasthenia gravis, die durch erweiterte transsternale und minimalinvasive Zugänge durchgeführt wird. Ann Thorac Surg. 2009; 87(2):385-391. doi:10.1016/j.athoracsur.2008.11.040.
- Sanders DB, Wolfe GI, Benatar M, et al. Internationale Konsensleitlinien für die Behandlung von Myasthenia gravis: Zusammenfassung. Neurologie. 2016; 87(4):419-425. doi:10.1212/WNL.00000000000002790.
- Bryant A, Atkins H, Pringle CE, et al. Myasthenia gravis, die mit autologer hämatopoetischer Stammzelltransplantation behandelt wird. JAMA Neurol. 2016; 73(6):652-658. doi:10.1001/jamaneurol.2016.0113.
Cite this article
Madariaga ML, Gaissert HA. Kombinierte Thymektomie und Lungenkeilresektion im rechten Unterlappen durch Thorakoskopie. J Med Einblick. 2024; 2024(181). doi:10.24296/jomi/181.