Timectomia Combinada e Ressecção em Cunha Pulmonar do Lobo Inferior Direito por Toracoscopia
Main Text
Table of Contents
Com o uso crescente da tomografia computadorizada (TC) para rastreamento e investigação diagnóstica, um número crescente de pacientes apresenta nódulos pulmonares. O paciente neste caso apresentou alterações na visão, fraqueza cervical e disfagia. A investigação revelou miastenia gravis não timomatosa, bem como um nódulo pulmonar incidental no lobo inferior direito que era suspeito de malignidade com base em características de imagem, crescimento intervalado e história de câncer de mama. Ela necessitou de uma ressecção pulmonar para fins diagnósticos e terapêuticos. Além disso, uma timectomia foi indicada para ajudar a controlar os sintomas da miastenia gravis. Consequentemente, foi realizada uma abordagem combinada.
A miastenia gravis (MG) é um distúrbio autoimune no qual os autoanticorpos direcionados a componentes da membrana pós-sináptica da junção neuromuscular (receptores de acetilcolina ou proteínas associadas a receptores) resultam em fraqueza fatigável dos músculos oculares, bulbares, dos membros ou respiratórios. A maioria dos pacientes tem anticorpos detectáveis contra o receptor de acetilcolina ou receptor de tirosina quinase específico do músculo.
Pacientes com MG apresentam fraqueza muscular esquelética flutuante que piora no final do dia ou após o exercício. Ptose e/ou diplopia é a apresentação inicial em 50% dos pacientes. Uma proporção menor de pacientes apresenta sintomas bulbares, como disartria, disfagia e mastigação fatigável, e menos frequentemente fraqueza dos membros proximais. Quando a fraqueza muscular respiratória leva à insuficiência respiratória, isso é denominado "crise miastênica" e é uma situação de risco de vida. A crise miastênica pode ser precipitada por muitos fatores, incluindo medicamentos, cirurgia ou inflamação/infecção.
Trata-se de uma mulher de 69 anos com história de miastenia gravis, hipertensão, diabetes, câncer de mama esquerdo tratada com mastectomia, radiação adjuvante e terapia hormonal que apresentou nódulo pulmonar espiculado no lobo inferior direito. O paciente começou a apresentar sintomas de miastenia cerca de 1 ano antes da apresentação. Ela tinha diplopia, cabeça caída, marcha instável e disfagia.
No exame físico, os pacientes demonstram movimentos oculares fracos com função da pupila intacta. Eles podem parecer inexpressivos devido ao envolvimento dos músculos faciais e ter uma "cabeça caída" devido aos músculos posteriores fracos do pescoço. Este paciente neste cenário apresentava sons pulmonares claros bilateralmente. Ela tinha ptose bilateral fatigável, direita maior que esquerda. Ela tinha hipermetropia esquerda fatigável em movimentos extraoculares. Ela tinha diminuído a força de flexão do pescoço. O resto do exame neurológico não foi digno de nota.
O diagnóstico de MG pode ser confirmado por testes sorológicos para autoanticorpos e estudos eletromiográficos. O teste de cloreto de edrofônio (Tensilon) é sensível, mas tem uma taxa significativa de falsos positivos. Uma TC ou ressonância nuclear magnética (RNM) do tórax deve ser obtida para demonstrar a ausência de um timoma. Cerca de 60 a 70% dos pacientes com MG têm hiperplasia tímica e 10 a 15% dos pacientes têm um timoma subjacente.
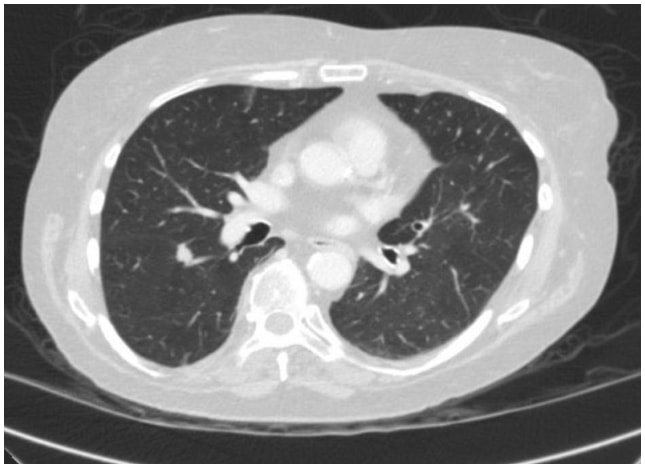
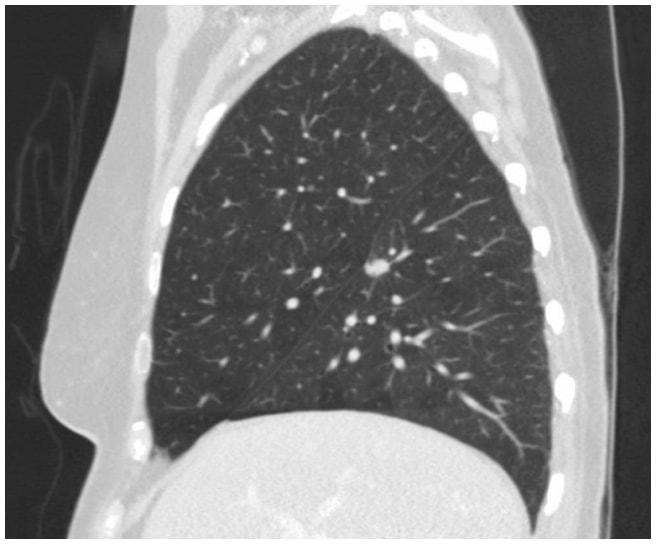
Neste caso, a TC de tórax revelou uma lesão espiculada de 1,3 cm na superfície fissural do segmento superior no lobo inferior direito, altamente suspeita de carcinoma de pulmão (Figura 1). Posteriormente, foi obtida uma PET/CT que mostrou avidez de FDG suspeita de malignidade.
A história natural da MG é a de intervalos livres de sintomas progressivamente mais curtos que atingem o pico dentro de 2 a 3 anos após o início da doença. Um período de tempo decorre quando os pacientes geralmente têm uma doença persistente e estável que pode piorar no contexto de infecção, medicamentos ou outras alterações clínicas. Uma terceira fase pode seguir, na qual cerca de 10 a 20% dos pacientes podem ter remissão espontânea.
O tratamento clínico da MG envolve controle dos sintomas (agentes anticolinesterase) e imunomodulação (esteróides, imunossupressão, plasmaférese, imunoglobulina intravenosa). Pacientes com MG não timomatosa podem se beneficiar da timectomia para melhorar os sintomas ou aumentar a probabilidade de remissão da doença. A classificação da gravidade da MG da Myasthenia Gravis Foundation of America (MGFA) sugere que os pacientes com apenas MG ocular (MGFA I) não obtêm benefícios com a timectomia, enquanto os pacientes com MG generalizada (MGFA >II) podem apresentar melhora dos sintomas. 1 Uma ressalva importante é que uma alta porcentagem (50–70%) de pacientes com MG ocular progride para MG generalizada nos primeiros 2 a 3 anos de diagnóstico; Assim, a timectomia precoce pode "resgatar" uma proporção dessa população.
Este paciente apresentava nódulo pulmonar no lobo inferior direito suspeito de malignidade e miastenia gravis não timomatosa. Ela precisou de uma ressecção pulmonar para fins diagnósticos e terapêuticos, bem como uma timectomia para ajudar a controlar seus sintomas de miastenia gravis. Consequentemente, foi realizada uma abordagem combinada.
A timectomia transcervical é a abordagem aberta menos invasiva; no entanto, a ressecção completa do tecido peritímico é limitada. Isso é importante porque o timo pode se estender além de seus limites anatômicos (veia inominada superiormente e nervos frênicos lateralmente), e cerca de 75% dos pacientes têm tecido tímico ectópico em todo o mediastino anterior. Técnicas minimamente invasivas, como a timectomia videoassistida (CTVA) ou a timectomia robótica, resultam em melhor visualização e completude da ressecção. Eles são realizados a partir do tórax esquerdo ou direito, dependendo da preferência do cirurgião e da lateralidade do tumor.
O cirurgião deve trabalhar com o neurologista para otimizar o paciente no pré-operatório para evitar crises miastênicas pós-operatórias e evitar insuficiência respiratória. A capacidade vital forçada e a capacidade respiratória máxima (frequência multiplicada pelo volume de respirações em 1 minuto) devem ser medidas para avaliar a fraqueza respiratória. Os sintomas de MG devem ser bem controlados com inibidores da colinesterase, imunossupressão, plasmaférese ou tratamento com imunoglobulina intravenosa antes da operação.
O planejamento pré-operatório com a equipe anestésica é fundamental; o bloqueio neuromuscular é completamente evitado, pois os pacientes com MG são resistentes à succinilcolina e altamente e imprevisivelmente sensíveis a agentes não despolarizantes. Sedativos e anestésicos devem ter ação curta para minimizar a depressão respiratória ao acordar da anestesia. Uma combinação de anestesia inalatória e intravenosa é frequentemente usada. Outros medicamentos conhecidos por interferir na transmissão neuromuscular devem ser evitados.
A melhora ou remissão dos sintomas de MG após a timectomia pode ser observada vários anos após a timectomia.
Dada a expectativa de terapia imunossupressora prolongada para MG, o diagnóstico de um nódulo pulmonar solitário é desejável para descartar infecção específica e doença neoplásica agressiva.
A. BIÓPSIA EM CUNHA PULMONAR, LOBO INFERIOR DIREITO:
Tumor carcinoide típico.
Um linfonodo na ressecção em cunha é envolvido por tumor carcinoide.
NOTA: As células tumorais são difusamente positivas para sinaptofisina e cromogranina. Uma coloração para ER é negativa. O Ki-67 cora 1% das células tumorais. Um foco microscópico de degeneração celular está presente. A atipia citológica é mínima. Nenhuma mitose é identificada.
Ilhas tumorais estão presentes em alguns alvéolos adjacentes ao nódulo do tumor. Há disseminação linfangítica limitada do tumor, mas não na margem de ressecção. As margens de excisão estão livres de tumor. Uma parte do tumor carcinoide é densamente esclerótica.
Algumas das características histológicas são incomuns, mas os achados não constituem um diagnóstico de tumor carcinoide atípico. Os slides selecionados foram revisados em conferência.
B. ESTAÇÃO 12 PRINCIPAL FISSURA:
Não há evidência de malignidade em um linfonodo (0/1).
C. BIÓPSIA LINFONODAL DA ESTAÇÃO 12:
Tumor carcinoide metastático em um linfonodo (1/1).
D. BIÓPSIA LINFONODAL DA ESTAÇÃO 7:
Não há evidência de malignidade em dois linfonodos (0/2).
E. RESSECÇÃO DO TIMO:
Reposição gordurosa. Nenhum tecido tímico é identificado.
A timectomia para MG foi descrita pela primeira vez por Alfred Blalock em 1939 no caso de uma jovem com timoma cujos sintomas miastênicos entraram em remissão após a timectomia. 2 Em 1941, ele demonstrou ainda que a melhora dos sintomas também poderia ser alcançada em pacientes com MG não timomatosa submetidos à timectomia. 3 A timectomia para MG tornou-se um paradigma de tratamento bem estabelecido após a publicação de um estudo longitudinal de 1.355 pacientes do Mount Sinai e do Massachusetts General Hospital. 4 Este estudo demonstrou que mulheres com menos de 40 anos de idade com MG não timomatosa generalizada moderada a grave submetidas à timectomia tiveram benefício significativo (38% de remissão total, 51% de melhora dos sintomas) e sustentado. 4
O único estudo controlado de timectomia randomizado foi publicado recentemente em 2016. Este foi um estudo multicêntrico que comparou timectomia transesternal associada a prednisona com prednisona isolada. 5.126 pacientes foram incluídos sob os seguintes critérios: idade de 18 a 65 anos, MG não timomatosa, duração da doença < 5 anos, classe II-IV de AGMG e anticorpo sérico elevado do receptor de acetilcolina. O grupo timectomia demonstrou maior melhora nos escores quantitativos de miastenia gravis e menor necessidade de imunossupressão ao longo de um acompanhamento de 3 anos. As questões ainda a serem respondidas são se esses benefícios são sustentados por longos períodos de tempo, se as abordagens cirúrgicas menos invasivas oferecem os mesmos benefícios e se esses benefícios podem ser observados sem tratamento concomitante com esteróides prolongados em altas doses.
A morbidade e mortalidade operatórias para timectomia são de 20% e 1%, respectivamente. 6,7 A necessidade de ventilação pós-operatória em um estudo de comparação foi de 4% após timectomia por CTVA e 16% após timectomia transesternal. 8 As diretrizes de consenso internacional mais recentes para o manejo da MG recomendam que9 (1) para pacientes com MG generalizada não timomatosa, a timectomia completa seja realizada como um procedimento eletivo para evitar ou minimizar o tratamento imunossupressor; (2) todos os pacientes com MG timomatosa devem ser submetidos a timectomia completa, e os timomas ressecados incompletamente devem ser tratados com quimioterapia adjuvante e/ou radiação; (3) abordagens menos invasivas para timectomia (toracoscópica, robótica) parecem produzir resultados semelhantes a abordagens mais agressivas, embora isso não tenha sido demonstrado em ensaios clínicos randomizados.
O paciente, neste caso, apresentou sangramento pós-operatório e foi levado de volta à sala de cirurgia no 1º dia de pós-operatório para exploração. Após monitorização, acesso e ressuscitação adequados, o paciente foi intubado com tubo endotraqueal de duplo lúmen e colocado em decúbito lateral esquerdo. O tórax direito foi inserido através das incisões de toracotomia prévias. Cerca de 1 L de hematoma foi evacuado. Foi identificado sangramento no lado esternal da veia mamária interna. Isso foi controlado com ligadura de sutura. O restante da evolução pós-operatória do paciente não foi digno de nota. Atualmente, ela está desmamando os esteróides e melhorando a força muscular. A patologia final demonstrou tumor carcinoide típico com 1 linfonodo positivo na estação 12. O espécime de timo teve reposição gordurosa sem tecido tímico identificado.
A timectomia é, em última análise, a forma mais atraente de tratamento da MG porque evita a necessidade de compromisso de longo prazo com imunossupressão ou esteróides. Avanços em drogas imunossupressoras e aplicações emergentes de técnicas como o transplante de células-tronco hematopoiéticas podem fazer parte do tratamento da MG no futuro. 10
O tratamento para tumores carcinoides típicos consiste em ressecção completa e amostragem de linfonodos. Um linfonodo na fissura mostrou tumor carcinoide metastático. Dada a sua comorbidade, a extensão da ressecção cirúrgica é adequada. A dissecção radical dos linfonodos pode ter sido uma opção para um paciente mais saudável. A observação por tomografia computadorizada é um manejo satisfatório para nosso paciente.
Não temos nada a divulgar.
O paciente referido neste artigo em vídeo deu seu consentimento informado para ser filmado e está ciente de que informações e imagens serão publicadas online.
References
- Jaretzki A III, Barohn RJ, Ernstoff RM, et al; Força-Tarefa do Conselho Consultivo Científico Médico da Fundação Miastenia Gravis da América. Miastenia gravis: recomendações para padrões de pesquisa clínica. Cirurgia de Ann Thorac. 2000; 70(1):327-334. DOI:10.1016/S0003-4975(00)01595-2.
- Miastenia gravis e tumores da região tímica: relato de um caso em que o tumor foi removido. Ann Surg. 1939; 110(4):544-561. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1391425/.
- Kirschner PA. Alfred Blalock e timectomia para miastenia gravis. Cirurgia de Ann Thorac. 1987; 43(3):348-349. DOI:10.1016/S0003-4975(10)60635-2.
- Perlo VP, Poskanzer DC, Schwab RS, Viets HR, Osserman KE, Genkins G. Miastenia gravis: avaliação do tratamento em 1.355 pacientes. Neurologia. 1966; 16(5):431-439. DOI:10.1212/WNL.16.5.431.
- Wolfe GI, Kaminski HJ, Aban IB, et al. Ensaio randomizado de timectomia na miastenia gravis. N Engl J Med. 2016; 375(6):511-522. DOI:10.1056/NEJMoa1602489.
- Bachmann K, Burkhardt D, Schreiter I, et al. Evolução a longo prazo e qualidade de vida após timectomia aberta e toracoscópica para miastenia gravis: análise de 131 pacientes. Surg Endosc. 2008; 22(11):2470-2477. DOI:10.1007/S00464-008-9794-2.
- Gronseth GS, Barohn RJ. Parâmetro prático: timectomia para miastenia gravis autoimune (uma revisão baseada em evidências). Neurologia. 2000; 55(1):7-15. DOI:10.1212/WNL.55.1.7.
- Meyer DM, Herbert MA, Sobhani NC, et al. Resultados clínicos comparativos da timectomia para miastenia gravis realizada por abordagens transesternais estendidas e minimamente invasivas. Cirurgia de Ann Thorac. 2009; 87(2):385-391. DOI:10.1016/j.athoracsur.2008.11.040.
- Sanders DB, Wolfe GI, Benatar M, et al. Orientação de consenso internacional para o tratamento da miastenia gravis: resumo executivo. Neurologia. 2016; 87(4):419-425. DOI:10.1212/WNL.00000000000002790.
- Bryant A, Atkins H, Pringle CE, et al. Miastenia gravis tratada com transplante autólogo de células-tronco hematopoiéticas. JAMA Neurol. 2016; 73(6):652-658. DOI:10.1001/jamaneurol.2016.0113.
Cite this article
Madariaga ML, Gaissert HA. Timectomia combinada e ressecção em cunha pulmonar do lobo inferior direito por toracoscopia. J Med Insight. 2024; 2024(181). DOI:10.24296/jomi/181.