Timotomia combinata e resezione del cuneo polmonare del lobo inferiore destro tramite toracoscopia
Main Text
Table of Contents
Con l'uso crescente della tomografia computerizzata (TC) per lo screening e le analisi diagnostiche, un numero crescente di pazienti ha avuto noduli polmonari. In questo caso il paziente si è presentato con alterazioni della vista, debolezza del collo e disfagia. Le analisi hanno rivelato miastenia gravis non timomatosa e un nodulo polmonare del lobo inferiore destro incidentale sospetto di malignità in base alle caratteristiche di imaging, alla crescita intervallare e alla storia di cancro al seno. Ha richiesto una resezione polmonare per scopi diagnostici e terapeutici. Inoltre, è stata indicata una timectomia per aiutare a controllare i sintomi della miastenia gravis. Di conseguenza, fu adottato un approccio congiunto.
La miastenia gravis (MG) è una malattia autoimmune in cui gli autoanticorpi diretti contro componenti della membrana postsinaptica della giunzione neuromuscolare (recettori dell'acetilcolina o proteine associate ai recettori) causano una debolezza fatica dei muscoli oculari, bulbari, degli arti o respiratori. La maggior parte dei pazienti presenta anticorpi rilevabili contro il recettore dell'acetilcolina o il recettore tirosina-chinasi specifico per il muscolo.
I pazienti con MG presentano debolezza muscolare scheletrica fluttuante che peggiora più tardi nella giornata o dopo l'esercizio. La ptosi e/o la diplopia sono la presentazione iniziale nel 50% dei pazienti. Una proporzione minore di pazienti presenta sintomi bulbari come disartria, disfagia e masticazione stancante e meno frequentemente con debolezza prossimale degli arti. Quando la debolezza dei muscoli respiratori porta a un'insufficienza respiratoria, questa è chiamata "crisi miastenica" ed è una situazione potenzialmente letale. La crisi miastenica può essere scatenata da molti fattori, tra cui farmaci, interventi chirurgici o infiammazione/infezione.
Questa è una donna di 69 anni con una storia di miastenia gravis, ipertensione, diabete, cancro al seno sinistro trattato con lumpectomia, radioterapia adiuvante e terapia ormonale, che si è presentata con un nodulo polmonare spiculato del lobo inferiore destro. Il paziente ha iniziato ad avere sintomi di miastenia circa un anno prima della presentazione. Aveva diplopia, testa cadente, andatura instabile e disfagia.
Durante l'esame, i pazienti mostrano deboli movimenti oculari con la funzione pupillara intatta. Possono apparire inespressivi a causa del coinvolgimento muscolare facciale e avere una "testa abbassata" dovuta a muscoli posteriori del collo deboli. Questo paziente in questo scenario aveva suoni polmonari chiari bilateralmente. Aveva una ptosi bilaterale fatica, destra maggiore che sinistra. Presentava ipermetropia sinistra stanca nei movimenti extraoculari. Aveva una riduzione della forza di flessione del collo. Il resto dell'esame neurologico è stato poco rilevante.
La diagnosi di MG può essere confermata da test sierologici per autoanticorpi e studi elettromiografici. Il test del cloruro di edrophonio (Tensilon) è sensibile ma presenta un tasso significativo di falsi positivi. Dovrebbe essere effettuata una TAC toracica o una risonanza magnetica per dimostrare l'assenza di un timoma. Circa il 60–70% dei pazienti con MG presenta iperplasia timica, e il 10–15% presenta un timoma sottostante.
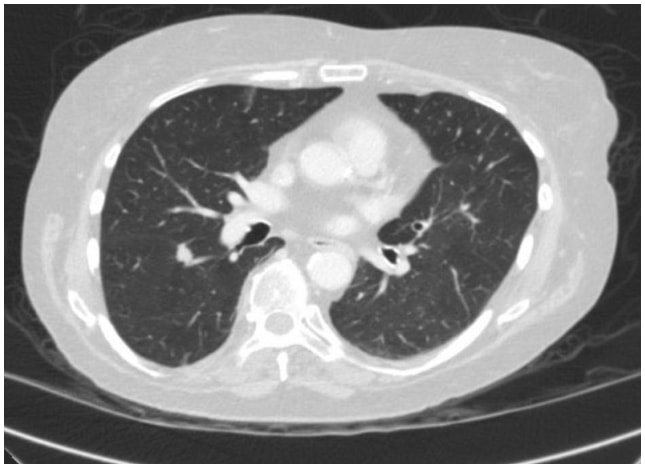
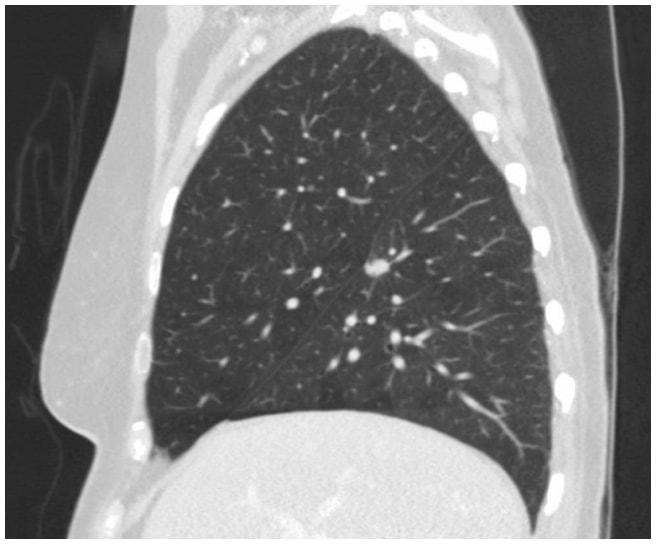
In questo caso, una TAC toracica ha rivelato una lesione spiculata di 1,3 cm sulla superficie fissurale del segmento superiore nel lobo inferiore destro, altamente sospetta di un carcinoma polmonare (Figura 1). Successivamente è stato effettuato un test PET/TAC che ha mostrato l'avidità di FDG sospetta di malignità.
La storia naturale della MG è quella di intervalli progressivamente più brevi senza sintomi che raggiungono il picco entro 2-3 anni dall'insorgenza della malattia. Passa poi un periodo di tempo in cui i pazienti hanno tipicamente una malattia persistente e stabile che può peggiorare in caso di infezioni, farmaci o altri cambiamenti clinici. Può seguire una terza fase in cui circa il 10–20% dei pazienti può avere remissione spontanea.
La gestione medica della MG prevede il controllo dei sintomi (agenti anticolinesterasi) e l'immunomodulazione (steroidi, immunosoppressione, scambio plasmatico, immunoglobulina endovenosa). I pazienti con MG non timomatosa possono beneficiare della timectomia per migliorare i sintomi o aumentare la probabilità di remissione della malattia. La classificazione della gravità della Myasthenia Gravis Foundation of America (MGFA) suggerisce che i pazienti con solo MG oculare (MGFA I) non traggono beneficio dalla timectomia, mentre i pazienti con MG generalizzato (MGFA >II) possono vedere un miglioramento dei sintomi. 1 Una particolare avvertenza è che un'alta percentuale (50–70%) di pazienti con MG oculare progrede verso una MG generalizzata nei primi 2-3 anni dalla diagnosi; Quindi, la timectomia precoce può "salvare" una parte di questa popolazione.
Questo paziente presentava un nodulo polmonare nel lobo inferiore destro sospetto di malignità e miastenia gravidis non timomatosa. Ha richiesto una resezione polmonare per scopi diagnostici e terapeutici, oltre a una timectomia per aiutare a controllare i sintomi della miastenia gravis. Di conseguenza, fu adottato un approccio congiunto.
La timectomia transcervicale è l'approccio aperto meno invasivo; tuttavia, la resezione completa del tessuto peritimico è limitata. Questo è importante perché il timo può estendersi oltre i suoi confini anatomici (vena innominata superiormente e nervi frenici lateralmente), e circa il 75% dei pazienti presenta tessuto timico ectopico in tutto il mediastino anteriore. Tecniche minimamente invasive come la toracoscopia assistita da video (VATS) o la timectomia robotica portano a una migliore visualizzazione e completezza della rezione. Vengono eseguite sia dal torace sinistro che dal destro, a seconda delle preferenze del chirurgo e della lateralità tumorale.
Il chirurgo dovrebbe collaborare con il neurologo per ottimizzare il paziente preoperatoriamente al fine di prevenire una crisi miastenica post-operatoria e di evitare l'insufficienza respiratoria. La capacità vitale forzata e la capacità respiratoria massima (frequenza moltiplicata per il volume di respiri in 1 minuto) devono essere misurate per valutare la debolezza respiratoria. I sintomi della MG devono essere ben controllati con inibitori della colinesterasi, immunosoppressione, plasmaferesi o trattamento con immunoglobuline endovenose prima dell'operazione.
La pianificazione preoperatoria con il team anestetico è fondamentale; il blocco neuromuscolare è completamente evitato poiché i pazienti con MG sono resistenti alla succinilcolina e altamente, e in modo imprevedibile, sensibili agli agenti non depolarizzanti. Sedativi e anestetici dovrebbero essere a breve intensità per minimizzare la depressione respiratoria all'emergenza dall'anestesia. Spesso si utilizza una combinazione di anestesia inalazionale e endovenosa. Altri farmaci noti per interferire con la trasmissione neuromuscolare dovrebbero essere evitati.
Il miglioramento o la remissione dei sintomi MG dopo la timectomia possono essere osservati diversi anni dopo la timectomia.
Data l'aspettativa di una terapia immunosoppressiva prolungata per la MG, è auspicabile la diagnosi di un singolo nodulo polmonare per escludere infezioni specifiche e malattia neoplastica aggressiva.
A. BIOPSIA DEL CUNEO POLMONARE, LOBO INFERIORE DESTRO:
Tumore carcinoide, tipico.
Un linfonodo nella resezione a cuneo è coinvolto da un tumore carcinoide.
NOTA: Le cellule tumorali sono diffusamente sinaptofisina e cromogranina positive. Una colorazione per ER è negativa. Ki-67 colora l'1% delle cellule tumorali. È presente un minimo focus microscopico di degenerazione cellulare. L'atipia citologica è minima. Non vengono identificate mitosi.
Le isole tumorali sono presenti in alcuni alveoli adiacenti al nodulo del tumore. C'è una diffusione linfangitica limitata del tumore, ma non al margine della resezione. I margini dell'escissione sono privi di tumori. Una parte del tumore carcinoide è densamente sclerotica.
Alcune caratteristiche istologiche sono insolite, ma i risultati non costituiscono una diagnosi di tumore carcinoide atipico. Alcune diapositive selezionate sono state esaminate in conferenza.
B. STAZIONE 12 FESSURA MAGGIORE:
Non ci sono evidenze di malignità in un linfonodo (0/1).
BIOPSIA DEI LINFONODI DELLA STAZIONE C. 12:
Tumore carcinoide metastatico in un linfonodo (1/1).
BIOPSIA DEI LINFONODI DELLA STAZIONE D. 7:
Non ci sono evidenze di neoplasie in due linfonodi (0/2).
RESEZIONE DI E. TIMO:
Sostituto grasso. Non viene identificato alcun tessuto timico.
La timectomia per MG fu descritta per la prima volta da Alfred Blalock nel 1939 nel caso di una giovane donna con un timoma i cui sintomi miastenici entrarono in remissione dopo la timotomia. 2 Nel 1941 dimostrò inoltre che il miglioramento dei sintomi poteva essere ottenuto anche nei pazienti con MG non timomatosa sottoposti a timectomia. 3 La timectomia per MG è diventata un paradigma terapeutico ben consolidato dopo la pubblicazione di uno studio longitudinale su 1.355 pazienti del Mount Sinai e del Massachusetts General Hospital. 4 Questo studio ha dimostrato che le donne sotto i 40 anni con MG generalizzato non timomatoso da moderato a grave sottoposte a timectomia hanno avuto un beneficio significativo (38% di remissione totale, miglioramento del 51% dei sintomi) e un beneficio sostenuto. 4
L'unico studio controllato e randomizzato sulla timectomia è stato pubblicato di recente nel 2016. Si trattava di uno studio multicentrico che confrontava la timectomia transsternale più prednisone con prednisone da solo. 5.126 pazienti sono stati inclusi secondo i seguenti criteri: età 18–65 anni, MG non timomatosa, durata della malattia < 5 anni, MGFA classe II–IV e anticorpo seroico dei recettori dell'acetilcolina elevati. Il gruppo della timectomia ha mostrato un miglioramento maggiore nei punteggi di Miastenia Gravis Quantitativa e una minore necessità di immunosoppressione in un follow-up di 3 anni. Le domande che restano da risolvere sono se questi benefici si mantengano per periodi di tempo più lunghi, se approcci chirurgici meno invasivi offrano gli stessi benefici e se questi benefici possano essere osservati senza un trattamento concomitante con steroidi ad alta dose prolungati.
La morbilità e la mortalità operative per la timoctomia sono rispettivamente del 20% e dell'1%. 6,7 Il bisogno di ventilazione post-operatoria in uno studio di confronto era del 4% dopo la timectomia VATS e del 16% dopo la timectomia transsternale. 8 Le linee guida internazionali di consenso più recenti per la gestione della MG raccomandano che9 (1) per i pazienti con MG generalizzato non timomatoso, la timectomia completa venga eseguita come procedura elettiva per evitare o minimizzare il trattamento immunosoppressivo; (2) tutti i pazienti con MG timomatosa devono sottoporsi a timectomia completa e i timomi completamente resezionati devono essere trattati con chemioterapia adiuvante e/o radioterapia; (3) Approcci meno invasivi alla timectomia (toracoscopico, robotico) sembrano produrre risultati simili a approcci più aggressivi, anche se ciò non è stato dimostrato in studi controllati randomizzati.
Il paziente in questo caso aveva sanguinamento post-operatorio ed è stato riportato in sala operatoria il primo giorno post-operatorio per l'esplorazione. Dopo aver stabilito un adeguato monitoraggio, accesso e rianimazione, il paziente è stato intubato con un tubo endotracheale a doppio lumen e posizionato nella posizione del decubito laterale sinistro. Il torace destro è stato inserito tramite le incisioni della toracotomia precedente. È stato evacuato circa 1 litro di ematoma. È stato identificato un sanguinamento sul lato sternale della vena mammaria interna. Questo è stato controllato con legatura di sutura. Il resto del corso postoperatorio del paziente è stato tranquillo. Attualmente sta smettendo gradualmente di prendere steroidi e sta avendo una maggiore forza muscolare. La patologia finale ha mostrato un tipico tumore carcinoide con 1 linfonodo positivo in stazione 12. L'esemplare del timo presentava una sostituzione adiposa senza che fosse stato identificato tessuto timico.
La timectomia è in definitiva la forma di trattamento MG più interessante perché evita la necessità di un impegno a lungo termine con l'immunosoppressione o gli steroidi. I progressi nei farmaci immunosoppressivi e le applicazioni emergenti di tecniche come il trapianto di cellule staminali ematopoietiche potrebbero far parte del trattamento MG in futuro. 10
Il trattamento dei tumori carcinoidi tipici consiste in una resezione completa e un campionamento dei linfonodi. Un linfonodo nella fessura mostrava un tumore carcinoide metastatico. Data la sua comorbidità, l'entità della resezione chirurgica è adeguata. La dissezione radicale dei linfonodi potrebbe essere stata un'opzione per un paziente più sano. L'osservazione tramite tomografia computerizzata rappresenta una gestione soddisfacente per il nostro paziente.
Non abbiamo nulla da rivelare.
Il paziente citato in questo video ha dato il suo consenso informato per essere filmato ed è consapevole che informazioni e immagini saranno pubblicate online.
References
- Jaretzki A III, Barohn RJ, Ernstoff RM, e altri; Task Force del Consiglio Consultivo Scientifico Medico della Myasthenia Gravis Foundation of America. Miastenia gravis: raccomandazioni per gli standard di ricerca clinica. Ann Thorac Surg. 2000; 70(1):327-334. doi:10.1016/S0003-4975(00)01595-2.
- Blalock A, Mason MF, Morgan HJ, Riven SS. Miastenia gravis e tumori della regione timica: referto di un caso in cui il tumore è stato rimosso. Ann Surg. 1939; 110(4):544-561. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1391425/.
- Kirschner, PA. Alfred Blalock e timotomia per miastenia gravis. Ann Thorac Surg. 1987; 43(3):348-349. doi:10.1016/S0003-4975(10)60635-2.
- Perlo VP, Poskanzer DC, Schwab RS, Viets HR, Osserman KE, Genkins G. Miastenia gravis: valutazione del trattamento in 1.355 pazienti. Neurologia. 1966; 16(5):431-439. doi:10.1212/WNL.16.5.431.
- Wolfe GI, Kaminski HJ, Aban IB, e altri. Studio randomizzato sulla timoctomia nella miastenia gravis. N Engl J Med. 2016; 375(6):511-522. doi:10.1056/NEJMoa1602489.
- Bachmann K, Burkhardt D, Schreiter I, e altri. Esito a lungo termine e qualità della vita dopo la timectomia aperta e toracoscopica per miastenia gravis: analisi di 131 pazienti. Endosc chirurgico. 2008; 22(11):2470-2477. doi:10.1007/s00464-008-9794-2.
- Gronseth GS, Barohn RJ. Parametro di pratica: timectomia per miastenia gravis autoimmune (una revisione basata su evidenze). Neurologia. 2000; 55(1):7-15. doi:10.1212/WNL.55.1.7.
- Meyer DM, Herbert MA, Sobhani NC, ecc. Esiti clinici comparativi della timectomia per miastenia gravis eseguita tramite approcci transsternali estesi e minimamente invasivi. Ann Thorac Surg. 2009; 87(2):385-391. doi:10.1016/j.athoracsur.2008.11.040.
- Sanders DB, Wolfe GI, Benatar M, e altri. Linee guida di consenso internazionale per la gestione della miastenia gravis: riassunto esecutivo. Neurologia. 2016; 87(4):419-425. doi:10.1212/WNL.0000000000002790.
- Bryant A, Atkins H, Pringle CE, et al. Miastenia gravis trattata con trapianto autologo di cellule staminali ematopoietiche. JAMA Neurol. 2016; 73(6):652-658. doi:10.1001/jamaneurol.2016.0113.
Cite this article
Madariaga ML, Gaissert HA. Timotomia combinata e resezione del cuneo polmonare del lobo inferiore destro tramite toracoscopia. J Med Insight. 2024; 2024(181). doi:10.24296/jomi/181.