Thymectomie combinée et résection du coin pulmonaire du lobe inférieur droit par thoracoscopie
Main Text
Table of Contents
Avec l’utilisation croissante de la tomodensitométrie (TDM) pour le dépistage et le bilan diagnostique, on constate qu’un nombre croissant de patients présentent des nodules pulmonaires. Dans ce cas, le patient présentait des changements de vision, une faiblesse du cou et une dysphagie. Le bilan a révélé une myasthénie grave non thymomateuse ainsi qu’un nodule pulmonaire accidentel du lobe inférieur droit qui était suspecté de malignité sur la base des caractéristiques d’imagerie, de la croissance de l’intervalle et des antécédents de cancer du sein. Elle a eu besoin d’une résection pulmonaire à des fins diagnostiques et thérapeutiques. De plus, une thymectomie a été indiquée pour aider à contrôler ses symptômes de myasthénie grave. Par conséquent, une approche combinée a été menée.
La myasthénie grave (MG) est une maladie auto-immune dans laquelle des auto-anticorps dirigés contre des composants de la membrane postsynaptique de la jonction neuromusculaire (récepteurs de l’acétylcholine ou protéines associées aux récepteurs) entraînent une faiblesse fatigable des muscles oculaires, bulbaires, des membres ou respiratoires. La plupart des patients ont des anticorps détectables contre le récepteur de l’acétylcholine ou le récepteur de la tyrosine kinase spécifique du muscle.
Les patients atteints de MG présentent une faiblesse musculaire squelettique fluctuante qui s’aggrave plus tard dans la journée ou après l’exercice. La ptose et/ou la diplopie sont la présentation initiale chez 50 % des patients. Une plus petite proportion de patients présentent des symptômes bulbaires tels que la dysarthrie, la dysphagie et la mastication fatigable et moins fréquemment une faiblesse des membres proximaux. Lorsque la faiblesse des muscles respiratoires entraîne une insuffisance respiratoire, on parle de « crise myasthénique » et il s’agit d’une situation potentiellement mortelle. La crise myasthénique peut être précipitée par de nombreux facteurs, notamment les médicaments, la chirurgie ou l’inflammation/infection.
Il s’agit d’une femme de 69 ans ayant des antécédents de myasthénie grave, d’hypertension, de diabète, de cancer du sein gauche traité par tumorectomie, radiothérapie adjuvante et hormonothérapie qui s’est présentée avec un nodule pulmonaire spiculé du lobe inférieur droit. Le patient a commencé à présenter des symptômes de myasthénie environ 1 an avant la consultation. Elle souffrait de diplopie, de tête tombante, d’une démarche instable et de dysphagie.
À l’examen, les patients présentent des mouvements oculaires faibles avec une fonction pupillaire intacte. Ils peuvent sembler inexpressifs en raison de l’atteinte des muscles faciaux et avoir une « tête tombante » due à la faiblesse des muscles postérieurs du cou. Dans ce scénario, ce patient avait des bruits pulmonaires clairs bilatéraux. Elle avait une ptose bilatérale fatigable, la droite plus grande que la gauche. Elle souffrait d’hypermétropie gauche fatigable dans les mouvements extraoculaires. Elle avait une diminution de la force de flexion du cou. Le reste de l’examen neurologique n’a pas été remarquable.
Le diagnostic de MG peut être confirmé par des tests sérologiques pour les auto-anticorps et des études électromyographiques. Le test au chlorure d’édrophonium (Tensilon) est sensible mais présente un taux important de faux positifs. Une tomodensitométrie ou une IRM thoracique doit être obtenue pour démontrer l’absence de thymome. Environ 60 à 70 % des patients atteints de MG présentent une hyperplasie thymique, et 10 à 15 % des patients ont un thymome sous-jacent.
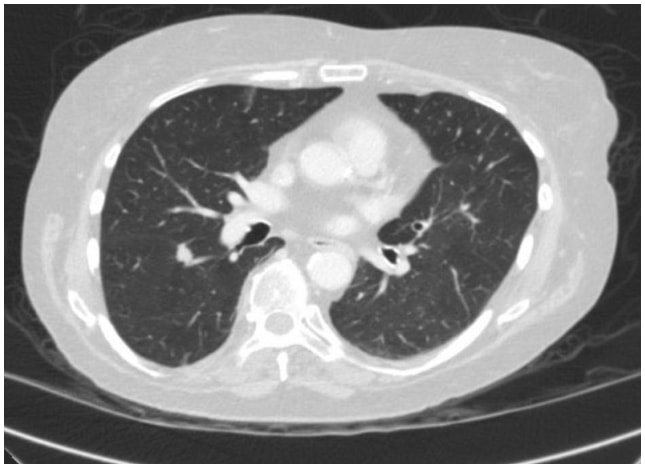
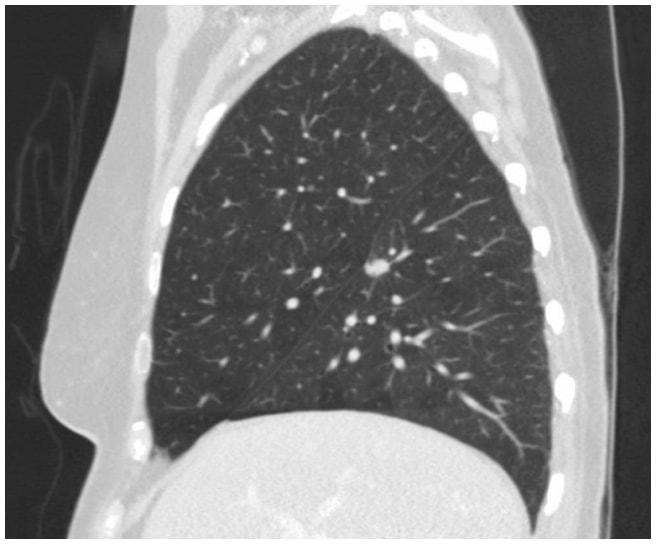
Dans ce cas, une tomodensitométrie thoracique a révélé une lésion spiculée de 1,3 cm à la surface fissurale du segment supérieur du lobe inférieur droit, très suspecte d’un carcinome du poumon (figure 1). Par la suite, une TEP/TDM a révélé une suspicion de malignité chez le FDG.
L’histoire naturelle de la MG est celle d’intervalles sans symptômes de plus en plus courts qui culminent dans les 2 à 3 ans suivant le début de la maladie. Une période de temps s’écoule alors pendant laquelle les patients ont généralement une maladie persistante et stable qui peut s’aggraver dans le cadre d’une infection, de médicaments ou d’autres changements cliniques. Une troisième phase peut suivre au cours de laquelle environ 10 à 20 % des patients peuvent avoir une rémission spontanée.
La prise en charge médicale de la MG implique le contrôle des symptômes (agents anticholinestérasiques) et l’immunomodulation (stéroïdes, immunosuppression, plasmaplasmase, immunoglobuline intraveineuse). Les patients atteints de MG non thymomateuse peuvent bénéficier de la thymectomie pour améliorer les symptômes ou augmenter la probabilité de rémission de la maladie. La classification de la gravité de la MG de la Myasthenia Gravis Foundation of America (MGFA) suggère que les patients atteints uniquement de MG oculaire (MGFA I) ne tirent aucun bénéfice de la thymectomie, tandis que les patients atteints de MG généralisée (MGFA >II) peuvent voir une amélioration des symptômes. 1 Une mise en garde importante est qu’un pourcentage élevé (50 à 70 %) de patients atteints de MG oculaire évolue vers une MG généralisée au cours des 2 à 3 premières années suivant le diagnostic ; Ainsi, une thymectomie précoce peut « sauver » une partie de cette population.
Ce patient présentait un nodule pulmonaire du lobe inférieur droit suspect de malignité et de myasthénie grave non thymomateuse. Elle a eu besoin d’une résection pulmonaire à des fins diagnostiques et thérapeutiques ainsi que d’une thymectomie pour aider à contrôler ses symptômes de myasthénie grave. Par conséquent, une approche combinée a été menée.
La thymectomie transcervicale est l’approche ouverte la moins invasive ; Cependant, la résection complète du tissu périthymique est limitée. Ceci est important car le thymus peut s’étendre au-delà de ses limites anatomiques (veine innominée en haut et nerfs phréniques latéralement), et environ 75 % des patients ont un tissu thymique ectopique dans tout le médiastin antérieur. Les techniques mini-invasives telles que la thoracoscopie vidéo-assistée (VATS) ou la thymectomie robotisée permettent d’améliorer la visualisation et l’exhaustivité de la résection. Ils sont effectués soit à partir de la poitrine gauche, soit de la poitrine droite selon la préférence du chirurgien et la latéralité de la tumeur.
Le chirurgien doit travailler avec le neurologue pour optimiser le patient avant l’opération afin de prévenir la crise myasthénique postopératoire et d’éviter l’insuffisance respiratoire. La capacité vitale forcée et la capacité respiratoire maximale (fréquence multipliée par le volume des respirations en 1 minute) doivent être mesurées pour évaluer la faiblesse respiratoire. Les symptômes de la MG doivent être bien contrôlés par des inhibiteurs de la cholinestérase, une immunosuppression, une plasmaphérèse ou un traitement par immunoglobulines intraveineuses avant l’opération.
La planification préopératoire avec l’équipe d’anesthésie est essentielle ; Le blocage neuromusculaire est complètement évité car les patients atteints de MG sont résistants à la succinylcholine et très, et de manière imprévisible, sensibles aux agents non dépolarisants. Les sédatifs et les anesthésiques doivent avoir une action courte pour minimiser la dépression respiratoire à la sortie de l’anesthésie. Une combinaison d’anesthésie par inhalation et par voie intraveineuse est souvent utilisée. D’autres médicaments connus pour interférer avec la transmission neuromusculaire doivent être évités.
L’amélioration ou la rémission des symptômes de la MG après la thymectomie peut être observée plusieurs années après la thymectomie.
Étant donné l’attente d’un traitement immunosuppresseur prolongé pour la MG, le diagnostic d’un nodule pulmonaire solitaire est souhaitable pour exclure une infection spécifique et une maladie néoplasique agressive.
A. BIOPSIE DU COIN PULMONAIRE, LOBE INFÉRIEUR DROIT :
Tumeur carcinoïde, typique.
Un ganglion lymphatique dans la résection cunéiforme est impliqué par une tumeur carcinoïde.
REMARQUE : Les cellules tumorales sont diffuses positives pour la synaptophysine et la chromogranine. Une coloration pour le RE est négative. Le Ki-67 colore 1 % des cellules tumorales. Un foyer microscopique minuscule de dégénérescence cellulaire est présent. L’atypie cytologique est minime. Aucune mitose n’est identifiée.
Des îlots tumoraux sont présents dans certaines alvéoles adjacentes au nodule de la tumeur. Il y a une propagation lymphangitique limitée de la tumeur, mais pas à la marge de résection. Les marges d’excision sont exemptes de tumeur. Une partie de la tumeur carcinoïde est densément sclérosée.
Certaines des caractéristiques histologiques sont inhabituelles, mais les résultats ne constituent pas un diagnostic de tumeur carcinoïde atypique. Une sélection de diapositives a été examinée lors de la conférence.
B. STATION 12 FISSURE MAJEURE :
Il n’y a aucun signe de malignité dans un ganglion lymphatique (0/1).
C. BIOPSIE DES GANGLIONS LYMPHATIQUES DE LA STATION 12 :
Tumeur carcinoïde métastatique dans un ganglion lymphatique (1/1).
D. BIOPSIE DES GANGLIONS LYMPHATIQUES DE LA STATION 7 :
Il n’y a aucun signe de malignité dans deux ganglions lymphatiques (0/2).
E. RÉSECTION DU THYMUS :
Remplacement des graisses. Aucun tissu thymique n’est identifié.
La thymectomie pour la MG a été décrite pour la première fois par Alfred Blalock en 1939 dans le cas d’une jeune femme atteinte d’un thymome dont les symptômes myasthéniques sont entrés en rémission après une thymectomie. 2 En 1941, il a en outre démontré que l’amélioration des symptômes pouvait également être obtenue chez les patients atteints de MG non thymomateuse qui ont subi une thymectomie. 3 La thymectomie pour la MG est devenue un paradigme de traitement bien établi après la publication d’une étude longitudinale portant sur 1 355 patients du Mount Sinai et du Massachusetts General Hospital. 4 Cette étude a démontré que les femmes de moins de 40 ans atteintes de MG généralisée non thymomateuse modérée à sévère qui ont subi une thymectomie présentaient des avantages significatifs (38 % de rémission totale, 51 % d’amélioration des symptômes) et durables. 4
Le seul essai contrôlé randomisé sur la thymectomie a récemment été publié en 2016. Il s’agissait d’un essai multicentrique qui comparait la thymectomie transsternale associée à la prednisone à la prednisone seule. 5 126 patients ont été inclus selon les critères suivants : âge de 18 à 65 ans, MG non thymomateuse, durée de la maladie < 5 ans, MGFA de classe II-IV et anticorps sériques élevés contre le récepteur de l’acétylcholine. Le groupe de thymectomie a montré une amélioration plus élevée des scores quantitatifs de myasthénie grave et moins d’immunosuppression requise au cours d’un suivi de 3 ans. Les questions qui se posent encore sont de savoir si ces avantages sont maintenus sur de plus longues périodes, si les approches chirurgicales moins invasives offrent les mêmes avantages et si ces avantages peuvent être observés sans traitement concomitant avec des stéroïdes à forte dose prolongée.
La morbidité et la mortalité opératoires pour la thymectomie sont respectivement de 20 % et 1 %. 6,7 Dans une étude comparative, le besoin de ventilation postopératoire était de 4 % après thymectomie VATS et de 16 % après thymectomie transsternale. 8 Les lignes directrices consensuelles internationales les plus récentes pour la prise en charge de la MG recommandentque 9 (1) pour les patients atteints de MG généralisée non thymomateuse, une thymectomie complète soit pratiquée en tant que procédure élective pour éviter ou minimiser le traitement immunosuppresseur ; (2) tous les patients atteints de MG thymomateuse doivent subir une thymectomie complète, et les thymomes incomplètement réséqués doivent être traités par chimiothérapie adjuvante et/ou radiothérapie ; (3) Les approches moins invasives de la thymectomie (thoracoscopique, robotique) semblent donner des résultats similaires à ceux des approches plus agressives, bien que cela n’ait pas été démontré dans les essais contrôlés randomisés.
Dans ce cas, le patient a eu des saignements postopératoires et a été ramené à la salle d’opération le jour 1 postopératoire pour une exploration. Après la mise en place d’une surveillance, d’un accès et d’une réanimation adéquats, le patient a été intubé à l’aide d’une sonde endotrachéale à double lumière, et il a été placé en position de décubitus latéral gauche. Le thorax droit a été pénétré par les incisions de la thoracotomie précédente. Environ 1 L d’hématome a été évacué. Un saignement a été identifié du côté sternal de la veine mammaire interne. Cela a été contrôlé par la ligature des sutures. Le reste de l’évolution postopératoire du patient n’a pas été remarquable. Elle est actuellement sevrée des stéroïdes et a amélioré sa force musculaire. La pathologie finale a mis en évidence une tumeur carcinoïde typique avec 1 station 12 ganglion lymphatique positif. L’échantillon de thymus avait un remplacement graisseux sans tissu thymique identifié.
La thymectomie est finalement la forme la plus attrayante de traitement de la MG car elle évite la nécessité d’un engagement à long terme vers l’immunosuppression ou les stéroïdes. Les progrès des médicaments immunosuppresseurs et les applications émergentes de techniques telles que la greffe de cellules souches hématopoïétiques pourraient faire partie du traitement de la MG à l’avenir. 10
Le traitement des tumeurs carcinoïdes typiques consiste en une résection complète et un prélèvement de ganglions lymphatiques. Un ganglion lymphatique dans la fissure a montré une tumeur carcinoïde métastatique. Compte tenu de sa comorbidité, l’étendue de la résection chirurgicale est adéquate. Le curage ganglionnaire radical aurait pu être une option pour un patient en meilleure santé. L’observation par tomodensitométrie est une prise en charge satisfaisante pour notre patient.
Nous n’avons rien à divulguer.
Le patient visé dans cet article vidéo a donné son consentement éclairé pour être filmé et est conscient que des informations et des images seront publiées en ligne.
References
- Jaretzki A.I., Barohn R.J., Ernstoff R.M., et coll. ; Groupe de travail du Conseil consultatif scientifique médical de la Fondation Myasthenia Gravis d’Amérique. Myasthénie grave : recommandations pour les normes de recherche clinique. Ann Thorac Surg. 2000; 70(1):327-334. doi :10.1016/S0003-4975(00)01595-2.
- Blalock A, Mason MF, Morgan HJ, Riven SS. Myasthénie grave et tumeurs de la région thymique : rapport d’un cas dans lequel la tumeur a été enlevée. Ann Surg. 1939; 110(4):544-561. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1391425/.
- Kirschner, Pennsylvanie. Alfred Blalock et thymectomie pour la myasthénie grave. Ann Thorac Surg. 1987; 43(3):348-349. doi :10.1016/S0003-4975(10)60635-2.
- Perlo VP, Poskanzer DC, Schwab RS, Viets HR, Osserman KE, Genkins G. Myasthénie grave : évaluation du traitement chez 1 355 patients. Neurologie. 1966; 16(5):431-439. doi :10.1212/WNL.16.5.431.
- Wolfe GI, Kaminski HJ, Aban IB, et al. Essai randomisé de thymectomie dans la myasthénie grave. N Engl J Med. 2016; 375(6):511-522. doi :10.1056/NEJMoa1602489.
- Bachmann K, Burkhardt D, Schreiter I, et al. Évolution à long terme et qualité de vie après une thymectomie ouverte et thoracoscopique pour la myasthénie grave : analyse de 131 patients. Surg Endosc. 2008; 22(11):2470-2477. doi :10.1007/s00464-008-9794-2.
- Gronseth GS, Barohn RJ. Paramètre de pratique : thymectomie pour la myasthénie grave auto-immune (une revue fondée sur des preuves). Neurologie. 2000; 55(1):7-15. doi :10.1212/WNL.55.1.7.
- Meyer DM, Herbert MA, Sobhani NC, et al. Résultats cliniques comparatifs de la thymectomie pour la myasthénie grave réalisée par des approches transsternales étendues et mini-invasives. Ann Thorac Surg. 2009; 87(2):385-391. doi :10.1016/j.athoracsur.2008.11.040.
- Sanders DB, Wolfe GI, Benatar M, et al. Lignes directrices consensuelles internationales pour la prise en charge de la myasthénie grave : résumé. Neurologie. 2016; 87(4):419-425. doi :10.1212/WNL.000000000002790.
- Bryant A, Atkins H, Pringle CE, et al. Myasthénie grave traitée par autogreffe de cellules souches hématopoïétiques. JAMA Neurol. 2016; 73(6):652-658. doi :10.1001/jamaneurol.2016.0113.
Cite this article
Madariaga ML, Gaissert HA. Thymectomie combinée et résection du coin pulmonaire du lobe inférieur droit par thoracoscopie. J Med Insight. 2024; 2024(181). doi :10.24296/jomi/181.