Timectomía combinada y resección en cuña pulmonar del lóbulo inferior derecho mediante toracoscopia
Main Text
Table of Contents
Con el uso cada vez mayor de la tomografía computarizada (TC) para la detección y el diagnóstico, se encuentra un número cada vez mayor de pacientes con nódulos pulmonares. El paciente en este caso presentó cambios en la visión, debilidad en el cuello y disfagia. El estudio reveló miastenia gravis no timomatosa, así como un nódulo pulmonar incidental en el lóbulo inferior derecho que era sospechoso de malignidad según las características de las imágenes, el intervalo de crecimiento y los antecedentes de cáncer de mama. Requirió una resección pulmonar con fines diagnósticos y terapéuticos. Además, se le indicó una timectomía para ayudar a controlar sus síntomas de miastenia gravis. En consecuencia, se llevó a cabo un enfoque combinado.
La miastenia gravis (MG) es un trastorno autoinmune en el que los autoanticuerpos dirigidos a componentes de la membrana postsináptica de la unión neuromuscular (receptores de acetilcolina o proteínas asociadas a receptores) provocan una debilidad fatigable de los músculos oculares, bulbares, de las extremidades o respiratorios. La mayoría de los pacientes tienen anticuerpos detectables contra el receptor de acetilcolina o el receptor de tirosina quinasa específico del músculo.
Los pacientes con MG presentan debilidad fluctuante del músculo esquelético que empeora más tarde en el día o después del ejercicio. La ptosis y/o diplopía es la presentación inicial en el 50% de los pacientes. Una proporción menor de pacientes presenta síntomas bulbares como disartria, disfagia y masticación fatigable y, con menor frecuencia, debilidad de las extremidades proximales. Cuando la debilidad de los músculos respiratorios conduce a la insuficiencia respiratoria, esto se denomina "crisis miasténica" y es una situación potencialmente mortal. La crisis miasténica puede ser precipitada por muchos factores, incluidos los medicamentos, la cirugía o la inflamación/infección.
Se trata de una mujer de 69 años con antecedentes de miastenia gravis, hipertensión, diabetes, cáncer de mama izquierdo tratado con tumorectomía, radiación adyuvante y terapia hormonal que acudió a consulta con un nódulo pulmonar espiculado en lóbulo inferior derecho. El paciente comenzó a tener síntomas de miastenia aproximadamente 1 año antes de la presentación. Tenía diplopía, cabeza caída, marcha inestable y disfagia.
En el examen, los pacientes muestran movimientos oculares débiles con la función de la pupila intacta. Pueden parecer inexpresivos debido a la afectación de los músculos faciales y tienen una "cabeza caída" debido a la debilidad de los músculos posteriores del cuello. Este paciente en este escenario presentaba ruidos pulmonares claros bilateralmente. Tenía una ptosis bilateral fatigable, mayor derecha que izquierda. Tenía una hipermetropía izquierda fatigable en los movimientos extraoculares. Había disminuido la fuerza de flexión del cuello. El resto del examen neurológico no tuvo nada de especial.
El diagnóstico de MG puede confirmarse mediante pruebas serológicas de autoanticuerpos y estudios electromiográficos. La prueba de cloruro de edrofonio (Tensilon) es sensible, pero tiene una tasa significativa de falsos positivos. Se debe obtener una tomografía computarizada de tórax o una resonancia magnética para demostrar la ausencia de un timoma. Alrededor del 60-70% de los pacientes con MG tienen hiperplasia tímica, y el 10-15% de los pacientes tienen un timoma subyacente.
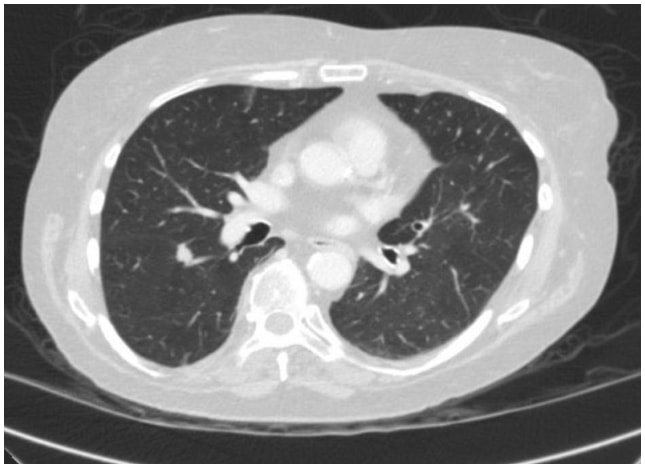
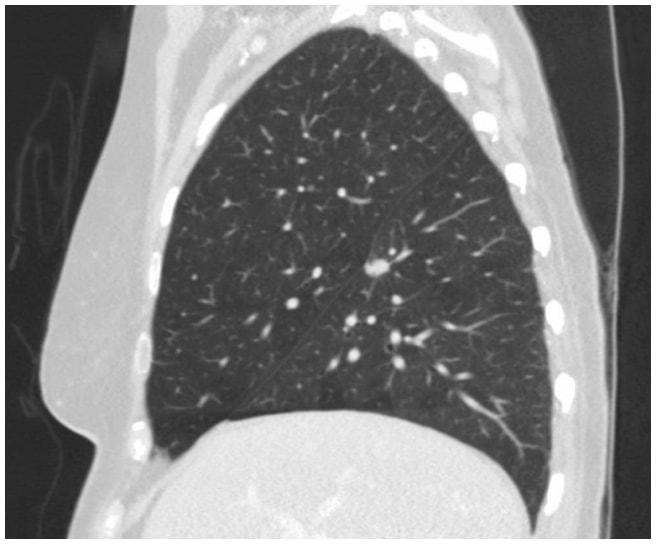
En este caso, la TAC de tórax reveló una lesión espiculada de 1,3 cm en la superficie fisural del segmento superior en el lóbulo inferior derecho que era altamente sospechosa de carcinoma de pulmón (Figura 1). Posteriormente se obtuvo una PET/TC que mostró avidez de FDG sospechosa de malignidad.
La historia natural de la MG es la de intervalos sin síntomas progresivamente más cortos que alcanzan su punto máximo dentro de los 2 a 3 años posteriores al inicio de la enfermedad. Luego transcurre un período de tiempo en el que los pacientes suelen tener una enfermedad persistente y estable que puede empeorar en el contexto de una infección, medicamentos u otros cambios clínicos. A continuación, puede seguir una tercera fase en la que alrededor del 10-20% de los pacientes pueden tener remisión espontánea.
El tratamiento médico de la MG incluye el control de los síntomas (agentes anticolinesterasa) y la inmunomodulación (esteroides, inmunosupresión, recambio plasmático, inmunoglobulina intravenosa). Los pacientes con MG no timomatosa pueden beneficiarse de la timectomía para mejorar los síntomas o aumentar la probabilidad de remisión de la enfermedad. La clasificación de la Myasthenia Gravis Foundation of America (MGFA) de la gravedad de la MG sugiere que los pacientes con MG ocular (MGFA I) no obtienen beneficios de la timectomía, mientras que los pacientes con MG generalizada (MGFA >II) pueden ver una mejoría de los síntomas. 1 Una advertencia importante es que un alto porcentaje (50-70%) de los pacientes con MG ocular progresan a MG generalizada durante los primeros 2 a 3 años del diagnóstico; Por lo tanto, la timectomía precoz puede "rescatar" a una parte de esta población.
Este paciente tenía un nódulo pulmonar en el lóbulo inferior derecho que era sospechoso de malignidad y miastenia gravis no timomatosa. Requirió una resección pulmonar con fines diagnósticos y terapéuticos, así como una timectomía para ayudar a controlar sus síntomas de miastenia gravis. En consecuencia, se llevó a cabo un enfoque combinado.
La timectomía transcervical es el abordaje abierto menos invasivo; sin embargo, la resección completa del tejido peritímico es limitada. Esto es importante porque el timo puede extenderse más allá de sus límites anatómicos (vena innominada superior y nervios frénicos lateralmente), y alrededor del 75% de los pacientes tienen tejido tímico ectópico en todo el mediastino anterior. Las técnicas mínimamente invasivas, como la videotoracoscópica (VATS) o la timectomía robótica, mejoran la visualización y la integridad de la resección. Se realizan desde el tórax izquierdo o derecho, según la preferencia del cirujano y la lateralidad del tumor.
El cirujano debe trabajar con el neurólogo para optimizar al paciente preoperatoriamente para prevenir la crisis miasténica postoperatoria y evitar la insuficiencia respiratoria. La capacidad vital forzada y la capacidad respiratoria máxima (frecuencia multiplicada por el volumen de respiraciones en 1 minuto) deben medirse para evaluar la debilidad respiratoria. Los síntomas de la MG deben controlarse bien con inhibidores de la colinesterasa, inmunosupresión, plasmaféresis o tratamiento con inmunoglobulinas intravenosas antes de la operación.
La planificación preoperatoria con el equipo de anestesia es fundamental; El bloqueo neuromuscular se evita por completo, ya que los pacientes con MG son resistentes a la succinilcolina y son muy sensibles e impredecibles a los agentes no despolarizantes. Los sedantes y anestésicos deben ser de acción corta para minimizar la depresión respiratoria al salir de la anestesia. A menudo se utiliza una combinación de anestesia inhalatoria e intravenosa. Deben evitarse otros medicamentos que se sabe que interfieren con la transmisión neuromuscular.
La mejoría o remisión de los síntomas de MG después de la timectomía puede observarse varios años después de la timectomía.
Dada la expectativa de un tratamiento inmunosupresor prolongado para la MG, es deseable el diagnóstico de un nódulo pulmonar solitario para excluir una infección específica y una enfermedad neoplásica agresiva.
A. BIOPSIA EN CUÑA PULMONAR, LÓBULO INFERIOR DERECHO:
Tumor carcinoide, típico.
Un ganglio linfático en la resección en cuña está afectado por un tumor carcinoide.
NOTA: Las células tumorales son difusamente positivas para sinaptofisina y cromogranina. Una tinción para ER es negativa. El Ki-67 tiñe el 1% de las células tumorales. Un minúsculo foco microscópico de degeneración celular está presente. La atipia citológica es mínima. No se identifican mitosis.
Las islas tumorales están presentes en algunos alvéolos adyacentes al nódulo del tumor. La diseminación linfangítica del tumor es limitada, pero no en el margen de resección. Los márgenes de la escisión están libres de tumor. Una parte del tumor carcinoide es densamente esclerótica.
Algunas de las características histológicas son inusuales, pero los hallazgos no constituyen un diagnóstico de tumor carcinoide atípico. Las diapositivas seleccionadas fueron revisadas en la conferencia.
B. ESTACIÓN 12 FISURA MAYOR:
No hay evidencia de neoplasia maligna en un ganglio linfático (0/1).
BIOPSIA DE GANGLIOS LINFÁTICOS DE LA ESTACIÓN 12:
Tumor carcinoide metastásico en un ganglio linfático (1/1).
D. BIOPSIA DE GANGLIOS LINFÁTICOS DE LA ESTACIÓN 7:
No hay evidencia de malignidad en dos ganglios linfáticos (0/2).
E. RESECCIÓN DEL TIMO:
Reemplazo graso. No se identifica tejido tímico.
La timectomía para la MG fue descrita por primera vez por Alfred Blalock en 1939 en el caso de una mujer joven con un timoma cuyos síntomas miasténicos entraron en remisión después de la timectomía. 2 En 1941, demostró además que la mejoría de los síntomas también podía lograrse en pacientes con MG no timomatosa que se sometieron a timectomía. 3 La timectomía para la MG se convirtió en un paradigma de tratamiento bien establecido después de la publicación de un estudio longitudinal de 1.355 pacientes de Mount Sinai y el Hospital General de Massachusetts. 4 Este estudio demostró que las mujeres menores de 40 años con MG no timomatosa generalizada de moderada a grave que se sometieron a timectomía tuvieron un beneficio significativo (38 % de remisión total, 51 % de mejoría en los síntomas) y sostenido. 4
El único ensayo controlado de timectomía aleatorizada se publicó recientemente en 2016. Este fue un ensayo multicéntrico que comparó la timectomía transesteral más prednisona con la prednisona sola. Se incluyeron 5 126 pacientes con los siguientes criterios: edad de 18 a 65 años, MG no timomatosa, duración de la enfermedad < 5 años, AGMG clase II-IV y elevación sérica de anticuerpos contra el receptor de acetilcolina. El grupo de timectomía demostró una mayor mejoría en las puntuaciones cuantitativas de miastenia gravis y un menor requerimiento de inmunosupresión durante un seguimiento de 3 años. Las preguntas que aún no se han respondido son si estos beneficios se mantienen durante períodos de tiempo más largos, si los enfoques quirúrgicos menos invasivos ofrecen los mismos beneficios y si estos beneficios se pueden ver sin tratamiento simultáneo con esteroides prolongados en dosis altas.
La morbimortalidad operatoria de la timectomía es del 20% y del 1%, respectivamente. 6,7 La necesidad de ventilación postoperatoria en un estudio comparativo fue del 4% después de la timectomía VATS y del 16% después de la timectomía transesternal. 8 Las guías de consenso internacional más recientes para el manejo de la MG recomiendan que9 (1) para los pacientes con MG generalizada no timomatosa, la timectomía completa se realice como un procedimiento electivo para evitar o minimizar el tratamiento inmunosupresor; (2) todos los pacientes con MG timomatosa deben someterse a timectomía completa, y los timomas resecados de forma incompleta deben tratarse con quimioterapia adyuvante o radiación; (3) Los abordajes menos invasivos de la timectomía (toracoscópica, robótica) parecen producir resultados similares a los abordajes más agresivos, aunque esto no se ha demostrado en ensayos controlados aleatorizados.
El paciente en este caso presentó sangrado postoperatorio y fue llevado de nuevo al quirófano el día 1 del postoperatorio para su exploración. Después de establecer una adecuada monitorización, acceso y reanimación, el paciente fue intubado con un tubo endotraqueal de doble luz y se colocó al paciente en decúbito lateral izquierdo. Se ingresó al tórax derecho a través de las incisiones previas de toracotomía. Alrededor de 1 litro de hematoma fue evacuado. Se identificó sangrado en el lado esternal de la vena mamaria interna. Esto se controló con ligadura de sutura. El resto de la evolución postoperatoria del paciente transcurrió sin complicaciones. Actualmente está dejando los esteroides y ha mejorado la fuerza muscular. La anatomía patológica final demostró tumor carcinoide típico con 1 ganglio linfático positivo en la estación 12. El espécimen de timo tenía reemplazo graso sin que se identificara tejido tímico.
La timectomía es, en última instancia, la forma más atractiva de tratamiento de la MG porque evita la necesidad de un compromiso a largo plazo con la inmunosupresión o los esteroides. Los avances en los fármacos inmunosupresores y las aplicaciones emergentes de técnicas como el trasplante de células madre hematopoyéticas pueden formar parte del tratamiento de la MG en el futuro. 10
El tratamiento de los tumores carcinoides típicos consiste en la resección completa y la toma de muestras de ganglios linfáticos. Un ganglio linfático en la fisura mostró un tumor carcinoide metastásico. Dada su comorbilidad, la extensión de la resección quirúrgica es adecuada. La disección radical de los ganglios linfáticos puede haber sido una opción para un paciente más sano. La observación por tomografía computarizada es un manejo satisfactorio para nuestro paciente.
No tenemos nada que revelar.
El paciente al que se hace referencia en este videoartículo ha dado su consentimiento informado para ser filmado y es consciente de que la información y las imágenes se publicarán en línea.
References
- Jaretzki A III, Barohn RJ, Ernstoff RM, et al; Grupo de Trabajo de la Junta Asesora Científica Médica de la Fundación Miastenia Gravis de América. Miastenia gravis: recomendaciones para estándares de investigación clínica. Ann Thorac Surg. 2000; 70(1):327-334. doi:10.1016/S0003-4975(00)01595-2.
- Blalock A, Mason MF, Morgan HJ, Riven SS. Miastenia gravis y tumores de la región tímica: reporte de un caso en el que se extirpó el tumor. Ann Surg. 1939; 110(4):544-561. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1391425/.
- Kirschner PA. Alfred Blalock y la timectomía para la miastenia gravis. Ann Thorac Surg. 1987; 43(3):348-349. doi:10.1016/S0003-4975(10)60635-2.
- Perlo VP, Poskanzer DC, Schwab RS, Viets HR, Osserman KE, Genkins G. Miastenia gravis: evaluación del tratamiento en 1.355 pacientes. Neurología. 1966; 16(5):431-439. doi:10.1212/WNL.16.5.431.
- Wolfe GI, Kaminski HJ, Aban IB, et al. Ensayo aleatorizado de timectomía en miastenia gravis. N Engl J Med. 2016; 375(6):511-522. doi:10.1056/NEJMoa1602489.
- Bachmann K, Burkhardt D, Schreiter I, et al. Resultado a largo plazo y calidad de vida después de la timectomía abierta y toracoscópica para la miastenia gravis: análisis de 131 pacientes. Surg Endosc. 2008; 22(11):2470-2477. doi:10.1007/s00464-008-9794-2.
- Gronseth GS, Barohn RJ. Parámetro de práctica: timectomía para la miastenia gravis autoinmune (una revisión basada en la evidencia). Neurología. 2000; 55(1):7-15. doi:10.1212/WNL.55.1.7.
- Meyer DM, Herbert MA, Sobhani NC, et al. Resultados clínicos comparativos de la timectomía para la miastenia gravis realizada por abordajes transesternales extendidos y mínimamente invasivos. Ann Thorac Surg. 2009; 87(2):385-391. doi:10.1016/j.athoracsur.2008.11.040.
- Sanders DB, Wolfe GI, Benatar M, et al. Guía de consenso internacional para el manejo de la miastenia gravis: resumen ejecutivo. Neurología. 2016; 87(4):419-425. doi:10.1212/WNL.0000000000000002790.
- Bryant A, Atkins H, Pringle CE, et al. Miastenia gravis tratada con trasplante autólogo de células madre hematopoyéticas. JAMA Neurol. 2016; 73(6):652-658. doi:10.1001/jamaneurol.2016.0113.
Cite this article
Madariaga ML, Gaissert HA. Combinación de timectomía y resección en cuña pulmonar del lóbulo inferior derecho mediante toracoscopia. J Med Insight. 2024; 2024(181). doi:10.24296/jomi/181.