Procedimento de Whipple para Neoplasia Endócrina Múltipla do Pâncreas
Main Text
Table of Contents
A neoplasia endócrina múltipla tipo 1 (NEM-1) é uma condição hereditária autossômica dominante incomum com uma frequência estimada de 1:30.000 na população em geral. 35% a 75% dos pacientes com NEM-1 acabam desenvolvendo tumores neuroendócrinos do pâncreas, que apresentam a ameaça mais significativa à sobrevida em longo prazo. A pancreatectomia continua sendo a única terapia curativa para esses pacientes e tem se tornado cada vez mais segura nas últimas décadas. Aqui apresentamos o caso de uma jovem com MEN-1 que apresentou um tumor neuroendócrino pancreático bem diferenciado de 3,5 cm na cabeça do pâncreas. Descrevemos a história natural, os cuidados pré-operatórios, a técnica intraoperatória e as considerações pós-operatórias.
A síndrome NEM-1 é uma síndrome hereditária autossômica dominante relacionada à inativação de mutações na proteína supressora de tumor menina. Infelizmente, a síndrome NEM-1 ocorre na população em geral com uma frequência estimada de 1:30.000, e 35% a 75% das pessoas com a doença desenvolvem tumores neuroendócrinos do pâncreas.
Nossa paciente é uma mulher de 26 anos com história conhecida de MEN-1 em familiares imediatos. Ela estava em ótima saúde até o desenvolvimento de dor de cabeça e lactação, sem qualquer dor ou desconforto abdominal, perda de peso ou sintomas de hipoglicemia. A investigação revelou um adenoma hipofisário que foi finalmente tratado com cabergolina com resolução dos sintomas. A investigação subsequente para tumores adicionais relacionados ao NEM-1 incluiu estudos de ressonância magnética e tomografia computadorizada que revelaram uma massa de 3,5 cm na cabeça do pâncreas. Nosso paciente então se apresentou para avaliação cirúrgica de tumor neuroendócrino da cabeça do pâncreas.
Ela não tem história médica ou cirúrgica abdominal prévia. Seu único medicamento no momento da apresentação é a cabergolina, e ela só bebe uma taça de vinho ocasional. Sua história familiar é notável para MEN-1; sua avó materna tinha um tumor pancreático e foi submetida ao procedimento de Whipple aos 50 anos. Seu pai e dois tios têm tumores pancreáticos e de paratireoide.
O exame físico revelou uma jovem de aparência saudável, com pulso de 80 bpm e pressão arterial de 110/80 mmHg. Ela não tem icterícia escleral e nem linfadenopatia cervical nem supraclavicular. Ela não tem massas palpáveis na tireoide. Seus pulmões estão limpos para a ausculta bilateralmente e seu coração tem frequência e ritmo regulares sem sopro. Seu abdome é mole, insensível, não distendido e sem massas palpáveis, esplenomegalia, hepatomegalia ou ascite. Os exames de pele e extremidades também não apresentam anormalidades focais.
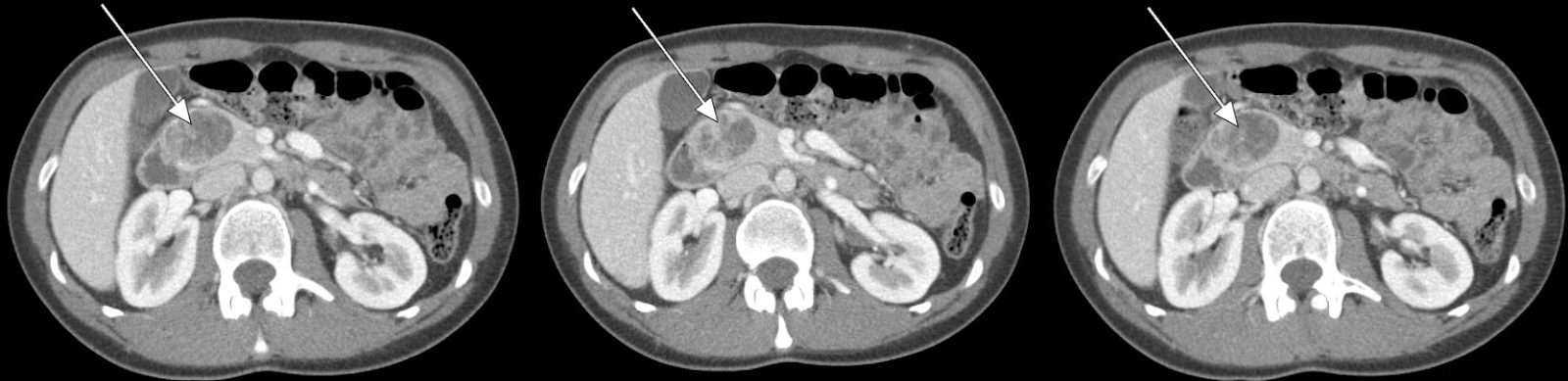
Nosso paciente foi submetido a uma tomografia computadorizada de abdome com contraste de fase arterial que mostrou uma lesão realçada de 3,5 cm na cabeça do pâncreas (Figuras 1, 2). A USE subsequente com biópsia confirmou um tumor neuroendócrino bem diferenciado. A avaliação anatomopatológica adicional constatou que as células tumorais são positivas para cromogranina e CD56, mas com um baixo índice Ki-67 de 3% a 4%, sugerindo um tumor neuroendócrino bem diferenciado.
Os pacientes geralmente se apresentam ao cirurgião já tendo sido submetidos a uma série de estudos radiológicos. A modalidade de imagem mais importante é a TC abdominal trifásica: sem contraste, com contraste de fase arterial e com contraste de fase venosa portal. A ressonância nuclear magnética (RNM) abdominal também pode fornecer informações úteis para diferenciar entre tumores de etiologia incerta. No entanto, os tumores neuroendócrinos pancreáticos (PNETs) têm características muito características nas tomografias computadorizadas que, juntamente com a história e o exame físico do paciente, muitas vezes podem fornecer informações adequadas para recomendações cirúrgicas. 1,2
Os PNETs são tipicamente isodensos com parênquima pancreático visível em imagens pré-contraste. No entanto, os tumores têm realce acentuado na imagem da fase arterial, com uma minoria de tumores também sendo evidente na fase venosa portal. Em raras ocasiões, os PNETS podem ser de natureza hipovascular ou cística, o que diminui a capacidade de discriminar entre outras lesões apenas pela TC. A ultrassonografia endoscópica com biópsia está sendo cada vez mais usada para localizar lesões particularmente pequenas. Embora altamente sensível para lesões menores, a USE também é altamente dependente do operador.
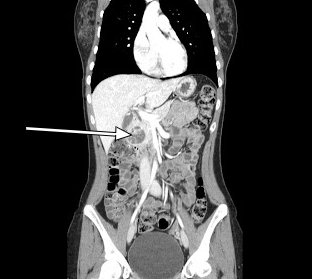
Figura 2. Tomografia computadorizada sagital TC sagital revelando uma lesão realçada de 3,5 cm associada à cabeça do pâncreas.
As manifestações clínicas da síndrome NEM-1 incluem adenomas de paratireoide e hipófise, bem como tumores neuroendócrinos pancreáticos (PNETs). Embora os PNETs representem menos de 3% de todas as neoplasias pancreáticas na população em geral, 30% a 80% dos pacientes com NEM-1 desenvolverão evidências de um tumor neuroendócrino. 3-5 Aproximadamente metade de todas as mortes em pacientes com NEM1 pode ser atribuída a neoplasias endócrinas malignas.
Pacientes com lesões na cabeça do pâncreas provavelmente precisarão de duodenopancreatectomia para obter ressecção oncológica adequada. As variações na reconstrução incluem preservação do piloro, duodenojejunostomia antecólica versus retrocólica (ou gastrojejunostomia) e método de pancreaticojejunostomia. No entanto, essas variações resultaram em pequenas diferenças nos resultados imediatos e de longo prazo. 6-8 Lesões no corpo ou cauda do pâncreas podem ser submetidas a uma pancreatectomia média ou distal, respectivamente. Independentemente do procedimento realizado, a vigilância regular com imagens axiais é necessária devido ao risco contínuo de desenvolver PNET adicional no pâncreas remanescente.
Dado que o paciente tem um tumor neuroendócrino pancreático não funcionante na cabeça do pâncreas, o procedimento de Whipple é a única opção curativa potencial. Optamos por realizar uma duodenopancreatectomia com preservação do piloro porque não foi observada diferença nos resultados em suas variações. 6,7
Aqui apresentamos o caso de uma mulher de 26 anos com MEN-1 e um tumor neuroendócrino pancreático não funcionante na cabeça do pâncreas. Ela foi submetida a uma duodenopancreatectomia sem complicações com preservação do piloro e se recuperou sem complicações adicionais. A patologia final revelou um tumor neuroendócrino bem diferenciado com 0 de 12 linfonodos positivos para malignidade.
Salvo quaisquer complicações intraoperatórias ou comorbidades específicas do paciente, a maioria dos pacientes deve ser extubada na sala de cirurgia. Normalmente, deixamos uma sonda nasogástrica durante a noite e removemos no dia número 1 do pós-operatório. Os drenos de Blake devem ser monitorados quanto ao volume, caráter e teor de amilase. 9 Vários algoritmos foram desenvolvidos para determinar o momento ideal de remoção do dreno. Em última análise, os drenos podem ser removidos se a drenagem for de baixo volume, com baixos níveis de amilase (< 600 U/L) e não for de caráter suspeito. No entanto, se a saída do dreno permanecer em alto volume ou tiver alta concentração de amilase, o(s) dreno(s) deve(m) permanecer no local. Além disso, os cirurgiões devem ter um limiar baixo para refazer a imagem dos pacientes após a cirurgia, caso apresentem sinais de vazamento pancreático descontrolado, incluindo taquicardia, febre, dor abdominal ou leucocitose inexplicável.
O stent pancreático deve permanecer no local até três semanas após a cirurgia, quando pode ser removido na clínica. A dieta do paciente deve ser avançada lentamente conforme tolerado, com cuidado para monitorar o retardo do esvaziamento gástrico.
Na ausência de complicações explícitas, geralmente fornecemos restrições de rotina após a laparotomia, incluindo evitar levantamento de peso por quatro a seis semanas após a cirurgia. Os pacientes geralmente retornam à clínica para acompanhamento duas ou três semanas após a cirurgia (dependendo se um stent pancreático foi usado). Um estudo recente acompanhou dezesseis pacientes com NEM-1 após pancreatectomia para tumores neuroendócrinos não funcionantes. 10 10 desses pacientes desenvolveram novos PNETs após um acompanhamento médio de 74 meses. Independentemente do procedimento específico realizado, os pacientes devem, portanto, fazer acompanhamento com exames axiais de rotina para avaliar a doença recorrente ou metastática.
O procedimento de Whipple continua sendo a única opção para o tratamento curativo de malignidades da cabeça do pâncreas, incluindo tumores neuroendócrinos. A mortalidade pelo procedimento melhorou acentuadamente nas últimas décadas; As taxas de mortalidade perioperatória estão agora < 2% em centros de alto volume. 11 No entanto, taxas de morbidade acima de 40% continuam a atormentar a cirurgia. As fístulas pancreáticas ocorrem em aproximadamente 10-15% dos casos. Trabalhos recentes sugerem que os stents do ducto pancreático externo podem ajudar a reduzir a fístula clinicamente significativa em pacientes de alto risco (aqueles com glândula mole e ducto pancreático pequeno). 12 Embora tenha havido um debate considerável sobre o papel da drenagem por sucção fechada após o procedimento de Whipple, um recente ensaio clínico randomizado e controlado mostrou que a drenagem de rotina também reduz a frequência e a gravidade das complicações pós-operatórias. Vários estudos estão em andamento para identificar estratégias para reduzir a frequência de infecções do sítio cirúrgico que atualmente ocorrem em 8% a 10% desses procedimentos. Dados crescentes sugerem que os antibióticos profiláticos pré-operatórios padrão podem não estar cobrindo adequadamente a flora biliar, que está frequentemente presente após a instrumentação pré-operatória do trato biliar (CPRE, esfincterotomias, stents, etc.). 13 Relatórios preliminares sugerem que os cirurgiões podem considerar adaptar as opções de antibióticos aos microrganismos mais frequentemente vistos em suas respectivas populações. O retardo do esvaziamento gástrico também ocorre em 25% a 30% dos pacientes após duodenopancreatectomia sem associação clara entre preservação do piloro versus Whipple clássico ou duodenojejunostomia antecólica versus retrocólica (ou gastrojejunostomia). 14
Atualização editorial 24/06/2018: A paciente está agora quase 4 anos após a cirurgia, sem evidência de doença recorrente no pâncreas, embora tenha precisado da remoção de um adenoma de paratireoide.
Os equipamentos especiais usados neste procedimento incluem um afastador Bookwalter, um tubo de alimentação pediátrico (3-5 francês), dilatadores e um coagulador de feixe de argônio (opcional).
Nenhum.
O consentimento para o uso da história clínica, radiologia e vídeo intraoperatório foi obtido do paciente e dos profissionais envolvidos na compilação deste relato de caso e filmagem.
References
- Philips S, Shah SN, Vikram R, Verma S, Shanbhogue AKP, Prasad SR. Neoplasias endócrinas pancreáticas: uma atualização atual em genética e imagem. Br J Radiol. 2012; 85(1014):682-696. DOI:10.1259/bjr/85014761.
- Lewis MA, Thompson GB, Young WF Jr. Avaliação pré-operatória do pâncreas na neoplasia endócrina múltipla tipo 1. Mundo J Surg. 2012; 36(6):1375-1381. DOI:10.1007/S00268-012-1539-7.
- Hausman MS Jr, Thompson NW, Gauger PG, Doherty GM. O tratamento cirúrgico da doença neuroendócrina pancreatoduodenal MEN-1. Cirurgia. 2004; 136(6):1205-1211. DOI:10.1016/j.surg.2004.06.049.
- Tonelli F, Fratini G, Nesi G, et al. Pancreatectomia em gastrinomas relacionados a neoplasias endócrinas múltiplas tipo 1 e neoplasias endócrinas pancreáticas. Ann Surg. 2006; 244(1):61-70. DOI:10.1097/01.sla.0000218073.77254.62.
- Lairmore TC, Chen VY, DeBenedetti MK, Gillanders WE, Norton JA, Doherty GM. Ann Surg. 2000; 231(6):909-918. DOI:10.1097%2F00000658-200006000-00016.
- Diener MK, Knaebel HP, Heukaufer C, Antes G, Büchler MW, Seiler CM. Uma revisão sistemática e meta-análise de duodenopancreatectomia com preservação do piloro versus duodenopancreatectomia clássica para tratamento cirúrgico de carcinoma periampular e pancreático. Ann Surg. 2007; 245(2):187-200. DOI:10.1097/01.sla.0000242711.74502.a9.
- Tran KTC, Smeenk HG, van Eijck CHJ, et al. Duodenopancreatectomia com preservação do piloro versus procedimento padrão de Whipple: uma análise prospectiva, randomizada e multicêntrica de 170 pacientes com tumores pancreáticos e periampulares. Ann Surg. 2004; 240(5):738-745. DOI:10.1097/01.sla.0000143248.71964.29.
- Eshuis WJ, van Eijck CHJ, Gerhards MF, et al. Via antecólica versus retrocólica da anastomose gastroentérica após duodenopancreatectomia: um ensaio clínico randomizado controlado. Ann Surg. 2014; 259(1):45-51. DOI:10.1097/SLA.0b013e3182a6f529.
- Van Buren G II, Bloomston M, Hughes SJ, et al. Um estudo multicêntrico prospectivo randomizado de duodenopancreatectomia com e sem drenagem intraperitoneal de rotina. Ann Surg. 2014; 259(4):605-612. DOI:10.1097/SLA.00000000000000460.
- Lopez CL, Waldmann J, Fendrich V, Langer P, Kann PH, Bartsch DK. Resultados a longo prazo da cirurgia para neoplasias neuroendócrinas pancreáticas em pacientes com NEM1. Arco Langenbecks Surg. 2011; 396(8):1187-1196. DOI:10.1007/S00423-011-0828-1.
- Fernández-del Castillo C, Morales-Oyarvide V, McGrath D, et al. Evolução do procedimento de Whipple no Hospital Geral de Massachusetts. Cirurgia. 2012; 152(3)(suppl 1):S56-S63. DOI:10.1016/j.surg.2012.05.022.
- Pessaux P, Sauvanet A, Mariette C, et al. O stent do ducto pancreático externo diminui a taxa de fístula pancreática após duodenopancreatectomia: estudo prospectivo randomizado multicêntrico. Ann Surg. 2011; 253(5):879-885. DOI:10.1097/SLA.0b013e31821219af.
- Donald GW, Dharma S, Lu X, et al. Antibióticos perioperatórios para infecção de sítio cirúrgico na duodenopancreatectomia: o esquema aprovado pelo SCIP oferece cobertura adequada? Cirurgia. 2013; 154(2):190-196. DOI:10.1016/j.surg.2013.04.001.
- Kawai M, Tani M, Hirono S, et al. A ressecção do anel piloro reduz o retardo do esvaziamento gástrico em pacientes submetidos à duodenopancreatectomia pancreato: um estudo prospectivo, randomizado e controlado de ressecção do piloro versus duodenopancreatectomia com preservação do piloro. Ann Surg. 2011; 253(3):495-501. DOI:10.1097/SLA.0b013e31820d98f1.
Cite this article
Lillemoe K, Loehrer A. Procedimento de Whipple para neoplasia endócrina múltipla do pâncreas. J Med Insight. 2018; 2018(16). DOI:10.24296/jomi/16.