Procedura di Whipple per neoplasia endocrina multipla del pancreas
Main Text
Table of Contents
La neoplasia endocrina multipla di tipo 1 (MEN-1) è una condizione ereditaria autosomica dominante rara con una frequenza stimata di 1:30.000 nella popolazione generale. Il 35% al 75% dei pazienti con MEN-1 sviluppa infine tumori neuroendocrini del pancreas, che rappresentano la minaccia più significativa per la sopravvivenza a lungo termine. La pancreatectomia rimane l'unica terapia curativa per questi pazienti ed è diventata sempre più sicura negli ultimi decenni. Qui presentiamo il caso di una giovane donna con MEN-1 che è stato trovato con un tumore neuroendocrino pancreatico ben differenziato di 3,5 cm nella testa del pancreas. Descriviamo la storia naturale, le cure preoperatorie, la tecnica intraoperatoria e le considerazioni post-operatorie.
La sindrome MEN-1 è una sindrome ereditaria autosomica dominante correlata a mutazioni inattivanti nella proteina soppressrice del tumore menin. Purtroppo, la sindrome di MEN-1 si verifica nella popolazione generale con una frequenza stimata di 1:30.000, e dal 35%-75% delle persone con questa condizione sviluppano tumori neuroendocrini del pancreas.
La nostra paziente è una donna di 26 anni con una storia nota di MEN-1 nei familiari stretti. Era stata in ottima salute fino allo sviluppo di mal di testa e lattazione, senza alcun dolore o disagio addominale, perdita di peso o sintomi di ipoglicemia. L'esame ha rivelato un adenoma ipofisario che è stato infine trattato con cabergolina con una risoluzione dei sintomi. Le successive analisi per ulteriori tumori correlati a MEN-1 hanno incluso una risonanza magnetica e una TAC che hanno rivelato una massa di 3,5 cm nella testa del pancreas. Il nostro paziente si è poi presentato per una valutazione chirurgica del tumore neuroendocrino della testa pancreasica.
Non ha precedenti precedenti medici o chirurgici addominali. Il suo unico farmaco al momento della presentazione è la cabergolina, e beve solo occasionalmente un bicchiere di vino. La storia della sua famiglia è notevole per MEN-1; sua nonna materna aveva un tumore al pancreas e si sottopose alla procedura di Whipple all'età di 50 anni. Suo padre e due zii hanno tumori al pancreas e alla paratiroide.
L'esame fisico ha rivelato una giovane donna dall'aspetto sano, con un polso di 80 bpm e una pressione sanguigna di 110/80 mmHg. Non ha ictere sclerale, né linfoadenopatia cervicale né sovraclavicolare. Non ha masse palpabili nella tiroide. I suoi polmoni sono chiari all'auscultazione bilaterale e il suo cuore ha frequenza e ritmo regolari senza soffio. Il suo addome è morbido, non tenero, non disteso e senza masse palpabili, splenomegalia, epatomegalia o ascite. Anche gli esami della pelle e degli arti non presentano anomalie focali.
Il nostro paziente ha subito una TAC addominale con contrasto di fase arteriosa che ha mostrato una lesione di 3,5 cm di aumento nella testa del pancreas (Figuri 1, 2). L'EUS successiva con biopsia ha confermato un tumore neuroendocrino ben differenziato. Ulteriori valutazioni patologiche hanno rilevato che le cellule tumorali erano positive per cromogranina e CD56 ma con un basso indice Ki-67 del 3%-4%, suggerendo un tumore neuroendocrino ben differenziato.
I pazienti spesso si presentano al chirurgo avendo già subito una serie di studi radiologici. La modalità di imaging più importante è la TAC addominale trifase: senza contrasto, con contrasto arterioso-fase e con contrasto di fase portal-venosa. La risonanza magnetica addominale può anche fornire informazioni utili per differenziare tumori di eziologia incerta. Tuttavia, i tumori neuroendocrini pancreatici (PNET) presentano caratteristiche molto caratteristiche nelle TAC che, unite all'anamnesi e alla fisica del paziente, possono spesso fornire informazioni adeguate per raccomandazioni chirurgiche. 1,2
I PNET sono tipicamente isodensi con parenchima pancreatico visibile nelle immagini pre-contrasto. Tuttavia, i tumori presentano un netto miglioramento nell'imaging della fase arteriosa, con una minoranza di tumori evidente anche nella fase venosa porta. In rare occasioni, i PNETS possono essere di natura ipovascolare o cistica, il che riduce la capacità di distinguere tra altre lesioni solo tramite la TAC. L'ecografia endoscopica con biopsia viene sempre più utilizzata per localizzare lesioni particolarmente piccole. Sebbene altamente sensibile per lesioni minori, l'EUS è anche molto dipendente dall'operatore.
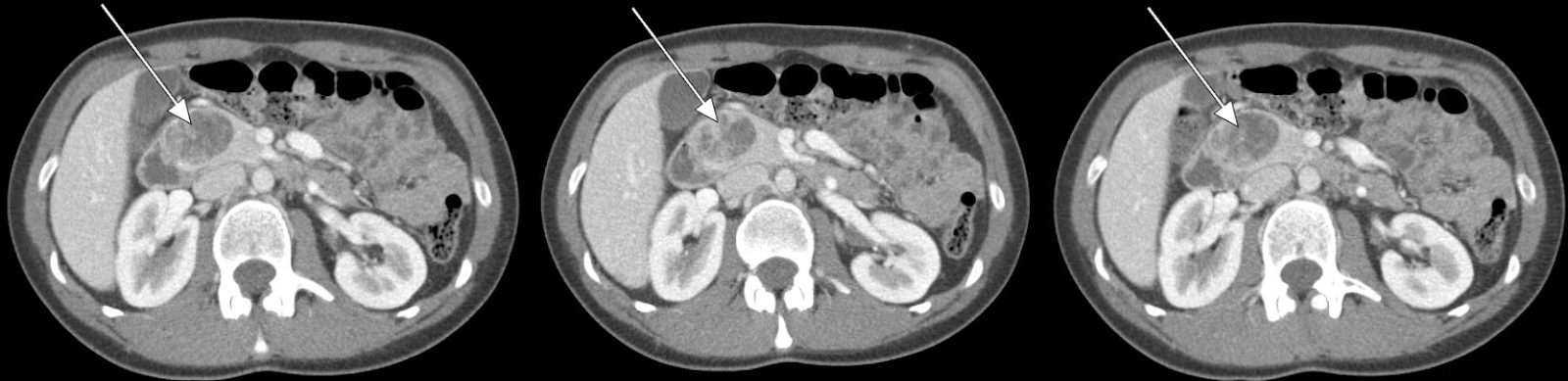
Figura 1. TAC addominale La TAC addominale ha rivelato una lesione di 3,5 cm di potenziamento associata alla testa del pancreas.
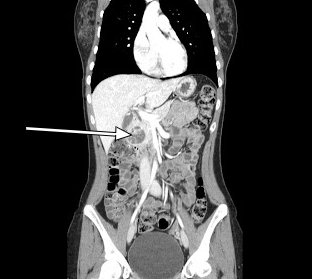
Figura 2. TAC sagittale La TAC sagittale rivela una lesione di 3,5 cm di potenziamento associata alla testa del pancreas.
Le manifestazioni cliniche della sindrome MEN-1 includono adenomi paratiroidei e ipofisari, oltre a tumori neuroendocrini pancreatici (PNET). Sebbene le PNET rappresentino meno del 3% di tutte le neoplasie pancreatiche nella popolazione generale, il 30%–80% dei pazienti con MEN-1 svilupperà evidenza di un tumore neuroendocrino. 3-5 Circa la metà dei decessi nei pazienti con MEN-1 può essere attribuita a neoplasie endocrine maligne.
I pazienti con lesioni nella testa del pancreas probabilmente necessiteranno di una pancreaticoduodenectomia per ottenere una resezione oncologica adeguata. Le variazioni nella ricostruzione includono la conservazione del piloro, la duodenojegiunostomia antecolica vs retrocolica (o gastrojegiunostomia) e il metodo della pancreaticojegiunostomia. Tuttavia, queste variazioni hanno portato a poche differenze negli esiti immediati e a lungo termine. 6-8 Lesioni nel corpo o nella coda del pancreas possono essere sottoposte rispettivamente a una pancreatectomia media o distale. Indipendentemente dalla procedura eseguita, è necessaria una sorveglianza regolare con imaging assiale dato il rischio continuo di sviluppare ulteriore PNET nel pancreas residuo.
Dato che il paziente presenta un tumore neuroendocrino pancreatico non funzionante alla testa del pancreas, la procedura di Whipple è l'unica opzione curativa potenziale. Abbiamo scelto di eseguire una pancreaticoduodenectomia preservativa del pilore perché non sono state osservate differenze negli esiti nelle sue variazioni. 6,7
Qui presentiamo il caso di una donna di 26 anni con MEN-1 e un tumore neuroendocrino pancreatico non funzionante alla testa del pancreas. Ha subito una pancreaticoduodenectomia senza complicazioni che preserva il pilore e si è ripresa senza ulteriori complicazioni. La patologia finale ha rivelato un tumore neuroendocrino ben differenziato con 0 su 12 linfonodi positivi a malignità.
Salvo complicazioni intraoperatorie o specifiche comorbidità del paziente, la maggior parte dei pazienti dovrebbe essere estubata in sala operatoria. Di solito lasciamo un sondino nasogastrico tutta la notte e lo rimuoviamo il primo giorno postoperatorio. I drenaggi Blake dovrebbero essere monitorati per volume, carattere e contenuto di amilasi. 9 Sono stati sviluppati diversi algoritmi per determinare il momento ottimale per la rimozione dei drenaggi. In definitiva, gli scarichi possono essere rimossi se il drenaggio è a basso volume, con bassi livelli di amilasi (< 600 U/L) e non sospetto. Tuttavia, se l'output di drenaggio rimane ad alto volume o presenta un'alta concentrazione di amilasi, i dreni dovrebbero rimanere al loro posto. Inoltre, i chirurghi dovrebbero avere una soglia bassa per riimporre i pazienti dopo l'intervento nel caso in cui presentino segni di perdita pancreatica incontrollata, tra cui tachicardia, febbre, dolore addominale o leucocitosi inspiegabile.
Lo stent pancreatico dovrebbe rimanere al suo posto fino a tre settimane dopo l'intervento, momento in cui potrà essere rimosso in clinica. La dieta del paziente dovrebbe essere avanzata lentamente secondo tolleranza, con attenzione a monitorare eventuali ritardi nello svuotamento gastrico.
In assenza di complicazioni esplicite, di solito prevediamo restrizioni di routine dopo la laparotomia, tra cui evitare di sollevare pesanti per quattro o sei settimane dopo l'intervento. I pazienti di solito tornano in clinica per un controllo due o tre settimane dopo l'intervento (a seconda che sia stato utilizzato o meno uno stent pancreatico). Uno studio recente ha seguito sedici pazienti con MEN-1 dopo una pancreatectomia per tumori neuroendocrini non funzionanti. 10-10 di questi pazienti hanno sviluppato nuovi PNETs dopo un follow-up mediano di 74 mesi. Indipendentemente dalla procedura specifica eseguita, i pazienti dovrebbero quindi effettuare un controllo di imaging assiale di routine per valutare la presenza di malattie ricorrenti o metastatiche.
La procedura di Whipple rimane l'unica opzione per il trattamento curativo delle neoplasie del pancreas cranico, inclusi i tumori neuroendocrini. La mortalità dovuta alla procedura è migliorata notevolmente negli ultimi decenni; I tassi di mortalità perioperatoria sono ora < 2% nei centri ad alto volume. 11 Tuttavia, i tassi di morbilità superiori al 40% continuano a affliggere l'intervento. Le fistole pancreatiche si verificano in circa il 10-15% dei casi. Studi recenti suggeriscono che gli stent esterni del dotto pancreatico possono aiutare a ridurre la fistola clinicamente significativa nei pazienti ad alto rischio (quelli con ghiandola molle e dotto pancreatico piccolo). 12 Sebbene ci sia stato un notevole dibattito sul ruolo del drenaggio a aspirazione chiusa dopo la procedura di Whipple, un recente studio controllato randomizzato ha mostrato che il drenaggio di routine riduce anche la frequenza e la gravità delle complicanze post-operatorie. Sono in corso diversi studi per individuare strategie volte a ridurre la frequenza delle infezioni del sito chirurgico che attualmente si verificano nell'8%–10% di queste procedure. Dati sempre più numerosi suggeriscono che gli antibiotici profilattici preoperatori standard potrebbero non coprire adeguatamente la flora biliare, che è frequentemente presente dopo l'uso preoperatorio di strumenti delle vie biliari (CPRE, sfinterotomie, stent, ecc.). 13 Rapporti preliminari suggeriscono che i chirurghi potrebbero considerare di adattare le scelte di antibiotici ai microrganismi più frequentemente osservati nelle rispettive popolazioni. Lo svuotamento gastrico ritardato si verifica anche nel 25%–30% dei pazienti dopo pancreaticoduodenectomia, senza una chiara associazione tra preservazione del piloro vs Whipple classica o duodenojegiunostomia antecolica vs retrocolica. 14
Aggiornamento editoriale 24/06/2018: La paziente è ora a quasi 4 anni dall'intervento chirurgico senza segni di recidiva nel pancreas, anche se ha richiesto la rimozione di un adenoma paratiroideo.
Apparecchiature speciali utilizzate in questa procedura includono un retrattore Bookwalter, un tubo di alimentazione pediatrico (3-5 francesi), dilatatori e un coagulatore a fascio di argon (opzionale).
Nessuno.
Il consenso per l'uso della storia clinica, della radiologia e del video intraoperatorio è stato ottenuto dal paziente e dai medici coinvolti nella compilazione di questo rapporto e nelle riprese.
References
- Philips S, Shah SN, Vikram R, Verma S, Shanbhogue AKP, Prasad SR. Neoplasie endocrine pancreatiche: aggiornamento attuale su genetica e imaging. Br J Radiol. 2012; 85(1014):682-696. doi:10.1259/bjr/85014761.
- Lewis MA, Thompson GB, Young WF Jr. Valutazione preoperatoria del pancreas nella neoplasia endocrina multipla di tipo 1. World J Surg. 2012; 36(6):1375-1381. doi:10.1007/s00268-012-1539-7.
- Hausman MS Jr, Thompson NW, Gauger PG, Doherty GM. La gestione chirurgica della malattia neuroendocrina pancreatoduodenale MEN-1. Intervento chirurgico. 2004; 136(6):1205-1211. doi:10.1016/j.surg.2004.06.049.
- Tonelli F, Fratini G, Nesi G, et al. Pancreatectomia in neoplastie endocrine multiple di tipo 1 correlati e neoplasie endocrine pancreatiche. Ann Surg. 2006; 244(1):61-70. doi:10.1097/01.sla.0000218073.77254.62.
- Lairmore TC, Chen VY, DeBenedetti MK, Gillanders WE, Norton JA, Doherty GM. Resezioni duodenopancreatiche in pazienti con neoplasia endocrina multipla di tipo 1. Ann Surg. 2000; 231(6):909-918. doi:10.1097%2F00000658-200006000-00016.
- Diener MK, Knaebel HP, Heukaufer C, Antes G, Büchler MW, Seiler CM. Una revisione sistematica e meta-analisi della preservazione del piloro rispetto alla classica pancreaticoduodenectomia per il trattamento chirurgico del carcinoma periampullare e pancreatico. Ann Surg. 2007; 245(2):187-200. doi:10.1097/01.sla.0000242711.74502.a9.
- Tran KTC, Smeenk HG, van Eijck CHJ, et al. Pylorus che preserva pancreaticoduodenectomia rispetto alla procedura standard di Whipple: un'analisi prospettica, randomizzata e multicentrica di 170 pazienti con tumori pancreati e periampullari. Ann Surg. 2004; 240(5):738-745. doi:10.1097/01.sla.0000143248.71964.29.
- Eshuis WJ, van Eijck CHJ, Gerhards MF, e altri. Percorso antecolico versus retrocolico dell'anastomosi gastroenterica dopo pancreatoduodenectomia: uno studio controllato randomizzato. Ann Surg. 2014; 259(1):45-51. doi:10.1097/SLA.0b013e3182a6f529.
- Van Buren G II, Bloomston M, Hughes SJ, e altri. Uno studio randomizzato prospettico multicentrico sulla pancreaticoduodenectomia con e senza drenaggio intraperitoneale di routine. Ann Surg. 2014; 259(4):605-612. doi:10.1097/SLA.0000000000000460.
- Lopez CL, Waldmann J, Fendrich V, Langer P, Kann PH, Bartsch DK. Risultati a lungo termine dell'intervento chirurgico per neoplasie neuroendocrine pancreatiche in pazienti con MEN1. Langenbecks Archichiurgia. 2011; 396(8):1187-1196. doi:10.1007/s00423-011-0828-1.
- Fernández-del Castillo C, Morales-Oyarvide V, McGrath D, e altri. Evoluzione della procedura di Whipple al Massachusetts General Hospital. Intervento chirurgico. 2012; 152(3)(supplemento 1):S56-S63. doi:10.1016/j.surg.2012.05.022.
- Pessaux P, Sauvanet A, Mariette C, et al. Stent del dotto pancreatico esterno riduce il tasso di fistola pancreatica dopo pancreaticoduodenectomia: studio randomizzato multicentrico prospettico. Ann Surg. 2011; 253(5):879-885. doi:10.1097/SLA.0b013e31821219af.
- Donald GW, Dharma S, Lu X, e altri. Antibiotici perioperatori per infezioni del sito chirurgico nella pancreaticoduodenectomia: il regime approvato da SCIP offre una copertura adeguata? Intervento chirurgico. 2013; 154(2):190-196. doi:10.1016/j.surg.2013.04.001.
- Kawai M, Tani M, Hirono S, e altri. La resezione dell'anello del piloro riduce lo svuotamento gastrico ritardato nei pazienti sottoposti a pancreatoduodenectomia: uno studio prospettico, randomizzato e controllato che consiste in pancreatoduodenectomia che preserva il piloro. Ann Surg. 2011; 253(3):495-501. doi:10.1097/SLA.0b013e31820d98f1.
Cite this article
Lillemoe K, Loehrer A. Procedura di Whipple per neoplasia endocrina multipla del pancreas. J Med Insight. 2018; 2018(16). doi:10.24296/jomi/16.


