Procédure de Whipple pour la néoplasie endocrinienne multiple du pancréas
Main Text
Table of Contents
La néoplasie endocrinienne multiple de type 1 (NEM-1) est une maladie héréditaire autosomique dominante peu fréquente dont la fréquence est estimée à 1:30 000 dans la population générale. 35 à 75 % des patients atteints de NEM-1 développent finalement des tumeurs neuroendocrines du pancréas, qui représentent la menace la plus importante pour la survie à long terme. La pancréatectomie reste la seule thérapie curative pour ces patients et est devenue de plus en plus sûre au cours des dernières décennies. Nous présentons ici le cas d’une jeune femme atteinte de NEM-1 qui présentait une tumeur neuroendocrine pancréatique bien différenciée de 3,5 cm dans la tête du pancréas. Nous décrivons l’histoire naturelle, les soins préopératoires, la technique peropératoire et les considérations postopératoires.
Le syndrome MEN-1 est un syndrome héréditaire autosomique dominant lié à des mutations inactivatrices de la protéine suppresseur de tumeur ménine. Malheureusement, le syndrome MEN-1 se produit dans la population générale avec une fréquence estimée à 1:30 000, et 35 % à 75 % des personnes atteintes de la maladie développent des tumeurs neuroendocrines du pancréas.
Notre patiente est une femme de 26 ans avec des antécédents connus de NEM-1 chez des membres de la famille immédiate. Elle était en excellente santé jusqu’à l’apparition de maux de tête et d’allaitement sans aucune douleur ou inconfort abdominal, perte de poids ou symptômes d’hypoglycémie. Le bilan a révélé un adénome hypophysaire qui a finalement été traité avec de la cabergoline avec une résolution des symptômes. Les recherches ultérieures pour d’autres tumeurs liées à la NEM-1 comprenaient une IRM et une tomodensitométrie qui ont révélé une masse de 3,5 cm dans la tête du pancréas. Notre patient s’est ensuite présenté pour une évaluation chirurgicale de la tumeur neuroendocrine de la tête pancréatique.
Elle n’a pas d’antécédents médicaux ou de chirurgie abdominale. Son seul médicament au moment de la présentation est la cabergoline, et elle ne boit qu’un verre de vin de temps en temps. Ses antécédents familiaux sont remarquables pour MEN-1 ; sa grand-mère maternelle avait une tumeur au pancréas et a subi une procédure de Whipple à l’âge de 50 ans. Son père et ses deux oncles ont des tumeurs pancréatiques et parathyroïdiennes.
L’examen physique a révélé une jeune femme d’apparence saine, avec un pouls de 80 bpm et une tension artérielle de 110/80 mmHg. Elle n’a pas d’ictère scléral, ni de lymphadénopathie cervicale, ni de lymphadénopathie supraclaviculaire. Elle n’a pas de masses palpables dans la thyroïde. Ses poumons sont dégagés pour l’auscultation bilatérale, et son cœur a un rythme régulier sans souffle. Son abdomen est mou, non sensible, non distendu et sans masses palpables, splénomégalie, hépatomégalie ou ascite. Les examens de la peau et des extrémités sont également sans aucune anomalie focale.
Notre patient a subi une tomodensitométrie abdominale avec contraste de phase artérielle qui a montré une lésion de 3,5 cm dans la tête du pancréas (Figures 1, 2). L’EUS ultérieure avec biopsie a confirmé une tumeur neuroendocrine bien différenciée. Une évaluation pathologique supplémentaire a révélé que les cellules tumorales étaient positives pour la chromogranine et CD56, mais avec un faible indice Ki-67 de 3 % à 4 %, suggérant une tumeur neuroendocrine bien différenciée.
Les patients se présentent souvent à leur chirurgien après avoir déjà subi une série d’études radiologiques. La modalité d’imagerie la plus importante est une tomodensitométrie abdominale en trois phases : sans contraste, avec contraste de phase artérielle et avec contraste de phase veineuse porte. L’IRM abdominale peut également fournir des informations utiles pour différencier les tumeurs d’étiologie incertaine. Cependant, les tumeurs neuroendocrines pancréatiques (PNET) présentent des caractéristiques très caractéristiques sur les tomodensitogrammes qui, associées aux antécédents et à l’état physique du patient, peuvent souvent fournir des informations adéquates pour les recommandations chirurgicales. 1,2
Les PNET sont généralement isodenses avec un parenchyme pancréatique visible sur les images pré-contraste. Cependant, les tumeurs ont une nette amélioration à l’imagerie de la phase artérielle, une minorité de tumeurs étant également évidentes en phase veineuse porte. En de rares occasions, les TNE peuvent être de nature hypovasculaire ou kystique, ce qui diminue la capacité d’une personne à faire la distinction entre les autres lésions par TDM seule. L’échographie endoscopique avec biopsie est de plus en plus utilisée pour localiser des lésions particulièrement petites. Bien que très sensible pour les petites lésions, l’EUS dépend également fortement de l’opérateur.
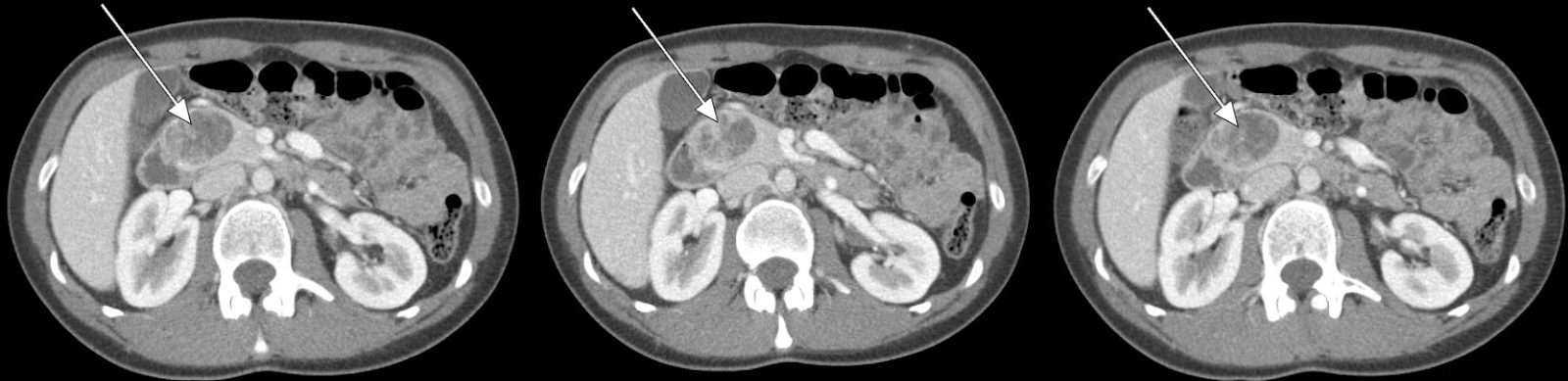
Graphique 1. TDM abdominale La TDM abdominale révèle une lésion rehaussante de 3,5 cm associée à la tête du pancréas.
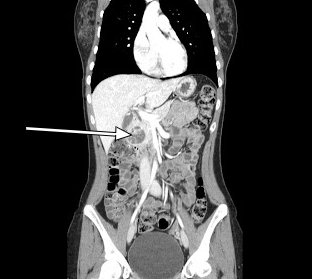
Graphique 2. Sifftal CT Scan Sagittal CT révélant une lésion rehaussante de 3,5 cm associée à la tête du pancréas.
Les manifestations cliniques du syndrome MEN-1 comprennent des adénomes parathyroïdiens et hypophysaires ainsi que des tumeurs neuroendocrines pancréatiques (PNET). Bien que les PNET représentent moins de 3 % de tous les néoplasmes pancréatiques dans la population générale, 30 à 80 % des patients atteints de NEM-1 développeront des signes d’une tumeur neuroendocrine. 3-5 Environ la moitié de tous les décès chez les patients atteints de NEM-1 peuvent être attribués à des néoplasmes endocriniens malins.
Les patients présentant des lésions à la tête du pancréas auront très probablement besoin d’une pancréaticoduodénectomie pour obtenir une résection oncologique adéquate. Les variations dans la reconstruction comprennent la préservation du pylore, la duodénojéjunostomie antécolique ou rétrocolique (ou gastrojéjunostomie) et la méthode de pancréaticojéjunostomie. Cependant, ces variations ont entraîné de petites différences dans les résultats immédiats et à long terme. 6-8 Les lésions du corps ou de la queue du pancréas peuvent subir une pancréatectomie moyenne ou distale, respectivement. Quelle que soit l’intervention pratiquée, une surveillance régulière par imagerie axiale est nécessaire compte tenu du risque continu de développer un PNET supplémentaire dans le pancréas restant.
Étant donné que le patient a une tumeur neuroendocrine pancréatique non fonctionnelle à la tête du pancréas, la procédure de Whipple est la seule option curative potentielle. Nous avons choisi de réaliser une pancréaticoduodénectomie préservant le pylore car aucune différence dans les résultats n’a été observée dans ses variations. 6,7
Nous présentons ici le cas d’une femme de 26 ans atteinte d’une NEM-1 et d’une tumeur neuroendocrine pancréatique non fonctionnelle à la tête du pancréas. Elle a subi une pancréaticoduodénectomie non compliquée et s’est rétablie sans aucune complication supplémentaire. La pathologie finale a révélé une tumeur neuroendocrine bien différenciée avec 0 des 12 ganglions lymphatiques positifs pour la malignité.
À moins de complications peropératoires ou de comorbidités spécifiques au patient, la plupart des patients doivent être extubés en salle d’opération. Nous laissons généralement une sonde nasogastrique pendant la nuit et la retirons le jour postopératoire numéro 1. Le volume, le caractère et la teneur en amylase des drains Blake doivent être surveillés. 9 Plusieurs algorithmes ont été mis au point pour déterminer le moment optimal pour l’enlèvement du drain. En fin de compte, les drains peuvent être éliminés si le drainage est de faible volume, avec de faibles niveaux d’amylase (< 600 U/L) et est de nature non suspecte. Cependant, si le débit du drain reste élevé ou a une forte concentration d’amylase, le ou les drains doivent rester en place. De plus, les chirurgiens doivent avoir un seuil bas pour réimager les patients après la chirurgie s’ils montrent des signes de fuite pancréatique incontrôlée, notamment une tachycardie, de la fièvre, des douleurs abdominales ou une leucocytose inexpliquée.
L’endoprothèse pancréatique doit rester en place jusqu’à trois semaines postopératoires, après quoi elle peut être retirée en clinique. Le régime alimentaire du patient doit être lentement avancé selon la tolérance, en prenant soin de surveiller le retard de la vidange gastrique.
En l’absence de complications explicites, nous imposons généralement des restrictions de routine après la laparotomie, notamment en évitant de soulever des objets lourds pendant quatre à six semaines après la chirurgie. Les patients retournent généralement à la clinique pour un suivi deux ou trois semaines après la chirurgie (selon qu’une endoprothèse pancréatique a été utilisée ou non). Une étude récente a suivi seize patients atteints de MEN-1 après une pancréatectomie pour des tumeurs neuroendocrines non fonctionnelles. 10 10 de ces patients ont développé de nouveaux PNET après un suivi médian de 74 mois. Quelle que soit la procédure spécifique effectuée, les patients doivent donc faire un suivi par imagerie axiale de routine pour évaluer la présence d’une maladie récurrente ou métastatique.
La procédure de Whipple reste la seule option pour le traitement curatif des tumeurs malignes de la tête pancréatique, y compris les tumeurs neuroendocrines. La mortalité due à la procédure s’est nettement améliorée au cours des dernières décennies ; Les taux de mortalité périopératoire sont maintenant < de 2 % dans les centres à fort volume. 11 Cependant, des taux de morbidité supérieurs à 40 % continuent d’affecter la chirurgie. Les fistules pancréatiques surviennent dans environ 10 à 15 % des cas. Des travaux récents suggèrent que les endoprothèses du canal pancréatique externe peuvent aider à réduire la fistule cliniquement significative chez les patients à haut risque (ceux qui ont une glande molle et un petit canal pancréatique). 12 Bien qu’il y ait eu un débat considérable sur le rôle du drainage par aspiration fermée après la procédure de Whipple, un récent essai contrôlé randomisé a montré que le drainage régulier réduit également la fréquence et la gravité des complications postopératoires. De nombreuses études sont en cours pour identifier des stratégies visant à réduire la fréquence des infections du site opératoire qui se produisent actuellement dans 8 à 10 % de ces procédures. De plus en plus de données suggèrent que les antibiotiques prophylactiques préopératoires standard pourraient ne pas couvrir adéquatement la flore biliaire, qui est fréquemment présente après l’instrumentation préopératoire des voies biliaires (CPRE, sphinctérotomies, endoprothèses, etc.). 13 Des rapports préliminaires suggèrent que les chirurgiens pourraient envisager d’adapter les choix d’antibiotiques aux micro-organismes les plus fréquemment observés dans leurs populations respectives. Une vidange gastrique retardée se produit également chez 25 à 30 % des patients après une pancréaticoduodénectomie, sans association claire entre la préservation du pylore et la Whipple classique ou la duodénojéjunostomie antécolique et rétrocolique (ou gastrojéjunostomie). 14
Mise à jour éditoriale 24/06/2018 : La patiente est maintenant près de 4 ans après l’opération et ne présente aucun signe de maladie récurrente dans son pancréas, bien qu’elle ait eu besoin de l’ablation d’un adénome parathyroïdien.
Les pièces d’équipement spéciales utilisées dans cette procédure comprennent un écarteur Bookwalter, une sonde d’alimentation pédiatrique (3-5 français), des dilatateurs et un coagulateur à faisceau d’argon (facultatif).
Aucun.
Le consentement à l’utilisation de l’anamnèse, de la radiologie et de la vidéo peropératoire a été obtenu du patient et des prestataires impliqués dans la compilation de ce rapport de cas et le tournage.
References
- Philips S, Shah SN, Vikram R, Verma S, Shanbhogue AKP, Prasad SR. Néoplasmes endocriniens pancréatiques : une mise à jour actuelle sur la génétique et l’imagerie. F. J. Radiol. 2012; 85(1014):682-696. doi :10.1259/bjr/85014761.
- Lewis MA, Thompson GB, Young WF Jr. Évaluation préopératoire du pancréas dans la néoplasie endocrinienne multiple de type 1. Monde J Surg. 2012; 36(6):1375-1381. doi :10.1007/s00268-012-1539-7.
- Hausman MS Jr, Thompson NW, Gauger PG, Doherty GM. La prise en charge chirurgicale de la maladie neuroendocrinienne pancréatoduodénale MEN-1. Chirurgie. 2004; 136(6):1205-1211. doi :10.1016/j.surg.2004.06.049.
- Tonelli F, Fratini G, Nesi G, et al. Pancréatectomie dans les néoplasies endocriniennes multiples, les gastrinomes de type 1 et les néoplasies endocriniennes pancréatiques. Ann Surg. 2006; 244(1):61-70. doi :10.1097/01.sla.0000218073.77254.62.
- Lairmore TC, Chen VY, DeBenedetti MK, Gillanders WE, Norton JA, Doherty GM. Résections duodénopancréatiques chez les patients atteints de néoplasie endocrinienne multiple de type 1. Ann Surg. 2000; 231(6):909-918. doi :10.1097%2F00000658-200006000-00016.
- Diener MK, Knaebel HP, Heukaufer C, Antes G, Büchler MW, Seiler CM. Une revue systématique et une méta-analyse de la pancréaticoduodénectomie classique par rapport à la pancréaticoduodénectomie classique pour le traitement chirurgical du carcinome périampullaire et pancréatique. Ann Surg. 2007; 245(2):187-200. doi :10.1097/01.sla.0000242711.74502.a9.
- Tran KTC, Smeenk HG, van Eijck CHJ, et al. Pancréaticoduodénectomie préservant le pylore par rapport à la procédure de Whipple standard : une analyse prospective, randomisée et multicentrique de 170 patients atteints de tumeurs pancréatiques et périampullaires. Ann Surg. 2004; 240(5):738-745. doi :10.1097/01.sla.0000143248.71964.29.
- Eshuis WJ, van Eijck CHJ, Gerhards MF, et al. Voie antéricolique versus rétrocolique de l’anastomose gastro-entérique après pancréatoduodénectomie : un essai contrôlé randomisé. Ann Surg. 2014; 259(1):45-51. doi :10.1097/SLA.0b013e3182a6f529.
- Van Buren G II, Bloomston M, Hughes SJ, et al. Un essai multicentrique prospectif randomisé sur la pancréaticoduodénectomie avec et sans drainage intrapéritonéal de routine. Ann Surg. 2014; 259(4):605-612. doi :10.1097/SLA.000000000000460.
- Lopez CL, Waldmann J, Fendrich V, Langer P, Kann PH, Bartsch DK. Résultats à long terme de la chirurgie des néoplasmes neuroendocriniens pancréatiques chez les patients atteints de NEM1. Langenbecks Arch Surg. 2011; 396(8):1187-1196. doi :10.1007/s00423-011-0828-1.
- Fernández-del Castillo C, Morales-Oyarvide V, McGrath D, et al. Évolution de la procédure de Whipple au Massachusetts General Hospital. Chirurgie. 2012; 152(3)(suppl 1) :S56 à S63. doi :10.1016/j.surg.2012.05.022.
- Pessaux P, Sauvanet A, Mariette C, et al. L’endoprothèse du canal pancréatique externe diminue le taux de fistule pancréatique après une pancréaticoduodénectomie : essai randomisé multicentrique prospectif. Ann Surg. 2011; 253(5):879-885. doi :10.1097/SLA.0b013e31821219af.
- Donald GW, Dharma S, Lu X, et al. Antibiotiques périopératoires pour l’infection du site opératoire dans la pancréaticoduodénectomie : le schéma approuvé par le SCIP offre-t-il une couverture adéquate ? Chirurgie. 2013; 154(2):190-196. doi :10.1016/j.surg.2013.04.001.
- Kawai M, Tani M, Hirono S, et al. La résection en anneau du pylore réduit la vidange gastrique retardée chez les patients subissant une pancréatoduodénectomie : un essai prospectif, randomisé et contrôlé comparant la résection du pylore à la pancréatoduodénectomie préservant le pylore. Ann Surg. 2011; 253(3):495-501. doi :10.1097/SLA.0b013e31820d98f1.
Cite this article
Lillemoe K, Loehrer A. Procédure de Whipple pour la néoplasie endocrinienne multiple du pancréas. J Med Insight. 2018; 2018(16). doi :10.24296/jomi/16.


