Procedimiento de Whipple para la neoplasia endocrina múltiple del páncreas
Main Text
Table of Contents
La neoplasia endocrina múltiple tipo 1 (NEM-1) es una afección hereditaria autosómica dominante poco frecuente con una frecuencia estimada de 1:30.000 en toda la población general. El 35% -75% de los pacientes con MEN-1 finalmente desarrollan tumores neuroendocrinos del páncreas, que presentan la amenaza más significativa para la supervivencia a largo plazo. La pancreatectomía sigue siendo la única terapia curativa para estos pacientes y se ha vuelto cada vez más segura en las últimas décadas. Aquí presentamos el caso de una mujer joven con MEN-1 que se encontró que tenía un tumor neuroendocrino pancreático bien diferenciado de 3,5 cm en la cabeza del páncreas. Describimos la historia natural, la atención preoperatoria, la técnica intraoperatoria y las consideraciones postoperatorias.
El síndrome MEN-1 es un síndrome hereditario autosómico dominante relacionado con mutaciones inactivadoras en la proteína supresora de tumores menina. Desafortunadamente, el síndrome MEN-1 ocurre en la población general con una frecuencia estimada de 1: 30,000, y el 35% -75% de las personas con la afección desarrollan tumores neuroendocrinos del páncreas.
Nuestra paciente es una mujer de 26 años con antecedentes conocidos de MEN-1 en familiares directos. Ella había estado en gran salud hasta el desarrollo de dolor de cabeza y lactancia sin ningún dolor abdominal o malestar, pérdida de peso o síntomas de hipoglucemia. El estudio reveló un adenoma hipofisario que finalmente se trató con cabergolina con una resolución de los síntomas. El estudio posterior para tumores adicionales relacionados con MEN-1 incluyó estudios de resonancia magnética y tomografía computarizada que revelaron una masa de 3,5 cm en la cabeza del páncreas. A continuación, nuestro paciente se sometió a evaluación quirúrgica del tumor neuroendocrino de la cabeza pancreática.
No tiene antecedentes médicos o quirúrgicos abdominales. Su único medicamento en el momento de la presentación es la cabergolina, y solo bebe una copa de vino ocasional. Su historia familiar es notable para MEN-1; su abuela materna tenía un tumor pancreático y se sometió al procedimiento de Whipple a los 50 años. Su padre y dos tíos tienen tumores pancreáticos y paratiroideos.
El examen físico reveló una joven de apariencia saludable con un pulso de 80 lpm y presión arterial de 110/80 mmHg. No tiene icterus escleral, ni linfadenopatía cervical ni supraclavicular. No tiene masas palpables en la tiroides. Sus pulmones son claros para la auscultación bilateralmente, y su corazón tiene ritmo y ritmo regulares sin soplo. Su abdomen es suave, no sensible, no distraído y sin masas palpables, esplenomegalia, hepatomegalia o ascitis. Los exámenes de la piel y las extremidades también están sin ninguna anomalía focal.
Nuestro paciente fue sometido a una tomografía computarizada abdominal con contraste de fase arterial que mostró una lesión potenciadora de 3,5 cm en la cabeza del páncreas (Figuras 1, 2). La EUS posterior con biopsia confirmó un tumor neuroendocrino bien diferenciado. Una evaluación patológica adicional encontró que las células tumorales son positivas para cromogranina y CD56, pero con un índice Ki-67 bajo de 3% -4%, lo que sugiere un tumor neuroendocrino bien diferenciado.
Los pacientes a menudo se presentan a su cirujano después de haber sido sometidos a una serie de estudios radiológicos. La modalidad de imagen más importante es una tomografía computarizada abdominal trifásica: sin contraste, con contraste de fase arterial y con contraste de fase portal-venosa. La resonancia magnética abdominal también puede proporcionar información útil para diferenciar entre tumores de etiología poco clara. Sin embargo, los tumores neuroendocrinos pancreáticos (PNET) tienen rasgos muy característicos en las tomografías computarizadas que, junto con la historia clínica y física del paciente, a menudo pueden proporcionar información adecuada para las recomendaciones quirúrgicas. 1,2
Los PNET son típicamente isodensas con parénquima pancreático visible en imágenes previas al contraste. Sin embargo, los tumores tienen una marcada mejora en las imágenes de la fase arterial con una minoría de tumores que también son evidentes en la fase venosa portal. En raras ocasiones, PNETS puede ser de naturaleza hipovascular o quística, lo que disminuye la capacidad de discriminar entre otras lesiones solo por TC. La ecografía endoscópica con biopsia se utiliza cada vez más para localizar lesiones particularmente pequeñas. Aunque es altamente sensible para lesiones más pequeñas, la EUS también es altamente dependiente del operador.
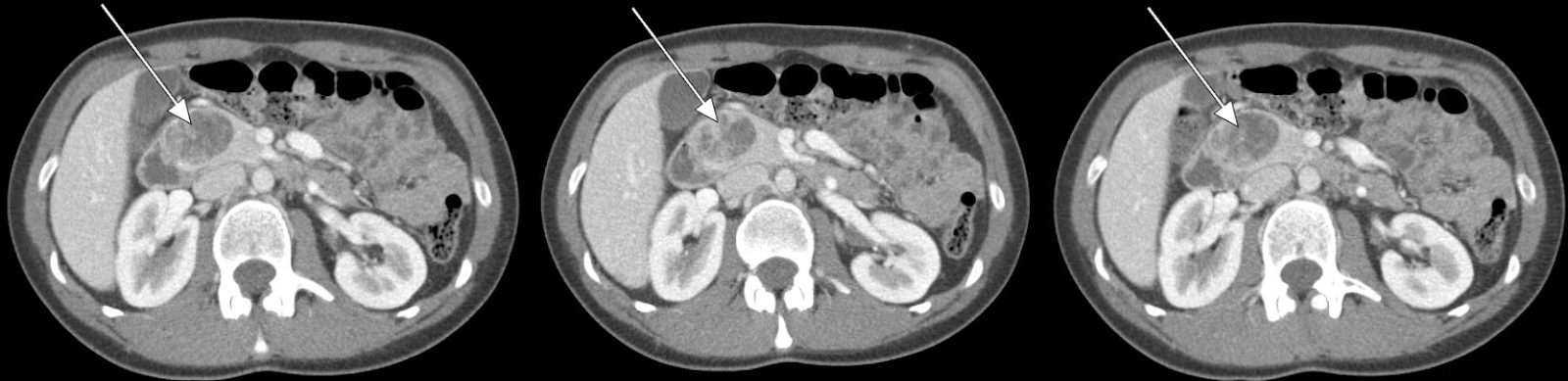
Figura 1. Tomografía computarizada abdominal La tomografía computarizada abdominal revela una lesión potenciadora de 3,5 cm asociada con la cabeza del páncreas.
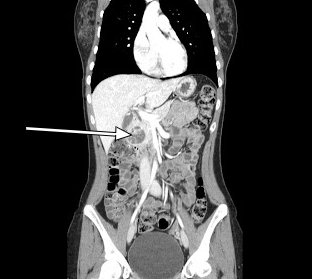
Figura 2. Tomografía computarizada sagital La tomografía computarizada sagital revela una lesión potenciadora de 3,5 cm asociada con la cabeza del páncreas.
Las manifestaciones clínicas del síndrome MEN-1 incluyen adenomas paratiroideos y pituitarios, así como tumores neuroendocrinos pancreáticos (PNET). Aunque los PNET representan menos del 3% de todas las neoplasias pancreáticas en la población general, entre el 30% y el 80% de los pacientes con MEN-1 desarrollarán evidencia de un tumor neuroendocrino. 3-5 Aproximadamente la mitad de todas las muertes en pacientes con MEN-1 pueden atribuirse a neoplasias endocrinas malignas.
Los pacientes con lesiones en la cabeza del páncreas probablemente requerirán una pancreaticoduodenectomía para obtener una resección oncológica adecuada. Las variaciones en la reconstrucción incluyen la preservación del píloro, la duodenoyeyunostomía antecólica vs retrocólica (o gastroyeyunostomía) y el método de pancreaticoyeyunostomía. Sin embargo, estas variaciones han dado lugar a pequeñas diferencias en los resultados inmediatos y a largo plazo. 6-8 Las lesiones en el cuerpo o la cola del páncreas pueden someterse a una pancreatectomía media o distal, respectivamente. Independientemente del procedimiento realizado, se requiere una vigilancia regular con imágenes axiales dado el riesgo continuo de desarrollar PNET adicional en el páncreas restante.
Dado que el paciente tiene un tumor neuroendocrino pancreático que no funciona en la cabeza del páncreas, el procedimiento de Whipple es la única opción curativa potencial. Se optó por realizar una pancreaticoduodenectomía con preservación del píloro porque no se han observado diferencias en los resultados en sus variaciones. 6,7
Aquí presentamos el caso de una mujer de 26 años con MEN-1 y un tumor neuroendocrino pancreático no funcional en la cabeza del páncreas. Se sometió a una pancreaticoduodenectomía sin complicaciones que preserva el píloro y se ha recuperado sin complicaciones adicionales. La patología final reveló un tumor neuroendocrino bien diferenciado con 0 de 12 ganglios linfáticos positivos para neoplasia maligna.
Salvo complicaciones intraoperatorias o comorbilidades específicas del paciente, la mayoría de los pacientes deben ser extubados en el quirófano. Por lo general, dejamos una sonda nasogástrica durante la noche y la retiramos en el día postoperatorio número 1. Los drenajes de Blake deben ser monitoreados para determinar el volumen, el carácter y el contenido de amilasa. 9 Se han desarrollado múltiples algoritmos para determinar el momento óptimo de eliminación del drenaje. En última instancia, los drenajes se pueden eliminar si el drenaje es de bajo volumen, con niveles bajos de amilasa (< 600 U / L), y no es de carácter sospechoso. Sin embargo, si la salida de drenaje sigue siendo de alto volumen o tiene una alta concentración de amilasa, los drenajes deben permanecer en su lugar. Además, los cirujanos deben tener un umbral bajo para reimaginar a los pacientes después de la cirugía en caso de que muestren signos de fuga pancreática no controlada, como taquicardia, fiebre, dolor abdominal o leucocitosis inexplicable.
El stent pancreático debe permanecer en su lugar hasta tres semanas después de la operación, momento en el que se puede retirar en la clínica. La dieta del paciente debe avanzar lentamente según lo tolerado, con cuidado de controlar el vaciamiento gástrico retrasado.
En ausencia de complicaciones explícitas, generalmente proporcionamos restricciones de rutina después de la laparotomía, incluida la evitación de levantar objetos pesados durante cuatro a seis semanas después de la cirugía. Los pacientes generalmente regresan a la clínica para el seguimiento dos o tres semanas después de la cirugía (dependiendo de si se usó un stent pancreático). Un estudio reciente siguió a dieciséis pacientes con MEN-1 después de la pancreatectomía para tumores neuroendocrinos que no funcionan. 10 10 de estos pacientes desarrollaron nuevos PNET después de una mediana de seguimiento de 74 meses. Independientemente del procedimiento específico realizado, los pacientes deben hacer un seguimiento con imágenes axiales de rutina para evaluar la enfermedad recurrente o metastásica.
El procedimiento de Whipple sigue siendo la única opción para el tratamiento curativo de las neoplasias malignas de la cabeza pancreática, incluidos los tumores neuroendocrinos. La mortalidad por el procedimiento ha mejorado notablemente en las últimas décadas; las tasas de mortalidad perioperatoria ahora son < del 2% en los centros de alto volumen. 11 Sin embargo, las tasas de morbilidad superiores al 40% continúan plagando la cirugía. Las fístulas pancreáticas ocurren en aproximadamente el 10-15% de los casos. Trabajos recientes sugieren que los stents de conducto pancreático externo pueden ayudar a reducir la fístula clínicamente significativa en pacientes de alto riesgo (aquellos con una glándula blanda y un conducto pancreático pequeño). 12 Aunque ha habido un debate considerable sobre el papel del drenaje de succión cerrada después del procedimiento de Whipple, un ensayo controlado aleatorio reciente mostró que el drenaje de rutina también reduce la frecuencia y la gravedad de las complicaciones postoperatorias. Se están realizando múltiples estudios para identificar estrategias para reducir la frecuencia de las infecciones del sitio quirúrgico que actualmente ocurren en el 8% al 10% de estos procedimientos. El aumento de los datos sugiere que los antibióticos profilácticos preoperatorios estándar pueden no cubrir adecuadamente la flora biliar, que con frecuencia está presente después de la instrumentación preoperatoria del tracto biliar (CPRE, esfinterotomías, stents, etc.). 13 Los informes preliminares sugieren que los cirujanos podrían considerar adaptar las opciones de antibióticos a los microorganismos que se observan con mayor frecuencia en sus respectivas poblaciones. El vaciamiento gástrico tardío también ocurre en el 25% -30% de los pacientes después de la pancreaticoduodenectomía sin una asociación clara entre la preservación del píloro frente a la duodenoyeyunostomía clásica o antecólica frente a la retrocólica (o gastroyeyunostomía). 14
Actualización editorial 24/06/2018: La paciente tiene ahora casi 4 años después de la cirugía sin evidencia de enfermedad recurrente en su páncreas, aunque requirió la extirpación de un adenoma paratiroideo.
Los equipos especiales utilizados en este procedimiento incluyen un retractor Bookwalter, un tubo de alimentación pediátrica (3-5 franceses), dilatadores y un coagulador de haz de argón (opcional).
Ninguno.
Se obtuvo el consentimiento para el uso de la historia clínica, la radiología y el video intraoperatorio del paciente y los proveedores involucrados en la compilación de este informe de caso y la filmación.
References
- Philips S, Shah SN, Vikram R, Verma S, Shanbhogue AKP, Prasad SR. Neoplasias endocrinas pancreáticas: una actualización actual sobre genética e imágenes. Fr. J Radiol. 2012;85(1014):682-696. doi:10.1259/bjr/85014761.
- Lewis MA, Thompson GB, Young WF Jr. Evaluación preoperatoria del páncreas en neoplasia endocrina múltiple tipo 1. Mundo J Surg. 2012;36(6):1375-1381. doi:10.1007/s00268-012-1539-7.
- Hausman MS Jr, Thompson NW, Gauger PG, Doherty GM. El manejo quirúrgico de la enfermedad neuroendocrina pancreatoduodenal MEN-1. Cirugía. 2004;136(6):1205-1211. doi:10.1016/j.surg.2004.06.049.
- Tonelli F, Fratini G, Nesi G, et al. Pancreatectomía en neoplasia endocrina múltiple relacionada con gastrinomas tipo 1 y neoplasias endocrinas pancreáticas. Ana Surg. 2006;244(1):61-70. doi:10.1097/01.sla.0000218073.77254.62.
- Lairmore TC, Chen VY, DeBenedetti MK, Gillanders WE, Norton JA, Doherty GM. Resecciones duodenopancreáticas en pacientes con neoplasia endocrina múltiple tipo 1. Ana Surg. 2000;231(6):909-918. doi:10.1097%2F00000658-200006000-00016.
- Diener MK, Knaebel HP, Heukaufer C, Antes G, Büchler MW, Seiler CM. Una revisión sistemática y un metanálisis de la preservación del píloro versus la pancreaticoduodenectomía clásica para el tratamiento quirúrgico del carcinoma periampular y pancreático. Ana Surg. 2007;245(2):187-200. doi:10.1097/01.sla.0000242711.74502.a9.
- Tran KTC, Smeenk HG, van Eijck CHJ, et al. Preservación del píloro pancreaticoduodenectomía versus procedimiento estándar de Whipple: un análisis prospectivo, aleatorizado y multicéntrico de 170 pacientes con tumores pancreáticos y periampulares. Ana Surg. 2004;240(5):738-745. doi:10.1097/01.sla.0000143248.71964.29.
- Eshuis WJ, van Eijck CHJ, Gerhards MF, et al. Vía antecólica versus retrocólica de la anastomosis gastroentérica después de la pancreatoduodenectomía: un ensayo controlado aleatorio. Ana Surg. 2014;259(1):45-51. doi:10.1097/SLA.0b013e3182a6f529.
- Van Buren G II, Bloomston M, Hughes SJ, et al. Un ensayo prospectivo aleatorizado multicéntrico de pancreaticoduodenectomía con y sin drenaje intraperitoneal de rutina. Ana Surg. 2014;259(4):605-612. doi:10.1097/SLA.00000000000000460.
- Lopez CL, Waldmann J, Fendrich V, Langer P, Kann PH, Bartsch DK. Resultados a largo plazo de la cirugía para neoplasias neuroendocrinas pancreáticas en pacientes con MEN1. Langenbecks Arch Surg. 2011;396(8):1187-1196. doi:10.1007/s00423-011-0828-1.
- Fernández-del Castillo C, Morales-Oyarvide V, McGrath D, et al. Evolución del procedimiento de Whipple en el Hospital General de Massachusetts. Cirugía. 2012;152(3)(suppl 1):S56-S63. doi:10.1016/j.surg.2012.05.022.
- Pessaux P, Sauvanet A, Mariette C, et al. El stent del conducto pancreático externo disminuye la tasa de fístula pancreática después de la pancreaticoduodenectomía: ensayo aleatorizado multicéntrico prospectivo. Ana Surg. 2011;253(5):879-885. doi:10.1097/SLA.0b013e31821219af.
- Donald GW, Dharma S, Lu X, et al. Antibióticos perioperatorios para la infección del sitio quirúrgico en la pancreaticoduodenectomía: ¿el régimen aprobado por el SCIP proporciona una cobertura adecuada? Cirugía. 2013;154(2):190-196. doi:10.1016/j.surg.2013.04.001.
- Kawai M, Tani M, Hirono S, et al. La resección del anillo del píloro reduce el vaciamiento gástrico retardado en pacientes sometidos a pancreatoduodenectomía: un ensayo prospectivo, aleatorizado y controlado de pancreatoduodenectomía con resección del píloro versus pancreatoduodenectomía con preservación del píloro. Ana Surg. 2011;253(3):495-501. doi:10.1097/SLA.0b013e31820d98f1.
Cite this article
Lillemoe K, Loehrer A. Procedimiento de Whipple para la neoplasia endocrina múltiple del páncreas. J Med Insight. 2018;2018(16). doi:10.24296/jomi/16.


