Whipple-Verfahren bei multipler endokriner Neoplasie der Bauchspeicheldrüse
Main Text
Table of Contents
Die multiple endokrine Neoplasie Typ 1 (MEN-1) ist eine ungewöhnliche autosomal-dominante Erbkrankheit mit einer geschätzten Häufigkeit von 1:30.000 in der Allgemeinbevölkerung. 35% -75% der Patienten mit MEN-1 entwickeln letztendlich neuroendokrine Tumoren der Bauchspeicheldrüse, die die größte Bedrohung für das Langzeitüberleben darstellen. Die Pankreatektomie bleibt die einzige kurative Therapie für solche Patienten und ist in den letzten Jahrzehnten immer sicherer geworden. Hier stellen wir den Fall einer jungen Frau mit MEN-1 vor, bei der ein 3,5 cm großer, gut differenzierter neuroendokriner Pankreastumor im Kopf der Bauchspeicheldrüse festgestellt wurde. Wir skizzieren die Naturgeschichte, präoperative Versorgung, intraoperative Technik und postoperative Überlegungen.
Das MEN-1-Syndrom ist ein autosomal-dominantes Erbsyndrom, das mit inaktivierenden Mutationen im Tumorsuppressorprotein Menin zusammenhängt. Leider tritt das MEN-1-Syndrom in der Allgemeinbevölkerung mit einer geschätzten Häufigkeit von 1:30.000 auf, und 35% -75% der Menschen mit dieser Erkrankung entwickeln neuroendokrine Tumoren der Bauchspeicheldrüse.
Unsere Patientin ist eine 26-jährige Frau mit einer bekannten Vorgeschichte von MEN-1 in unmittelbaren Familienmitgliedern. Sie war bis zur Entwicklung von Kopfschmerzen und Laktation bei guter Gesundheit gewesen, ohne Bauchschmerzen oder -beschwerden, Gewichtsverlust oder Symptome einer Hypoglykämie. Die Aufarbeitung ergab ein Hypophysenadenom, das schließlich mit Cabergolin mit einer Auflösung der Symptome behandelt wurde. Die anschließende Aufarbeitung weiterer MEN-1-bezogener Tumoren umfasste eine MRT- und CT-Studie, die eine Masse von 3,5 cm im Kopf der Bauchspeicheldrüse ergab. Unser Patient präsentierte sich dann zur chirurgischen Beurteilung des neuroendokrinen Tumors des Pankreaskopfes.
Sie hat keine vorherige medizinische oder abdominale chirurgische Anamnese. Ihr einziges Medikament zum Zeitpunkt der Präsentation ist Cabergolin, und sie trinkt nur gelegentlich ein Glas Wein. Ihre Familiengeschichte ist bemerkenswert für MEN-1; Ihre Großmutter mütterlicherseits hatte einen Bauchspeicheldrüsentumor und unterzog sich im Alter von 50 Jahren einem Whipple-Verfahren. Ihr Vater und zwei Onkel haben Bauchspeicheldrüsen- und Nebenschilddrüsentumoren.
Die körperliche Untersuchung ergab eine gesund aussehende junge Dame mit einem Puls von 80 bpm und einem Blutdruck von 110/80 mmHg. Sie hat keinen Sklerusicterus und weder zervikale noch supraklavikuläre Lymphadenopathie. Sie hat keine tastbaren Massen in der Schilddrüse. Ihre Lungen sind deutlich für die Auskultation bilateral, und ihr Herz hat regelmäßige Rate und Rhythmus ohne Murmeln. Ihr Bauch ist weich, nicht zart, ungedehnt und ohne spürbare Massen, Splenomegalie, Hepatomegalie oder Aszites. Haut- und Extremitätenuntersuchungen sind auch ohne fokale Anomalien.
Unser Patient unterzog sich einem abdominalen CT-Scan mit arteriellem Phasenkontrast, der eine 3,5 cm verstärkende Läsion im Kopf der Bauchspeicheldrüse zeigte (Abbildungen 1, 2). Die anschließende EUS mit Biopsie bestätigte einen gut differenzierten neuroendokrinen Tumor. Zusätzliche pathologische Untersuchungen ergaben, dass Tumorzellen positiv auf Chromogranin und CD56 sind, aber mit einem niedrigen Ki-67-Index von 3% -4%, was auf einen gut differenzierten neuroendokrinen Tumor hindeutet.
Patienten präsentieren sich oft ihrem Chirurgen, nachdem sie bereits eine Reihe von radiologischen Studien durchlaufen haben. Die wichtigste Bildgebungsmodalität ist ein dreiphasiger abdominaler CT-Scan: ohne Kontrast, mit arteriellem Phasenkontrast und mit portalvenösem Phasenkontrast. Die abdominale MRT kann auch nützliche Informationen liefern, um zwischen Tumoren unklarer Ätiologie zu unterscheiden. Neuroendokrine Tumoren der Bauchspeicheldrüse (PNETs) weisen jedoch sehr charakteristische Merkmale bei CT-Scans auf, die in Verbindung mit der Anamnese und der körperlichen Vorgeschichte eines Patienten oft ausreichende Informationen für chirurgische Empfehlungen liefern können. 1,2
PNETs sind typischerweise isodense mit Pankreasparenchym, das auf Vorkontrastbildern sichtbar ist. Die Tumoren haben jedoch eine deutliche Verbesserung der arteriellen Phasenbildgebung, wobei eine Minderheit von Tumoren auch in der portalvenösen Phase sichtbar ist. In seltenen Fällen kann PNETS entweder hypovaskulär oder zystischer Natur sein, was die Fähigkeit verringert, zwischen anderen Läsionen allein durch CT zu unterscheiden. Endoskopischer Ultraschall mit Biopsie wird zunehmend eingesetzt, um besonders kleine Läsionen zu lokalisieren. Obwohl EUS für kleinere Läsionen hochempfindlich ist, ist es auch stark betreiberabhängig.
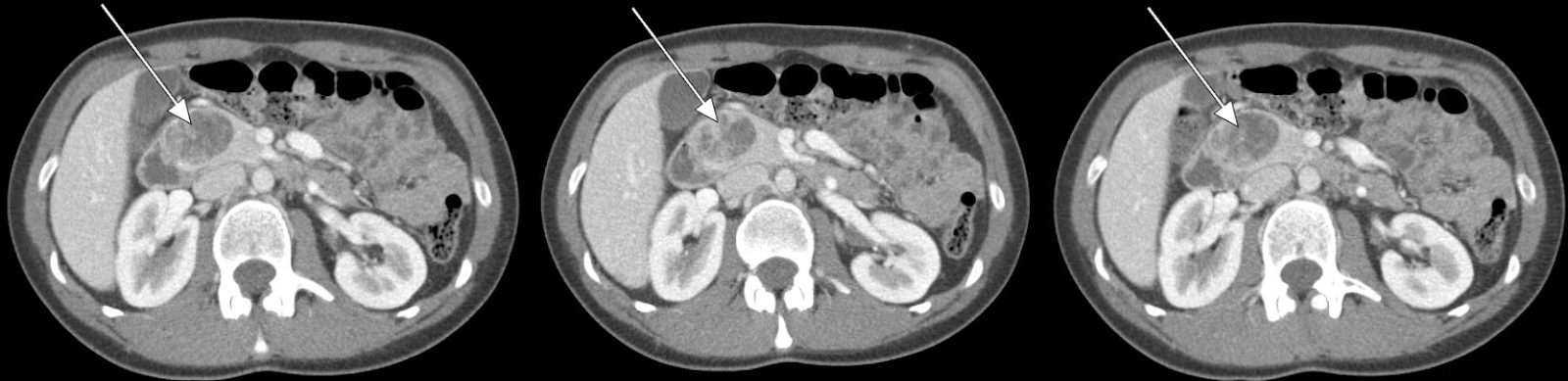
Abbildung 1. Abdominal CT Scan Abdominale CT zeigt eine 3,5 cm verstärkende Läsion, die mit dem Kopf der Bauchspeicheldrüse verbunden ist.
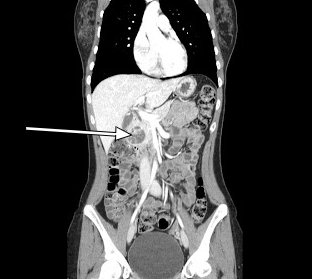
Abbildung 2. Sagittal CT Scan Sagittal CT zeigt eine 3,5 cm verstärkende Läsion, die mit dem Kopf der Bauchspeicheldrüse verbunden ist.
Zu den klinischen Manifestationen des MEN-1-Syndroms gehören Nebenschilddrüsen- und Hypophysenadenome sowie neuroendokrine Tumoren der Bauchspeicheldrüse (PNETs). Obwohl PNETs weniger als 3% aller Pankreasneoplasmen in der Allgemeinbevölkerung ausmachen, entwickeln 30% -80% der Patienten mit MEN-1 Hinweise auf einen neuroendokrinen Tumor. 3-5 Etwa die Hälfte aller Todesfälle bei Patienten mit MEN-1 kann auf maligne endokrine Neoplasmen zurückgeführt werden.
Patienten mit Läsionen im Kopf der Bauchspeicheldrüse benötigen höchstwahrscheinlich eine Pankreatikoduodenektomie, um eine adäquate onkologische Resektion zu erhalten. Variationen in der Rekonstruktion umfassen Pyloruskonservierung, antekolische vs. retrokolische Duodenojejunostomie (oder Gastrojejunostomie) und Methode der Pankreaticojejunostomie. Diese Variationen haben jedoch zu geringen Unterschieden in den unmittelbaren und langfristigen Ergebnissen geführt. 6-8 Läsionen im Körper oder Schwanz der Bauchspeicheldrüse können einer mittleren bzw. distalen Pankreatektomie unterzogen werden. Unabhängig vom durchgeführten Verfahren ist eine regelmäßige Überwachung mit axialer Bildgebung erforderlich, da das Risiko besteht, dass ein zusätzliches PNET in der verbleibenden Bauchspeicheldrüse entwickelt wird.
Angesichts der Tatsache, dass der Patient einen nicht funktionierenden neuroendokrinen Pankreastumor am Kopf der Bauchspeicheldrüse hat, ist das Whipple-Verfahren die einzige mögliche heilende Option. Wir haben uns für eine Pylorus-erhaltende Pankreatikoduodenektomie entschieden, da in ihren Variationen kein Unterschied in den Ergebnissen beobachtet wurde. 6,7
Hier präsentieren wir den Fall einer 26-jährigen Frau mit MEN-1 und einem nicht funktionierenden neuroendokrinen Tumor der Bauchspeicheldrüse am Kopf der Bauchspeicheldrüse. Sie unterzog sich einer unkomplizierten Pylorus-erhaltenden Pankreatikoduodenektomie und hat sich ohne zusätzliche Komplikationen erholt. Die endgültige Pathologie zeigte einen gut differenzierten neuroendokrinen Tumor mit 0 von 12 Lymphknoten, die positiv auf Malignität waren.
Abgesehen von intraoperativen Komplikationen oder spezifischen Patientenkomorbiditäten sollten die meisten Patienten im Operationssaal extubiert werden. Wir lassen normalerweise eine Nasensonde über Nacht und entfernen sie am postoperativen Tag Nummer 1. Blake-Abflüsse sollten auf Volumen, Charakter und Amylasegehalt überwacht werden. 9 Es wurden mehrere Algorithmen entwickelt, um den optimalen Zeitpunkt der Abflussentfernung zu bestimmen. Letztendlich können Abflüsse entfernt werden, wenn die Drainage ein geringes Volumen aufweist, einen niedrigen Amylasespiegel (< 600 U / L) aufweist und keinen verdächtigen Charakter hat. Sollte der Abflussausgang jedoch ein hohes Volumen aufweisen oder eine hohe Konzentration an Amylase aufweisen, sollten die Abflüsse an Ort und Stelle bleiben. Darüber hinaus sollten Chirurgen eine niedrige Schwelle haben, um Patienten nach der Operation neu zu bebildern, wenn sie Anzeichen eines unkontrollierten Pankreaslecks wie Tachykardie, Fieber, Bauchschmerzen oder ungeklärter Leukozytose zeigen.
Der Pankreas-Stent sollte bis drei Wochen postoperativ an Ort und Stelle bleiben, dann kann er in der Klinik entfernt werden. Die Ernährung der Patienten sollte langsam wie toleriert vorangetrieben werden, wobei darauf zu achten ist, dass die Magenentleerung verzögert wird.
In Ermangelung expliziter Komplikationen bieten wir in der Regel routinemäßige Einschränkungen nach der Laparotomie an, einschließlich der Vermeidung von schwerem Heben für vier bis sechs Wochen nach der Operation. Die Patienten kehren in der Regel zwei oder drei Wochen nach der Operation zur Nachsorge in die Klinik zurück (je nachdem, ob ein Pankreasstent verwendet wurde). Eine kürzlich durchgeführte Studie folgte sechzehn Patienten mit MEN-1 nach Pankreektomie für nicht funktionierende neuroendokrine Tumoren. 10 10 dieser Patienten entwickelten nach einer medianen Nachbeobachtungszeit von 74 Monaten neue PNETs. Unabhängig von dem spezifischen Verfahren, das durchgeführt wird, sollten die Patienten daher eine routinemäßige axiale Bildgebung durchführen, um eine rezidivierende oder metastasierende Erkrankung zu untersuchen.
Das Whipple-Verfahren bleibt die einzige Option für die kurative Behandlung von malignen Erkrankungen des Pankreaskopfes, einschließlich neuroendokriner Tumoren. Die Mortalität durch das Verfahren hat sich in den letzten Jahrzehnten deutlich verbessert; Die perioperativen Sterberaten liegen jetzt < 2% in hochvolumigen Zentren. 11 Morbiditätsraten von mehr als 40% plagen die Operation jedoch weiterhin. Pankreasfisteln treten in etwa 10-15% der Fälle auf. Jüngste Arbeiten deuten darauf hin, dass externe Pankreaskanalstents dazu beitragen können, klinisch signifikante Fisteln bei Hochrisikopatienten (Patienten mit einer weichen Drüse und einem kleinen Pankreasgang) zu reduzieren. 12 Obwohl nach dem Whipple-Verfahren eine beträchtliche Debatte über die Rolle der geschlossenen Saugdrainage stattgefunden hat, zeigte eine kürzlich durchgeführte randomisierte kontrollierte Studie, dass die routinemäßige Drainage auch die Häufigkeit und Schwere postoperativer Komplikationen verringert. Mehrere Studien sind im Gange, um Strategien zur Verringerung der Häufigkeit von Infektionen an der Operationsstelle zu identifizieren, die derzeit bei 8% -10% dieser Verfahren auftreten. Zunehmende Daten deuten darauf hin, dass die präoperativen präoperativen prophylaktischen Antibiotika möglicherweise nicht ausreichend die Gallenflora abdecken, die häufig nach präoperativer Instrumentierung der Gallenwege (ERCP, Sphinkterotomien, Stents usw.) vorhanden ist. 13 Vorläufige Berichte deuten darauf hin, dass Chirurgen erwägen könnten, die Antibiotikaauswahl auf Mikroorganismen abzustimmen, die in ihren jeweiligen Populationen am häufigsten vorkommen. Eine verzögerte Magenentleerung tritt auch bei 25% -30% der Patienten nach Pankreatikoduodenektomie auf, ohne dass ein klarer Zusammenhang zwischen Pylorus-Erhaltung vs. klassischem Whipple oder antekolischer vs. retrokoler Duodenojejunostomie (oder Gastrojejunostomie) besteht. 14
Editorial Update 24.06.2018: Die Patientin ist jetzt fast 4 Jahre nach der Operation ohne Anzeichen einer wiederkehrenden Erkrankung in ihrer Bauchspeicheldrüse, obwohl sie die Entfernung eines Nebenschilddrüsenadenoms benötigte.
Zu den speziellen Geräten, die bei diesem Verfahren verwendet werden, gehören ein Bookwalter-Retraktor, eine pädiatrische Ernährungssonde (3-5 Französisch), Dilatatoren und ein Argonstrahlkoagulator (optional).
Nichts.
Die Zustimmung zur Verwendung von Anamnese, Radiologie und intraoperativem Video wurde von dem Patienten und den an der Erstellung dieses Fallberichts und der Filmaufzeichnung beteiligten Anbietern eingeholt.
References
- Philips S, Shah SN, Vikram R, Verma S, Shanbhogue AKP, Prasad SR. Pankreas-endokrine Neoplasmen: ein aktuelles Update zu Genetik und Bildgebung. Br. J. Radiol. 2012;85(1014):682-696. doi:10.1259/bjr/85014761
- Lewis MA, Thompson GB, Young WF Jr. Präoperative Beurteilung der Bauchspeicheldrüse bei multipler endokriner Neoplasie Typ 1. Welt J Surge 2012;36(6):1375-1381. doi:10.1007/s00268-012-1539-7
- Hausman MS Jr., Thompson NW, Gauger PG, Doherty GM Die chirurgische Behandlung von MEN-1 pankreatoduodenalen neuroendokrinen Erkrankungen. Chirurgie. 2004;136(6):1205-1211. doi:10.1016/j.surg.2004.06.049
- Tonelli F, Fratini G, Nesi G, et al. Pankreatektomie bei multiplen endokrinen Neoplasien Typ-1-bedingten Gastrinomen und pankreatischen endokrinen Neoplasien. Ann Surg 2006;244(1):61-70. doi:10.1097/01.sla.0000218073.77254.62
- Lairmore TC, Chen VY, DeBenedetti MK, Gillanders WE, Norton JA, Doherty GM. Duodenopankreasresektionen bei Patienten mit multipler endokriner Neoplasie Typ 1. Ann Surg 2000;231(6):909-918. doi:10.1097%2F00000658-200006000-00016
- Diener MK, Knaebel HP, Heukaufer C, Antes G, Büchler MW, Seiler CM. Eine systematische Überprüfung und Meta-Analyse der Pylorus-erhaltenden versus klassischen Pankreatikoduodenektomie zur chirurgischen Behandlung des periampullären und pankreatischen Karzinoms. Ann Surg 2007;245(2):187-200. doi:10.1097/01.sla.0000242711.74502.a9
- Tran KTC, Smeenk HG, van Eijck CHJ, et al. Pylorus-Konservierung Pankreaticoduodenektomie versus Standard-Whipple-Verfahren: eine prospektive, randomisierte, multizentrische Analyse von 170 Patienten mit Pankreas- und periampullären Tumoren. Ann Surg 2004;240(5):738-745. doi:10.1097/01.sla.0000143248.71964.29
- Eshuis WJ, van Eijck CHJ, Gerhards MF, et al. Vorkolische versus retrokolische Route der gastroenterischen Anastomose nach Pankreatoduodenektomie: eine randomisierte kontrollierte Studie. Ann Surg 2014;259(1):45-51. doi:10.1097/SLA.0b013e3182a6f529
- Van Buren G II, Bloomston M, Hughes SJ, et al. Eine randomisierte prospektive multizentrische Studie zur Pankreatikoduodenektomie mit und ohne routinemäßige intraperitoneale Drainage. Ann Surg 2014;259(4):605-612. doi:10.1097/SLA.0000000000000460
- Lopez CL, Waldmann J, Fendrich V, Langer P, Kann PH, Bartsch DK. Langzeitergebnisse der Operation bei neuroendokrinen Tumoren der Bauchspeicheldrüse bei Patienten mit MEN1. Langenbecks Bogen Surg. 2011;396(8):1187-1196. doi:10.1007/s00423-011-0828-1
- Fernández-del Castillo C, Morales-Oyarvide V, McGrath D, et al. Entwicklung des Whipple-Verfahrens am Massachusetts General Hospital. Chirurgie. 2012;152(3)(suppl 1):S56-S63. doi:10.1016/j.surg.2012.05.022
- Pessaux P, Sauvanet A, Mariette C, et al. Externer Pankreasgangstent verringert Pankreasfistelrate nach Pankreatikoduodenektomie: prospektive multizentrische randomisierte Studie. Ann Surg 2011;253(5):879-885. doi:10.1097/SLA.0b013e31821219af.
- Donald GW, Dharma S, Lu X, et al. Perioperative Antibiotika für die Infektion an der Operationsstelle bei der Pankreatikoduodenektomie: Bietet das SCIP-zugelassene Regime eine angemessene Abdeckung? Chirurgie. 2013;154(2):190-196. doi:10.1016/j.surg.2013.04.001
- Kawai M, Tani M, Hirono S, et al. Die Pylorus-Ringresektion reduziert die verzögerte Magenentleerung bei Patienten, die sich einer Pankreatoduodenektomie unterziehen: eine prospektive, randomisierte, kontrollierte Studie zur Pylorus-Resektion im Vergleich zur Pylorus-erhaltenden Pankreatoduodenektomie. Ann Surg 2011;253(3):495-501. doi:10.1097/SLA.0b013e31820d98f1
Cite this article
Lillemoe K, Loehrer A. Whipple-Verfahren für multiple endokrine Neoplasien der Bauchspeicheldrüse. J Med Einblick. 2018;2018(16). doi:10.24296/jomi/16.


