Reparo de aneurisma da aorta toracoabdominal
Main Text
Table of Contents
Os aneurismas da aorta toracoabdominal (AATs) são geralmente assintomáticos e são descobertos incidentalmente em imagens torácicas ou abdominais. Quando são identificados, o tratamento geralmente é expectante, dependendo do tamanho do aneurisma e de sua taxa de crescimento. A cirurgia é indicada para aneurismas maiores e aqueles que se expandem rapidamente, de modo a evitar a ruptura catastrófica do aneurisma. Apresentamos aqui o caso de uma mulher de 70 anos com AATA, que vinhamos acompanhando com exames seriados de angiotomografia computadorizada. A decisão de operar foi tomada quando o aneurisma começou a revelar crescimento em diâmetro. Sua anatomia não era propícia ao tratamento endovascular; portanto, reparamos seu aneurisma usando uma abordagem aberta tradicional.
Doenças cardiovasculares; doenças vasculares; aneurisma; aneurisma da aorta; toracoabdominal.
Os aneurismas da aorta são dilatações focais da aorta que podem ocorrer em qualquer ponto ao longo de seu comprimento desde a raiz, logo acima da válvula aórtica, até a bifurcação na pelve. A classificação é por localização anatômica e dividida em aneurismas torácicos, abdominais ou toracoabdominais. Os aneurismas torácicos são divididos naqueles que envolvem a raiz e a aorta ascendente, aqueles que envolvem o arco aórtico e aqueles que envolvem a aorta torácica descendente. Os aneurismas da aorta toracoabdominal (AATs) são categorizados usando a classificação de Crawford: a extensão I abrange a maior parte da aorta torácica descendente, abrangendo desde a artéria subclávia esquerda até a aorta abdominal suprarrenal. A extensão II é a mais extensa, envolvendo a aorta da artéria subclávia esquerda até a bifurcação aortoilíaca. A extensão III inclui a aorta torácica distal e se estende até a bifurcação aortoilíaca. A extensão IV está confinada à aorta abdominal abaixo do diafragma. O grupo de Safi introduziu a Extensão V, que envolve a aorta torácica distal, incluindo as origens das artérias celíaca e mesentérica superior, mas excluindo as artérias renais (Figura 1). 57
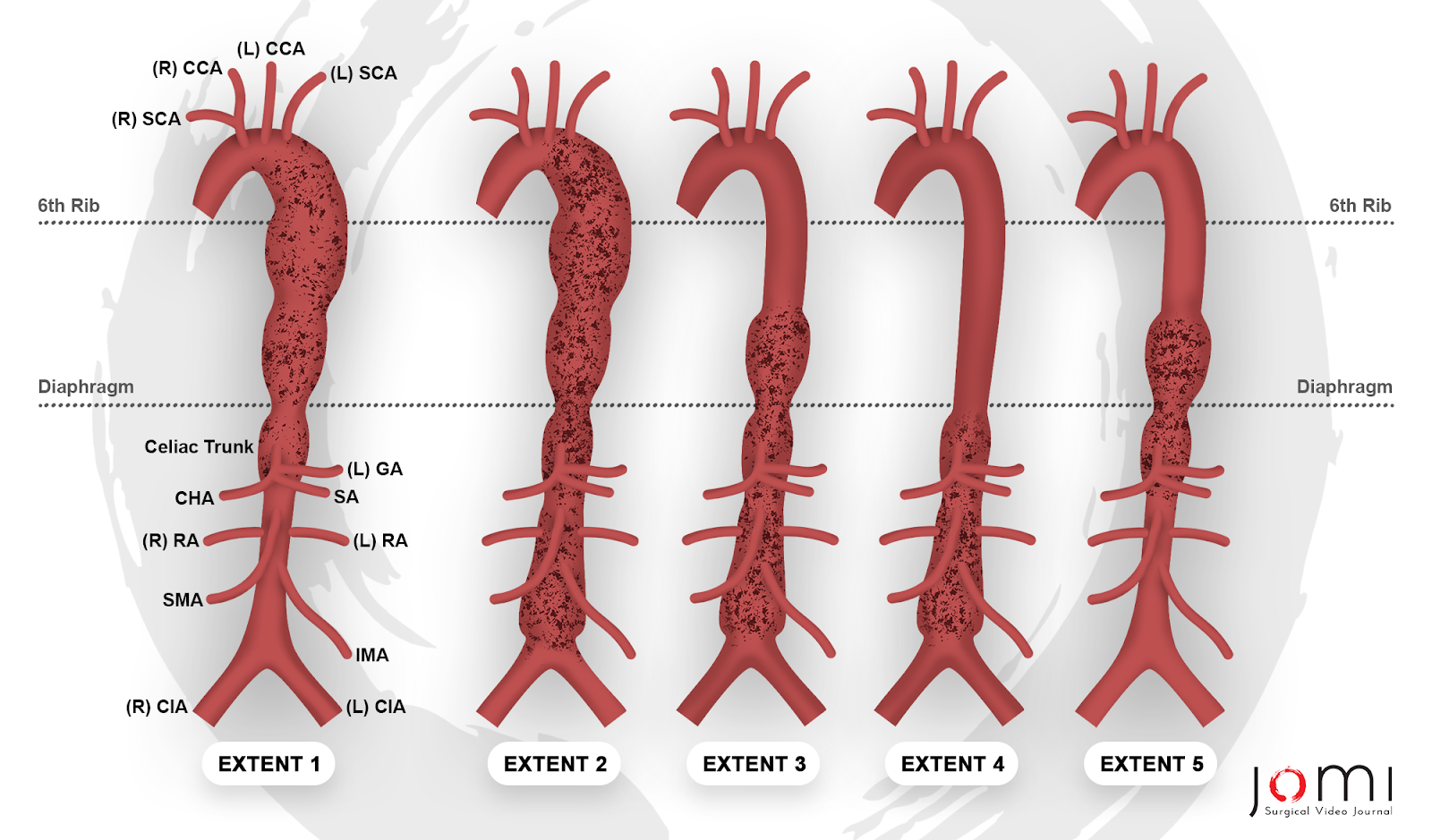
Figura 1. Classificação de Crawford do aneurisma da aorta toracoabdominal, modificada pelo grupo de Safi. Legenda: (R) SCA - Artéria Subclávia Direita, (R) CCA - Artéria Carótida Comum Direita, (L) CCA - Artéria Carótida Comum Esquerda, (L) SCA - Artéria Subclávia Esquerda, (L) GA - Artéria Gástrica Esquerda, CHA - Artéria Hepática Comum, SA - Artéria Esplênica, (R) AR - Artéria Renal Direita, (L) AR - Artéria Renal Esquerda, SMA - Artéria Mesentérica Superior, IMA - Artéria Mesentérica Inferior, (R) CIA - Artéria Ilíaca Comum Direita, (L) CIA - Artéria Ilíaca Comum Esquerda.
A etiologia da dilatação é tipicamente multifatorial e o resultado de fatores hereditários e ambientais, cuja via final comum resulta em uma degradação das fibras de colágeno e elastina e/ou inibição de sua síntese adequada. Essas duas proteínas da matriz extracelular da parede aórtica são as principais responsáveis por sua resistência à tração e elasticidade. 1 Além do colágeno e da elastina, outros componentes da matriz extracelular da parede aórtica (como glicosaminoglicanos) estão diminuídos em pacientes com aneurismas da aorta, o que se propõe ser devido à atividade aberrante da metaloproteinase da matriz. 2 Outros fatores como angiotensina II, mineralocorticóides, espécies reativas de oxigênio e células classicamente encontradas na resposta inflamatória sistêmica também foram implicados na formação de aneurismas da aorta. 3,4,5 As causas secundárias de formação de aneurismas são trauma e infecção, esta última classificada como aneurismas micóticos. Finalmente, mutações genéticas hereditárias e espontâneas que codificam os componentes do poço aórtico mencionados acima podem resultar na formação de aneurisma em associação com síndromes específicas, como Ehlers-Danlos tipo IV e síndrome de Marfan. 6
Os fatores de risco tradicionalmente associados à patogênese da degeneração aórtica do aneurisma incluem sexo masculino, história familiar e tabagismo. As diferenças entre os sexos na prevalência de aneurismas da aorta são significativas, com uma proporção de 5:1 entre homens e mulheres de pacientes afetados, embora um único mecanismo unificador para essas diferenças entre os sexos ainda não tenha sido elucidado. 7,8 A patogênese exata do tabagismo na formação de aneurismas é complexa, dados os constituintes heterogêneos da fumaça do tabaco, embora a associação com o aumento da expressão de metaloproteinases da matriz seja bem apoiada na literatura. 9,10
O reparo do aneurisma da aorta é realizado para evitar a ruptura, que na maioria dos casos é fatal se não for tratada com urgência ou emergência. 11
Como observado acima, os aneurismas da aorta são comumente de natureza insidiosa e se apresentam de forma assintomática, com o diagnóstico frequentemente feito incidentalmente na tomografia computadorizada (TC) para outra indicação. Os aneurismas que cresceram e se tornaram grandes podem causar dor nas costas ou no peito, ou sintomas secundários à compressão das estruturas circundantes. Alguns pacientes também podem endossar a sensação de uma "massa pulsátil", ao nível do aneurisma. Os estigmas embólicos do trombo mural que se separa da parede do aneurisma podem se manifestar como infartos nos órgãos abdominais ou lesões purpúricas nas extremidades inferiores, a chamada síndrome do "dedo do pé do lixo" ou "dedo azul". Conforme discutido, os pacientes com aneurisma podem ter elementos de sua história que elevam o risco de desenvolvimento de aneurisma, como história de tabagismo, história de hipertensão não controlada ou história de doença cardiovascular aterosclerótica. Se houver complicações secundárias do aneurisma, como infecção, o paciente pode apresentar febre subjetiva e outros sintomas sistêmicos.
Dois cenários distintos de exame físico são relevantes: detecção incidental de um aneurisma não roto e exame no momento da ruptura iminente ou ativa. O primeiro pode se apresentar como uma massa particularmente proeminente e pulsátil na região abdominal acima e ligeiramente à esquerda do umbigo. O hábito do corpo do paciente e o tamanho do aneurisma afetarão muito a capacidade de apreciar esse achado. Estigmas embólicos nos membros inferiores podem ser vistos ocasionalmente, principalmente se os pulsos dos membros inferiores forem palpáveis através do nível do pé. Nos casos de aneurismas micóticos ou inflamatórios, sintomas constitucionais associados, como febre e calafrios, podem estar presentes.
Ao contrário de suas contrapartes assintomáticas, a ruptura ou ruptura iminente geralmente se apresenta com dor em qualquer local ao longo da distribuição do aneurisma. A ruptura contida pode resultar na compressão de órgãos ou estruturas adjacentes, como o ureter, resultando em hidronefrose. A fistulização em estruturas luminais, como o intestino, resultará em sangramento gastrointestinal, enquanto a ruptura em estruturas circundantes, como a veia cava, pode resultar em início agudo de insuficiência cardíaca e um sopro de maquinário alto clássico no abdômen. A ruptura contida no retroperitônio pode se manifestar externamente como sinais de Grey Turner (equimose do flanco) ou Cullen (equimose periumbilical).
A maioria dos aneurismas é descoberta incidentalmente durante outros estudos; no entanto, naqueles que nunca fizeram esse tipo de imagem, a Força-Tarefa de Serviços Preventivos dos Estados Unidos (USPSTF) recomenda uma ultrassonografia abdominal única em homens de 65 a 75 anos com história de tabagismo para rastreamento de aneurisma da aorta abdominal (AAA) (recomendação B). Essas recomendações não são as mesmas para mulheres na mesma faixa etária e histórico de uso de substâncias (declaração I). 12
Os pacientes identificados como portadores de aneurismas da aorta são acompanhados de acordo com o tamanho da dilatação. De acordo com as recomendações da Academia Americana de Médicos de Família, pacientes com AAA de 3,0 a 3,9 cm de diâmetro devem ser monitorados por ultrassonografia do abdome a cada dois a três anos (recomendação C). Pacientes com AAAs de 4,0 a 5,4 cm de diâmetro devem ser acompanhados por ultrassonografia ou TC a cada seis a doze meses (recomendação C).13, 14 Pacientes com diâmetros aórticos superiores a 5,5 cm são encaminhados para correção cirúrgica eletiva. Nos aneurismas da aorta torácica (AAT), a vigilância geralmente é repetida a imagem axial seis meses após a detecção e o diagnóstico iniciais para avaliar o crescimento ou a estabilidade. O manejo e as modalidades de imagem específicas para a vigilância contínua dos AATs dependem da extensão, tamanho e taxa de crescimento. Ecocardiografia e ressonância magnética também podem ser opções. 15 O rastreamento para AAT é apropriado em pacientes com forte história familiar. 16,17
Devido às recomendações de triagem da USPSTF, Society for Vascular Surgery e American College of Radiology, os aneurismas da aorta abdominal podem ser detectados e acompanhados adequadamente onde poderiam ter continuado a crescer. Isso permite a mitigação planejada, dependendo da extensão do tamanho do aneurisma ou da taxa de crescimento por meio do gerenciamento de fatores de risco ou consulta cirúrgica.
Os pacientes que estão fora das categorias de risco para rastreamento ainda podem desenvolver aneurismas da aorta e podem nunca tê-los visualizados, onde podem ser assintomáticos até o ponto de ruptura. Alguns estudos sugeriram que cerca de 70 a 80% dos pacientes trazidos ao pronto-socorro por aneurismas rotos da aorta não tinham história ou conhecimento conhecido de um aneurisma da aorta diagnosticado. 18,19
Os aneurismas da aorta assintomáticos que não atendem aos critérios adequados de diâmetro/expansão para reparo são tratados por meio da redução dos fatores de risco cardiovascular. Isso é conseguido por meio de terapia anti-hipertensiva e estatina, além da cessação do tabagismo. Outras terapias farmacológicas, como a doxiciclina, estão sendo investigadas por suas propriedades anti-MMP, mas, atualmente, não há dados que sugiram benefícios substanciais para a mitigação do risco de aneurisma além dos mencionados anteriormente. 20,21,22
Os aneurismas da aorta em que o risco de ruptura excede o risco de cirurgia são encaminhados para uma consulta cirúrgica para reparar o aneurisma. Embora considerado profilaxia, o reparo de um aneurisma da aorta de alto risco tem uma taxa de sobrevida em 5 anos significativamente melhor do que o reparo de um aneurisma da aorta rompido. 23 As opções cirúrgicas para o reparo do aneurisma incluem aberto, endovascular ou um híbrido dos dois. A escolha entre as modalidades de procedimento depende das especificidades do caso do paciente, como a localização ao longo da aorta ou outras considerações anatômicas, além da extensão do aneurisma. Outras considerações mais sutis, como a etiologia exata do aneurisma (degenerativo vs. parte de uma síndrome genética) também influenciam a decisão, pois os pacientes que, de outra forma, seriam bons candidatos à terapia endovascular são tratados cirurgicamente se a etiologia do aneurisma for considerada de natureza genética.
Obviamente, as comorbidades médicas do paciente que afetariam sua candidatura cirúrgica também são levadas em consideração.
O reparo endovascular envolve a colocação de um tubo de tecido colapsado tecido a um stent, um enxerto de stent, na aorta de uma ou ambas as artérias femorais. A endoprótese é colocada em posição através do aneurisma sob fluoroscopia e, em seguida, implantada para que possa se expandir e fazer a ponte da aorta normal proximalmente para a aorta normal ou artérias ilíacas distalmente. O aneurisma é efetivamente "selado" da pressão arterial sistêmica e o fluxo é mantido através da aorta. Os aneurismas envolvendo a aorta toracoabdominal, no entanto, são muito mais desafiadores porque os principais vasos sanguíneos que suprem os órgãos abdominais surgem do próprio aneurisma. Tradicionalmente, a implantação de endopróteses na área resultaria na interrupção do fluxo sanguíneo para esses órgãos. Embora existam técnicas endovasculares avançadas e muito elegantes para abordar e manter o fluxo sanguíneo para esses vasos e, ao mesmo tempo, selar o aneurisma, os detalhes estão além do escopo deste capítulo. Em vez disso, o foco aqui está no reparo cirúrgico aberto do TAAA. A operação envolve a exposição da aorta acessando as cavidades torácica e abdominal, mobilizando os órgãos e tecidos adjacentes da aorta, controlando a aorta acima e abaixo do aneurisma, controlando todos os vasos ramificados decorrentes do aneurisma, interrompendo o fluxo sanguíneo através do segmento aneurismático e, em seguida, substituindo toda a aorta aneurismática por um enxerto de tecido e restaurando o fluxo para as artérias ramificadas. Adjuvantes como o bypass atrial-femoral são usados para ajudar a minimizar e mitigar os efeitos da isquemia de órgãos durante o reparo.
A terapia endovascular demonstrou em estudos observacionais e prospectivos conferir um benefício de mortalidade perioperatória, embora a superioridade da terapia endovascular em relação à terapia cirúrgica permaneça contestada quando se considera a mortalidade em curto prazo, especialmente em relação ao reparo da aorta torácica. 24-31 As conclusões dos ensaios DREAM, EVAR-1, OVER e ACE, avaliando o manejo do AAA infrarrenal, parecem corroborar com estudos anteriores que identificam um benefício de mortalidade em curto prazo versus cirurgia aberta, embora esses estudos não mostrem diferença significativa nos resultados em longo prazo até 10 anos. 32-42 Esses dados ajudaram os profissionais a identificar o procedimento mais adequado para pacientes que se enquadram nessas categorias. Pacientes mais velhos com risco perioperatório são candidatos mais apropriados para terapia endovascular, embora o risco para pacientes mais jovens, saudáveis e com menor risco perioperatório, seja menos claro e justifique uma investigação mais aprofundada. 43-47
O paciente, neste caso, foi diagnosticado com TAAA tipo I, ou seja, envolvimento aórtico estendido da aorta descendente para a aorta abdominal suprarrenal. No caso específico deste paciente, seu aneurisma começa logo após a origem da artéria subclávia esquerda e se estende pela aorta torácica terminando em seu segmento visceral. O plano para a cirurgia deste paciente envolve exposição da aorta torácica, abdominal e infrarrenal proximal, controle dos vasos viscerais, colocação do paciente em bypass femoral atrial esquerdo, colocação de enxerto e fechamento abdominal.
O paciente é colocado em decúbito lateral direito (como é habitual no reparo de AATA tipo I-III) para facilitar o acesso ao tórax e ao abdome. Drenos espinhais e eletrodos de potencial evocado motor também são colocados para avaliação da medula espinhal durante todo o procedimento. A incisão primária é feita ao longo da base do pescoço entre a coluna vertebral e a escápula em um ângulo oblíquo, passando sob a ponta da escápula e seguindo paralelamente às costelas, terminando em um espaço entre o umbigo do paciente e a sínfise púbica.
Atenção cuidadosa é tomada durante a incisão primária para não penetrar na fáscia antes que ela esteja totalmente exposta ao longo de toda a incisão. Pequenos vasos sangrantes são identificados e eletrocauterizados para evitar sangramento quando a heparina é administrada posteriormente no procedimento. Após a exposição da fáscia, a divisão da musculatura sobreposta, incluindo o grande dorsal, trapézio, serrátil anterior e rombóides, ocorre separadamente, com a criação de retalhos ocorrendo para facilitar a reconstrução ao final do procedimento. Suturas de marcação também são colocadas para auxiliar na identificação de bordas anatômicas para a reconstrução do músculo. A sexta costela é identificada e marcada, pois este será o ponto de entrada na cavidade torácica. A entrada começa com a divisão dos músculos intercostais, liberação da costela posterior do diafragma e osteotomia da sexta costela. Os pontos de marcação são colocados por toda parte para referência anatômica.
Uma vez que o diafragma é exposto, um grampeador GIA é usado para dividir o diafragma. As aderências pulmonares ao aneurisma torácico são então lisadas. O rim esquerdo foi então identificado e mobilizado. O diafragma é dividido ainda mais e o pericárdio é exposto. A artéria e veia renal esquerda e a artéria mesentérica superior são identificadas em preparação para dissecção da aorta. Os ramos do tronco celíaco são então ligados e divididos. A aorta é acompanhada para cima, continuando a expô-la e seus ramos para dissecção e ligadura antes da canulação na anastomose proximal para circulação extracorê-femoral.
Os locais de pinça para a anastomose proximal são identificados na aorta torácica descendente, e a veia e o ligamento pulmonar inferior esquerdo são mobilizados antes que uma sutura em bolsa seja colocada para a veia pulmonar inferior esquerda antes da canulação proximal. Uma incisão é feita na extremidade inferior para dissecar e colocar um cordão de bolsa para a artéria femoral, o local do bypass anastomótico distal. A colocação de uma cânula da veia pulmonar inferior esquerda até a artéria femoral permite a perfusão dos membros inferiores enquanto a aorta é reparada. Uma vez alcançada a exposição adequada, a artéria femoral esquerda é dilatada e tanto a veia pulmonar inferior esquerda quanto a artéria femoral esquerda são canuladas.
O reparo da aorta após a canulação começa com o pinçamento da aorta proximal antes da anastomose do enxerto. Durante esta fase, gerenciamos o fluxo da bomba a 500 mL/h para garantir a perfusão adequada. O enxerto é então suturado na extremidade proximal pinçada da aorta e, após a conclusão da anastomose proximal, é avaliado quanto a vazamentos no local da sutura. Uma vez que a anastomose proximal esteja segura, uma segunda pinça é colocada na aorta torácica descendente média, e a aorta é dividida longitudinalmente, com ligadura de quaisquer vasos luminais com sangramento. Durante todo o procedimento, mantemos a pressão distal média em 70 mmHg para garantir a perfusão adequada do órgão, ajustando conforme necessário com base no monitoramento intraoperatório. Essa técnica é continuada à medida que a pinça é movida sequencialmente para baixo em direção ao segmento distal do aneurisma da aorta, com incisão longitudinal contínua e ligadura dos vasos intraluminais com sangramento. O enxerto é então medido no comprimento apropriado em preparação para a anastomose distal.
A próxima parte da cirurgia envolve o tempo de isquemia visceral, uma parte sensível ao tempo do procedimento em que o segmento visceral é isquêmico devido à ligadura da artéria celíaca. Semelhante às etapas anteriores, a aorta é dividida longitudinalmente e seccionada abaixo da artéria renal direita, e os vasos sangrantes intraluminais são ligados. A aorta é então seccionada no local do implante e o enxerto é anastomosado ao segmento distal, com promessas suturadas no local da anastomose para minimizar o risco de vazamento após o enxerto ser totalmente suturado e avaliado. Uma vez avaliados, os grampos distais são removidos sequencialmente, permitindo a perfusão dos membros inferiores e vísceras. O tempo total de clampeamento para esta cirurgia foi de 21 minutos.
Após a anastomose do enxerto proximal e distalmente, o paciente é deculado no local da veia pulmonar inferior esquerda com o fechamento da sutura em bolsa na veia pulmonar inferior esquerda, seguido de decanulação da artéria femoral esquerda e fechamento da incisão na artéria femoral. À medida que a incisão para acesso à artéria femoral é fechada, o enxerto aórtico é pinçado longitudinalmente e incisado para facilitar a anastomose de um ponto de saída do braço lateral. A anastomose do braço lateral é avaliada quanto a vazamentos quando está totalmente suturada. A artéria celíaca é então anastomosada término-terminal ao segmento distal do enxerto lateral do braço e avaliada quanto a vazamentos.
Nesse ponto, todas as estruturas transitoriamente desvascularizadas são revascularizadas e o saco aneurismático é costurado novamente com o enxerto patente que transporta sangue aórtico em seu interior. A partir daí, o hemidiafragma esquerdo e a toracotomia são reparados e os drenos torácicos são colocados. A pele é fechada, concluindo assim o procedimento.
Para abordar brevemente os cuidados pós-operatórios desses pacientes, os pacientes são mantidos intubados por 24 horas até atingirem a eutermia e serem adequadamente ressuscitados. Após esse período, é dada atenção extremamente cuidadosa à avaliação neurológica do paciente (flexão do quadril/extensão da perna), sinais vitais (pressão arterial) e hemogramas completos (Hgb), pois o risco de lesão medular intraoperatória é avaliado com detalhes meticulosos. Além disso, o dreno de LCR no local deve ser gerenciado com cuidado para garantir uma pressão de perfusão arterial adequada para a medula espinhal, o que normalmente corresponde a uma baixa pressão de LCR. O dreno do LCR é normalmente mantido no local nos dois primeiros dias de pós-operatório, seguido por uma tentativa de pinçamento no segundo ou terceiro dia de pós-operatório, e (assumindo uma tentativa de pinçamento bem-sucedida) o dreno é removido no terceiro ou quarto dia de pós-operatório.
Além da morte, a paraplegia secundária à má perfusão da medula espinhal é um evento adverso significativo que pode ocorrer após esse tipo de reparo aneurismático da aorta. Crawford e colegas demonstraram que o tempo de pinçamento cruzado e a extensão do aneurisma estão diretamente associados a esse risco, e a lesão medular completa e permanente confere quase 100% de mortalidade em cinco anos após a operação48 Devido a essa morbidade potencial, investigações e pesquisas significativas foram feitas para otimizar a estratégia e proteger a perfusão. Embora muita atenção tenha sido dada à artéria espinhal anterior (de Adamkiewicz) como o principal determinante da perfusão da medula espinhal, o paradigma mudou para um "conceito de rede colateral", conforme descrito por Backes, Jacobs, Griepp, Wynn e Acher. 49-52 Essas redes colaterais incluem anastomoses das artérias subclávias, segmentares (intercostais e lombares) e ilíacas internas. Nesse modelo, desde que a perfusão adequada seja mantida a partir de duas dessas artérias, a ruptura de uma afetará minimamente o risco de dano isquêmico permanente. 53 As taxas de paraplegia diferem entre o reparo aberto e endovascular do TAAA, com incidências relatadas de aproximadamente 8,5% para o reparo aberto e 1,7% para as técnicas endovasculares em alguns estudos. Pesquisas adicionais são incentivadas para confirmar os resultados entre as populações, pois a abordagem depende da anatomia, das circunstâncias e da experiência. 55,56
O surgimento de técnicas endovasculares para o reparo do AATA reduziu as oportunidades de treinamento para o reparo cirúrgico aberto. Com menos casos abertos realizados, os estagiários têm exposição limitada às habilidades complexas necessárias para dissecção da aorta e colocação de enxerto. Essa tendência corre o risco de uma escassez de cirurgiões proficientes em reparo aberto, particularmente para pacientes inadequados para abordagens endovasculares. Abordar essa questão requer estratégias alternativas de treinamento, como simulação de alta fidelidade e programas centralizados em centros de alto volume.
Historicamente, o reparo de aneurismas da aorta evoluiu de Rudolph Matas realizando uma endoaneurisma para lesões arteriais em 1888, para 1951 com DeBakey e colegas tentando excisão e aortorrafia em pacientes com aneurismas, para o estabelecimento de programas de cirurgia aórtica ativa em centros médicos em todo o país. A inovação médica no domínio do aneurisma da aorta explodiu recentemente, com avanços individuais nas modalidades de imagem, enxertos, medicamentos anticoagulantes e circulação extracorpórea, todos contribuindo para melhores abordagens para resolver um problema médico com uma consequência quase fatal se rompido. Além disso, as abordagens endovasculares entraram em primeiro plano para as principais considerações ao planejar reparos de aneurisma da aorta sem contraindicações. 54 À medida que nossas imagens, medicamentos, instrumentos cirúrgicos e outros participantes da cirurgia aórtica continuam a evoluir, também evoluirá nossa capacidade de realizar esses procedimentos com segurança e eficácia para nossos pacientes.
Grampeador GIA; enxerto protético.
Nada a divulgar.
O paciente referido neste artigo em vídeo deu seu consentimento informado para ser filmado e está ciente de que informações e imagens serão publicadas online.
References
- Associação de colágeno, elastina, glicosaminoglicanos e macrófagos com a resistência e alongamento do material final do tecido em aneurismas da aorta torácica humana: um estudo de tensão uniaxial. J Biomech Eng. 2022; 144(10):101001. DOI:10.1115/1.4054060.
- Kadoglou NP, Liapis CD. Metaloproteinases da matriz: contribuição para a patogênese, diagnóstico, vigilância e tratamento dos aneurismas da aorta abdominal. Curr Med Res Opin. 2004; 20(4):419-432. DOI:10.1185/030079904125003143.
-
Savoia C, Burger D, Nishigaki N, Montezano A, Touyz RM. Especialista Rev Mol Med. 30 de março de 2011; 13:e11. DOI:10.1017/S1462399411001815.
- Estresse oxidativo, Noxs e hipertensão: evidências experimentais e controvérsias clínicas [correção publicada aparece em Ann Med. 2012 Dez; 44(8):854-8]. Ann Med. 2012; 44 Suppl 1:S2-S16. DOI:10.3109/07853890.2011.653393.
- Garrido AM, Griendling KK. NADPH oxidases e sinalização do receptor de angiotensina II. Mol Cell Endocrinol. 2009; 302(2):148-158. DOI:10.1016/j.mce.2008.11.003.
- Saratzis A, Bown MJ. A base genética para a doença aneurismática da aorta. Coração. 2014; 100(12):916-922. DOI:10.1136/heartjnl-2013-305130.
- Pleumeekers HJ, Hoes AW, van der Does E, et al. Aneurismas da aorta abdominal em idosos. O Estudo de Roterdã. Am J Epidemiol. 1995; 142(12):1291-1299. DOI:10.1093/oxfordjournals.aje.a117596.
- Boese AC, Chang L, Yin KJ, Chen YE, Lee JP, Hamblin MH. Diferenças sexuais nos aneurismas da aorta abdominal. Am J Physiol Heart Circ Physiol. 2018; 314(6):H1137-H1152. DOI:10.1152/ajpheart.00519.2017.
- Ghosh A, Pechota A, Coleman D, Upchurch GR Jr, Eliason JL. A secreção de MMP2 e MMP9 induzida pela fumaça de cigarro das células lisas vasculares da aorta é mediada pela via Jak/Stat. Hum Pathol. 2015; 46(2):284-294. DOI:10.1016/j.humpath.2014.11.003.
-
Wang S, Zhang C, Zhang M, et al. A ativação da proteína quinase α2 ativada por AMP pela nicotina instiga a formação de aneurismas da aorta abdominal em camundongos in vivo. Nat Med. Junho de 2012; 18(6):902-10. DOI:10.1038/nm.2711.
- Johansson G, Markström U, Swedenborg J. Aneurismas rotos da aorta torácica: um estudo das taxas de incidência e mortalidade. J Vasc Surg. 1995; 21(6):985-988. DOI:10.1016/S0741-5214(95)70227-X.
- Força-Tarefa de Serviços Preventivos dos EUA. Triagem para aneurisma da aorta abdominal: Declaração de recomendação da Força-Tarefa de Serviços Preventivos dos EUA. JAMA. 2019; 322(22):2211–2218. DOI:10.1001/jama.2019.18928.
- Keisler B, Carter C. Aneurisma da aorta abdominal. Sou médico da família. 2015; 91(8):538-543.
- Hirsch AT, Haskal ZJ, Hertzer NR, et al. Diretrizes práticas do ACC / AHA 2005 para o tratamento de pacientes com doença arterial periférica (extremidade inferior, aorta renal, mesentérica e abdominal): um relatório colaborativo da Associação Americana de Cirurgia Vascular / Sociedade de Cirurgia Vascular, Sociedade de Angiografia Cardiovascular e Intervenções, Sociedade de Medicina e Biologia Vascular, Sociedade de Radiologia Intervencionista, e a Força-Tarefa ACC/AHA sobre Diretrizes Práticas (Comitê de Redação para Desenvolver Diretrizes para o Manejo de Pacientes com Doença Arterial Periférica): endossado pela Associação Americana de Reabilitação Cardiovascular e Pulmonar; Instituto Nacional do Coração, Pulmão e Sangue; Sociedade de Enfermagem Vascular; Consenso Inter-Sociedade Transatlântico; e Fundação de Doenças Vasculares. Circulação. 2006; 113(11):e463-e654. DOI:10.1161/CIRCULATIONAHA.106.174526.
- Hiratzka LF, Bakris GL, Beckman JA, et al. 2010 Diretrizes ACCF/AHA/AATS/ACR/ASA/SCA/SCAI/SIR/STS/SVM para o diagnóstico e tratamento de pacientes com Doença da Aorta Torácica: um relatório da Força-Tarefa da American College of Cardiology Foundation/American Heart Association sobre Diretrizes Práticas, Associação Americana de Cirurgia Torácica, American College of Radiology, American Stroke Association, Sociedade de Anestesiologistas Cardiovasculares, Sociedade de Angiografia e Intervenções Cardiovasculares, Sociedade de Radiologia Intervencionista, Sociedade de Cirurgiões Torácicos e Sociedade de Medicina Vascular [correção publicada aparece em Circulação. 27 de julho de 2010; 122(4):e410]. Circulação. 2010; 121(13):e266-e369. DOI:10.1161/CIR.0b013e3181d4739e.
- Coady MA, Davies RR, Roberts M, et al. Padrões familiares de aneurismas da aorta torácica. Arco Surg. 1999; 134(4):361-367. DOI:10.1001/archsurg.134.4.361.
- Albornoz G, Coady MA, Roberts M, et al. Aneurismas e dissecções da aorta torácica familiar - incidência, modos de herança e padrões fenotípicos. Cirurgia de Ann Thorac. 2006; 82(4):1400-1405. DOI:10.1016/j.athoracsur.2006.04.098.
- Akkersdijk GJ, van Bockel JH. Aneurisma roto da aorta abdominal: diagnóstico inicial incorreto e efeito no tratamento. Eur J Surg. 1998; 164(1):29-34. DOI:10.1080/110241598750004922.
- Gloviczki P, Pairolero PC, Mucha P Jr, et al. Aneurismas rotos da aorta abdominal: o reparo não deve ser negado. J Vasc Surg. 1992; 15(5):851-859.
- Meijer CA, Stijnen T, Wasser MN, et al. Doxiciclina para estabilização de aneurismas da aorta abdominal: um estudo randomizado. Ann Estagiária Med. 2013; 159(12):815-823. DOI:10.7326/0003-4819-159-12-201312170-00007.
- Baxter BT, Matsumura J, Curci JA, et al. Efeito da doxiciclina no crescimento do aneurisma entre pacientes com pequenos aneurismas da aorta abdominal infrarrenal: um ensaio clínico randomizado. JAMA. 2020; 323(20):2029-2038. DOI:10.1001/jama.2020.5230.
- Ensaio clínico de tratamento não invasivo de aneurisma da aorta abdominal (N-TA(3)CT): desenho de um ensaio clínico randomizado de fase IIb, controlado por placebo, duplo-cego e randomizado de doxiciclina para a redução do crescimento de pequenos aneurismas da aorta abdominal. Julgamentos de Contemp Clin. 2016;48:91-98. DOI:10.1016/j.cct.2016.03.008.
- Davies RR, Goldstein LJ, Coady MA, et al. Taxas anuais de ruptura ou dissecção para aneurismas da aorta torácica: previsão simples baseada no tamanho. Cirurgia de Ann Thorac. 2002; 73(1):17-28. DOI:10.1016/s0003-4975(01)03236-2.
- Walsh SR, Tang TY, Sadat U, et al. Implante de stent endovascular versus cirurgia aberta para doença da aorta torácica: revisão sistemática e meta-análise dos resultados perioperatórios. J Vasc Surg. 2008; 47(5):1094-1098. DOI:10.1016/j.jvs.2007.09.062.
- Cheng D, Martin J, Shennib H, et al. Reparo aórtico endovascular versus reparo cirúrgico aberto para doença da aorta torácica descendente: uma revisão sistemática e meta-análise de estudos comparativos. J Am Coll Cardiol. 2010; 55(10):986-1001. DOI:10.1016/j.jacc.2009.11.047.
- Abraha I, Romagnoli C, Montedori A, Cirocchi R. Endoprótese torácica versus cirurgia para aneurisma torácico. Sistema de banco de dados Cochrane Rev. 2013; (9):CD006796. Publicado em 11 de setembro de 2013. DOI:10.1002/14651858.CD006796.pub3.
- Matsumura JS, Cambria RP, Dake MD, et al. Ensaio clínico internacional controlado de reparo de aneurisma endovascular torácico com o enxerto endovascular Zenith TX2: resultados de 1 ano. J Vasc Surg. 2008; 47(2):247-257. DOI:10.1016/j.jvs.2007.10.032.
- Bavaria JE, Appoo JJ, Makaroun MS, et al. Endoprótese endovascular versus reparo cirúrgico aberto de aneurismas da aorta torácica descendente em pacientes de baixo risco: um estudo comparativo multicêntrico. J Tórax Cardiovasc Surg. 2007; 133(2):369-377. DOI:10.1016/j.jtcvs.2006.07.040.
- Svensson LG, Crawford ES, Hess KR, Coselli JS, Safi HJ. Experiência com 1509 pacientes submetidos a operações aórticas toracoabdominais. J Vasc Surg. 1993; 17(2):357-370.
- Greenberg RK, Lu Q, Roselli EE, et al. Análise contemporânea do reparo de aneurisma torácico e toracoabdominal descendente: uma comparação de técnicas endovasculares e abertas. Circulação. 2008; 118(8):808-817. DOI:10.1161/CIRCULATIONAHA.108.769695.
- Jackson BM, Carpenter JP, Fairman RM, et al. Exclusão anatômica do reparo endovascular de aneurisma da aorta torácica. J Vasc Surg. 2007; 45(4):662-666. DOI:10.1016/j.jvs.2006.12.062.
- Investigadores do estudo EVAR do Reino Unido, Greenhalgh RM, Brown LC, et al. Reparo endovascular versus aberto de aneurisma da aorta abdominal. N Engl J Med. 2010; 362(20):1863-1871. DOI:10.1056/NEJMoa0909305.
- Bulder RMA, Bastiaannet E, Hamming JF, Lindeman JHN. Meta-análise da sobrevida em longo prazo após reparo endovascular ou aberto eletivo de aneurisma da aorta abdominal. Br J Surg. 2019; 106(5):523-533. DOI:10.1002/bjs.11123.
- Powell JT, Sweeting MJ, Ulug P, et al. Meta-análise de dados de pacientes individuais de ensaios EVAR-1, DREAM, OVER e ACE comparando os resultados do reparo endovascular ou aberto para aneurisma da aorta abdominal ao longo de 5 anos [correção publicada aparece em Br J Surg. 2018 agosto; 105(9):1222. DOI:10.1002/bjs.10928]. Br J Surg. 2017; 104(3):166-178. DOI:10.1002/bjs.10430.
- Paravastu SC, Jayarajasingam R, Cottam R, Palfreyman SJ, Michaels JA, Thomas SM. Sistema de banco de dados Cochrane Rev. 2014; 2014(1):CD004178. Publicado em 23 de janeiro de 2014. DOI:10.1002/14651858.CD004178.pub2.
- Stather PW, Sidloff D, Dattani N, Choke E, Bown MJ, Sayers RD. Revisão sistemática e meta-análise dos resultados precoces e tardios do reparo aberto e endovascular do aneurisma da aorta abdominal. Br J Surg. 2013; 100(7):863-872. DOI:10.1002/bjs.9101.
- Lederle FA, Freischlag JA, Kyriakides TC, et al. Comparação a longo prazo do reparo endovascular e aberto do aneurisma da aorta abdominal. N Engl J Med. 2012; 367(21):1988-1997. DOI:10.1056/NEJMoa1207481.
- Participantes do estudo EVAR. Reparo endovascular de aneurisma versus reparo aberto em pacientes com aneurisma da aorta abdominal (ensaio EVAR 1): ensaio clínico randomizado e controlado. Lanceta. 2005; 365(9478):2179-2186. DOI:10.1016/S0140-6736(05)66627-5.
- De Bruin JL, Baas AF, Buth J, et al. Resultado a longo prazo do reparo aberto ou endovascular do aneurisma da aorta abdominal. N Engl J Med. 2010; 362(20):1881-1889. DOI:10.1056/NEJMoa0909499.
- Blankensteijn JD, de Jong SE, Prinssen M, et al. Resultados de dois anos após correção convencional ou endovascular de aneurismas da aorta abdominal. N Engl J Med. 2005; 352(23):2398-2405. DOI:10.1056/NEJMoa051255.
- Brown LC, Thompson SG, Greenhalgh RM, Powell JT; Participantes do estudo de reparo de aneurisma endovascular. Incidência de eventos cardiovasculares e morte após correção aberta ou endovascular de aneurisma de aorta abdominal no estudo randomizado EVAR 1. Br J Surg. 2011; 98(7):935-942. DOI:10.1002/bjs.7485.
- Becquemin JP, Pillet JC, Lescalie F, et al. Um estudo controlado randomizado de reparo de aneurisma endovascular versus cirurgia aberta para aneurismas da aorta abdominal em pacientes de risco baixo a moderado. J Vasc Surg. 2011; 53(5):1167-1173.e1. DOI:10.1016/j.jvs.2010.10.124.
- Siracuse JJ, Gill HL, Graham AR, et al. Segurança comparativa do reparo cirúrgico endovascular e aberto de aneurismas da aorta abdominal em pacientes do sexo masculino de baixo risco. J Vasc Surg. 2014; 60(5):1154-1158. DOI:10.1016/j.jvs.2014.05.018.
- Vallabhaneni R, Farber MA, Schneider F, Ricco JB. Debate: se pacientes jovens e de bom risco devem ser tratados com correção endovascular de aneurisma de aorta abdominal. J Vasc Surg. 2013; 58(6):1709-1715. DOI:10.1016/j.jvs.2013.09.017.
- Sandford RM, Choke E, Bown MJ, Sayers RD. Qual é a melhor opção para o reparo eletivo de um aneurisma da aorta abdominal em um paciente jovem em forma?. Eur J Vasc Endovasc Surg. 2014; 47(1):13-18. DOI:10.1016/j.ejvs.2013.09.014.
- Lee K, Tang E, Dubois L, Power AH, DeRose G, Forbes TL. A durabilidade e a sobrevida são semelhantes após o reparo endovascular eletivo e aberto de aneurismas da aorta abdominal em pacientes mais jovens. J Vasc Surg. 2015; 61(3):636-641. DOI:10.1016/j.jvs.2014.10.012.
- Siracuse JJ, Schermerhorn ML, Meltzer AJ, et al. Comparação dos resultados após correção endovascular e aberta de aneurismas da aorta abdominal em pacientes de baixo risco. Br J Surg. 2016; 103(8):989-994. DOI:10.1002/bjs.10139.
- Aneurismas da aorta toracoabdominal: fatores pré-operatórios e intraoperatórios que determinam os resultados imediatos e a longo prazo das operações em 605 pacientes. J Vasc Surg. 1986; 3(3):389-404. DOI:10.1067/mva.1986.avs0030389.
- Backes WH, Nijenhuis RJ, Mess WH, Wilmink FA, Schurink GW, Jacobs MJ. Angiografia por ressonância magnética do suprimento sanguíneo colateral para a medula espinhal em pacientes com aneurisma da aorta torácica e toracoabdominal. J Vasc Surg. Agosto de 2008; 48(2):261–271. DOI:10.1016/j.jvs.2008.03.015.
- Jacobs MJ, de Mol BA, Elenbaas T, et al. Suprimento sanguíneo da medula espinhal em pacientes com aneurismas da aorta toracoabdominal. J Vasc Surg. Janeiro de 2002; 35(1):30–37. DOI:10.1067/MVA.2002.120041.
- Griepp EB, Griepp RB. O conceito de rede colateral: minimização da paraplegia secundária à ressecção de aneurisma da aorta toracoabdominal. Tex Heart Inst J. 2010; 37(6):672–674.
- Wynn MM, Acher CW. Uma teoria moderna de isquemia/lesão medular em cirurgia aórtica toracoabdominal e suas implicações para a prevenção da paralisia. J Cardiotorácico Vasc Anesth. 2014; 28(4):1088-1099. DOI:10.1053/j.jvca.2013.12.015.
- Eagleton MJ, Shah S, Petkosevek D, Mastracci TM, Greenberg RK. A permeabilidade da artéria hipogástrica e subclávia afeta o início e a recuperação da isquemia da medula espinhal associada à endoprótese aórtica. J Vasc Surg. 2014; 59(1):89-94. DOI:10.1016/j.jvs.2013.07.007.
- Cooley DA. Uma breve história da cirurgia de aneurisma da aorta. Aorta (Stamford). 2013; 1(1):1-3. Publicado em 1º de junho de 2013. DOI:10.12945/j.aorta.2013.12.006.
- Wongkornrat W, Yamamoto S, Sekine Y, et al. Preditores de paraplegia com correção atual de aneurisma da aorta toracoabdominal. Asiático Cardiovasc Thorac Ann. 2015; 23(4):406-411. DOI:10.1177/0218492314549563.
- Kotelis D, Geisbüsch P, von Tengg-Kobligk H, Allenberg JR, Böckler D. Paraplegia nach endovaskulärer therapie der thorakalen und thorakoabdominellen Aorta [Paraplegia após correção endovascular da aorta torácica e toracoabdominal]. Zentralbl Chir. 2008; 133(4):338-343. DOI:10.1055/s-2008-1076903.
- Frederick JR, Woo YJ. Aneurisma da aorta toracoabdominal. Cirurgia Cardiotorácica de Ann. 2012; 1(3):277-285. DOI:10.3978/j.issn.2225-319X.2012.09.01.
Cite this article
Del Re A, Mohebali J, Patel VI. Correção de aneurisma da aorta toracoabdominal. J Med Insight. 2024; 2024(109). DOI:10.24296/jomi/109.


