Réparation d’un anévrisme de l’aorte thoraco-abdominale
Main Text
Table of Contents
Les anévrismes de l’aorte thoraco-abdominale (AATA) sont généralement asymptomatiques et sont découverts fortuitement à l’imagerie thoracique ou abdominale. Lorsqu’ils sont identifiés, la prise en charge est souvent expectative, en fonction de la taille de l’anévrisme et de son taux de croissance. La chirurgie est indiquée pour les anévrismes plus gros et ceux qui se dilatent rapidement afin d’éviter la rupture catastrophique de l’anévrisme. Ici, nous présentons le cas d’une femme de 70 ans atteinte d’un TAAA, que nous avions suivie avec une angiographie par tomodensitométrie en série. La décision d’opérer a été prise lorsque l’anévrisme a commencé à révéler une croissance en diamètre. Son anatomie n’était pas propice au traitement endovasculaire ; Par conséquent, nous avons réparé son anévrisme en utilisant une approche ouverte traditionnelle.
Maladie cardiovasculaire; maladie vasculaire; anévrisme; anévrisme de l’aorte ; thoraco-abdominale.
Les anévrismes de l’aorte sont des dilatations focales de l’aorte qui peuvent se produire à n’importe quel point de sa longueur, de la racine, juste au-dessus de la valve aortique, jusqu’à la bifurcation du bassin. La classification se fait par localisation anatomique et divisée en anévrismes thoraciques, abdominaux ou thoraco-abdominaux. Les anévrismes thoraciques sont divisés en deux catégories : ceux qui impliquent l’aorte racine et ascendante, ceux qui impliquent l’arc aortique et ceux qui impliquent l’aorte thoracique descendante. Les anévrismes de l’aorte thoraco-abdominale (TAAA) sont classés à l’aide de la classification de Crawford : L’étendue I englobe la majorité de l’aorte thoracique descendante, allant de l’artère sous-clavière gauche à l’aorte abdominale surrénale. L’étendue II est la plus étendue, impliquant l’aorte de l’artère sous-clavière gauche jusqu’à la bifurcation aorto-iliaque. L’étendue III comprend l’aorte thoracique distale et s’étend à la bifurcation aorto-iliaque. L’étendue IV est confinée à l’aorte abdominale sous le diaphragme. Le groupe de Safi a introduit l’extension V, qui implique l’aorte thoracique distale, y compris les origines des artères cœliaque et mésentérique supérieure, mais à l’exclusion des artères rénales (Figure 1). 57
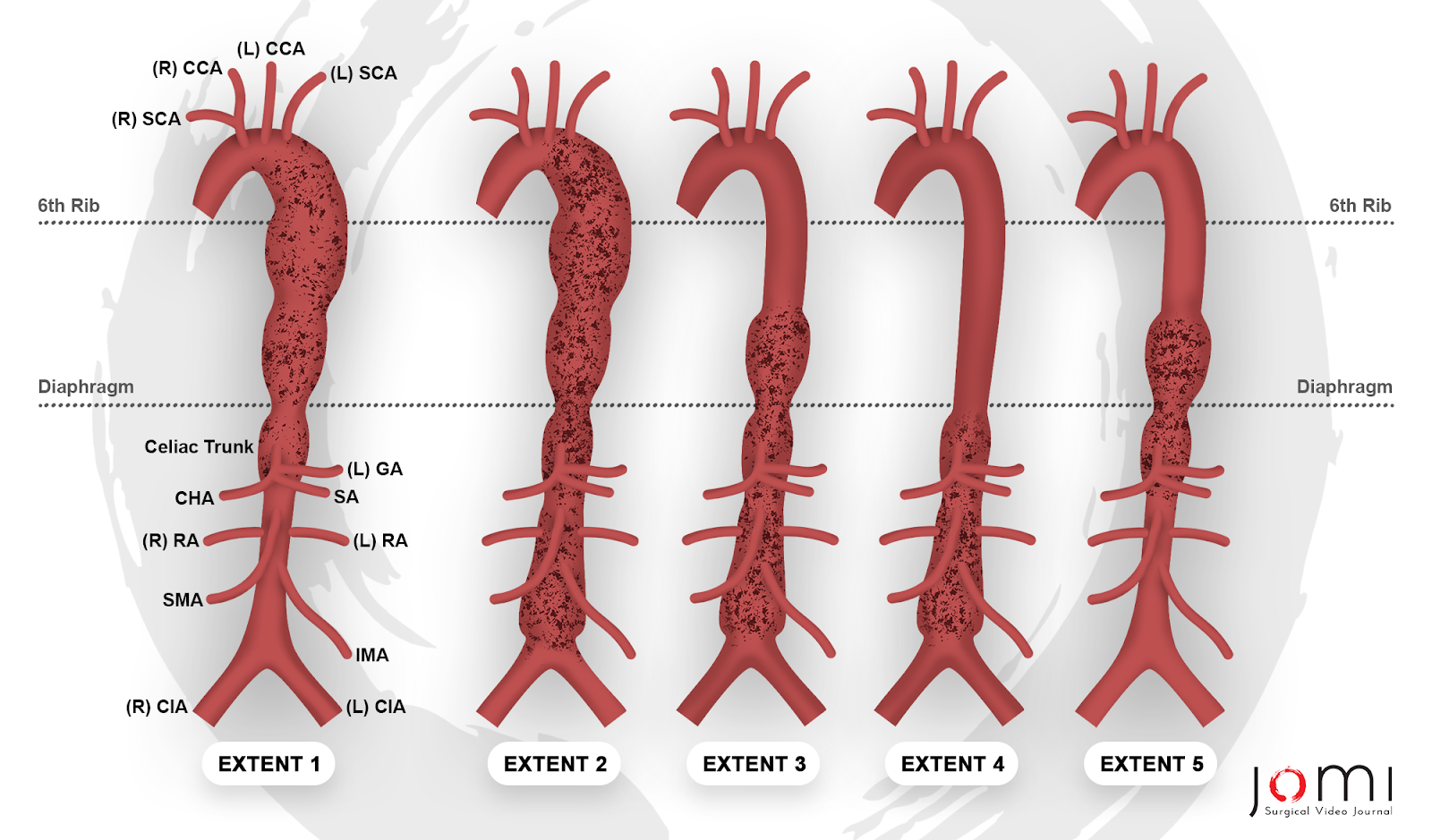
Graphique 1. Classification de Crawford de l’anévrisme de l’aorte thoraco-abdominale, modifiée par le groupe de Safi. Légende : (R) SCA - Artère sous-clavière droite, (R) CCA - Artère carotide commune droite, (L) CCA - Artère carotide commune gauche, (L) SCA - Artère sous-clavière gauche, (L) GA - Artère gastrique gauche, CHA - Artère hépatique commune, SA - Artère splénique, (R) RA - Artère rénale droite, (L) RA - Artère rénale gauche, SMA - Artère mésentérique supérieure, IMA - Artère mésentérique inférieure, (R) CIA - Artère iliaque commune droite, (L) CIA - Artère iliaque commune gauche.
L’étiologie de la dilatation est généralement multifactorielle et résulte de facteurs héréditaires et environnementaux dont la voie commune finale entraîne une dégradation des fibres de collagène et d’élastine et/ou une inhibition de leur bonne synthèse. Ces deux protéines de la matrice extracellulaire de la paroi aortique sont principalement responsables de sa résistance à la traction et de son élasticité. 1 En plus du collagène et de l’élastine, d’autres composants de la matrice extracellulaire de la paroi aortique (tels que les glycosaminoglycanes) sont diminués chez les patients atteints d’anévrismes de l’aorte, ce qui serait dû à une activité métalloprotéinase matricielle aberrante et active. 2 D’autres facteurs tels que l’angiotensine II, les minéralocorticoïdes, les espèces réactives de l’oxygène et les cellules classiquement présentes dans la réponse inflammatoire systémique ont également été impliqués dans la formation d’anévrismes de l’aorte. 3,4,5 Les causes secondaires de formation d’anévrisme sont les traumatismes et les infections, ces dernières étant classées comme anévrismes mycosiques. Enfin, des mutations génétiques héréditaires et spontanées codant pour les composants du puits aortique mentionnés ci-dessus peuvent entraîner la formation d’anévrisme en association avec des syndromes spécifiques tels que le syndrome d’Ehlers-Danlos de type IV et le syndrome de Marfan. 6
Les facteurs de risque traditionnellement associés à la pathogenèse de la dégénérescence anévrismale de l’aorte comprennent le sexe masculin, les antécédents familiaux et le tabagisme. Les différences entre les sexes dans la prévalence de l’anévrisme de l’aorte sont significatives, avec un rapport hommes/femmes de 5:1 chez les patients touchés, bien qu’un mécanisme unique d’unification de ces différences entre les sexes n’ait pas encore été élucidé. 7,8 La pathogenèse exacte du tabagisme sur la formation d’anévrisme est complexe compte tenu de l’hétérogénéité des constituants de la fumée de tabac, bien que l’association avec l’augmentation de l’expression de la métalloprotéinase matricielle soit bien étayée par la littérature. 9,10
La réparation de l’anévrisme de l’aorte est entreprise pour éviter une rupture, qui dans la plupart des cas est mortelle si elle n’est pas traitée d’urgence ou d’urgence. 11
Comme indiqué ci-dessus, les anévrismes de l’aorte sont généralement de nature insidieuse et se présentent de manière asymptomatique, le diagnostic étant souvent posé accidentellement par tomodensitométrie (TDM) pour une autre indication. Les anévrismes qui ont grossi peuvent causer des douleurs dorsales ou thoraciques, ou des symptômes secondaires à la compression des structures environnantes. Certains patients peuvent également endosser la sensation d’une « masse pulsée », au niveau de l’anévrisme. Les stigmates emboliques du thrombus mural se séparant de la paroi de l’anévrisme peuvent se manifester par des infarctus dans les organes abdominaux ou des lésions purpuriques dans les membres inférieurs, le syndrome dit du « trash-toe » ou du « blue-toe ». Comme nous l’avons vu, les patients atteints d’anévrisme peuvent avoir des éléments de leurs antécédents qui augmentent leur risque de développement d’anévrisme, tels que des antécédents de tabagisme, des antécédents d’hypertension non contrôlée ou des antécédents de maladie cardiovasculaire athéroscléreuse. S’il y a des complications secondaires de l’anévrisme, telles qu’une infection, le patient peut présenter une fièvre subjective et d’autres symptômes systémiques.
Deux scénarios d’examen physique distincts sont pertinents : la détection fortuite d’un anévrisme non rompu et l’examen au moment d’une rupture imminente ou active. Le premier peut se présenter sous la forme d’une masse particulièrement proéminente et pulsatile dans la région abdominale au-dessus et légèrement à gauche de l’ombilic. L’habitus corporel du patient et la taille de l’anévrisme affecteront grandement la capacité d’apprécier cette découverte. Des stigmates emboliques dans les membres inférieurs peuvent parfois être observés, en particulier si le pouls des membres inférieurs est palpable au niveau de la pédale. Dans les cas d’anévrismes mycosiques ou inflammatoires, des symptômes constitutionnels associés tels que des fièvres et des frissons peuvent être présents.
Contrairement à leurs homologues asymptomatiques, la rupture ou la rupture imminente se manifeste le plus souvent par une douleur à n’importe quel endroit le long de la distribution de l’anévrisme. La rupture contenue peut entraîner une compression des organes ou des structures adjacents tels que l’uretère, entraînant une hydronéphrose. La fistulisation dans les structures luminales telles que l’intestin entraînera des saignements gastro-intestinaux, tandis que la rupture dans les structures environnantes telles que la veine cave peut entraîner l’apparition soudaine d’une insuffisance cardiaque et un bruit de machine fort classique dans l’abdomen. La rupture contenue dans le rétropéritoine peut se manifester à l’extérieur par des signes de Grey Turner (ecchymose du flanc) ou de Cullen (ecchymose péri-ombilicale).
La plupart des anévrismes sont découverts fortuitement lors d’autres études ; cependant, chez ceux qui n’ont jamais eu une telle imagerie, le United States Preventive Services Task Force (USPSTF) recommande une échographie abdominale unique chez les hommes âgés de 65 à 75 ans qui ont des antécédents de tabagisme pour le dépistage de l’anévrisme de l’aorte abdominale (recommandation B). Ces recommandations ne sont pas les mêmes pour les femmes de la même catégorie d’âge et des mêmes antécédents de consommation de substances (I). 12
Les patients identifiés comme ayant des anévrismes de l’aorte sont suivis en fonction de la taille de la dilatation. Selon les recommandations de l’American Academy of Family Physicians, les patients atteints d’AAA de 3,0 à 3,9 cm de diamètre doivent être suivis par échographie de l’abdomen tous les deux à trois ans (recommandation C). Les patients présentant des AAA de 4,0 à 5,4 cm de diamètre doivent être suivis par échographie ou TDM tous les six à douze mois (recommandation C).13, 14 Les patients dont le diamètre de l’aorte dépasse 5,5 cm sont orientés vers une réparation chirurgicale élective. Dans les anévrismes de l’aorte thoracique (AAT), la surveillance consiste généralement en une imagerie axiale répétée six mois après la détection et le diagnostic initiaux afin d’évaluer la croissance ou la stabilité. La prise en charge et les modalités d’imagerie spécifiques pour la surveillance continue des TAA dépendent de l’étendue, de la taille et du taux de croissance. L’échocardiographie et l’imagerie par résonance magnétique peuvent également être des options. 15 Le dépistage de l’AAT est approprié chez les patients ayant de forts antécédents familiaux. 16,17
En raison des recommandations de dépistage de l’USPSTF, de la Society for Vascular Surgery et de l’American College of Radiology, les anévrismes de l’aorte abdominale peuvent être détectés et suivis de manière appropriée avec les endroits où ils auraient pu continuer à se développer. Cela permet une atténuation planifiée en fonction de l’étendue de la taille de l’anévrisme ou du taux de croissance via la gestion des facteurs de risque ou une consultation chirurgicale.
Les patients qui ne font pas partie des catégories de risque pour le dépistage peuvent toujours développer des anévrismes de l’aorte et ne jamais les visualiser, où ils peuvent être asymptomatiques au point de se rompre. Certaines études ont suggéré qu’environ 70 à 80 % des patients amenés aux urgences pour une rupture d’anévrisme de l’aorte n’avaient pas d’antécédents connus ou de connaissance d’un anévrisme de l’aorte diagnostiqué. 18,19
Les anévrismes de l’aorte asymptomatiques qui ne répondent pas aux critères de diamètre/expansion appropriés pour la réparation sont pris en charge par la réduction des facteurs de risque cardiovasculaires. Ceci est réalisé grâce à un traitement antihypertenseur et aux statines, en plus du sevrage tabagique. D’autres thérapies pharmacologiques telles que la doxycycline sont à l’étude pour leurs propriétés anti-MMP, mais dans l’état actuel des choses, il n’existe aucune donnée suggérant des avantages substantiels pour l’atténuation du risque d’anévrisme en dehors de ceux mentionnés précédemment. 20,21,22
Les anévrismes de l’aorte dans lesquels le risque de rupture dépasse le risque de chirurgie sont orientés vers une consultation chirurgicale pour réparer l’anévrisme. Bien qu’elle soit considérée comme une prophylaxie, la réparation d’un anévrisme de l’aorte à haut risque a un taux de survie à 5 ans significativement meilleur que la réparation d’un anévrisme de l’aorte rompu. 23 Les options chirurgicales pour la réparation d’un anévrisme comprennent l’anévrisme ouvert, endovasculaire ou un hybride des deux. Le choix entre les modalités de procédure dépend des spécificités du cas du patient, telles que l’emplacement le long de l’aorte ou d’autres considérations anatomiques, en plus de l’étendue de l’anévrisme. D’autres considérations plus nuancées, telles que l’étiologie exacte de l’anévrisme (dégénératif ou partie d’un syndrome génétique) entrent également en ligne de compte dans la décision, car les patients qui seraient autrement de bons candidats pour la thérapie endovasculaire sont plutôt traités chirurgicalement si l’étiologie de l’anévrisme est considérée comme étant de nature génétique.
Bien sûr, les comorbidités médicales du patient qui auraient un impact sur sa candidature à la chirurgie sont également prises en considération.
La réparation endovasculaire consiste à placer un tube de tissu affaissé tissé à un stent, une greffe de stent, dans l’aorte à partir d’une ou des deux artères fémorales. La greffe d’endoprothèse est mise en position à travers l’anévrisme sous fluoroscopie, puis déployée de manière à ce qu’elle puisse se dilater et passer de l’aorte normale à l’aorte normale ou aux artères iliaques distalement. L’anévrisme est efficacement « scellé » de la pression artérielle systémique et le flux est maintenu à travers l’aorte. Les anévrismes impliquant l’aorte thoraco-abdominale, cependant, sont beaucoup plus difficiles car les principaux vaisseaux sanguins alimentant les organes abdominaux proviennent de l’anévrisme lui-même. Traditionnellement, le déploiement d’une endoprothèse dans la zone entraînerait une perturbation du flux sanguin vers ces organes. Bien qu’il existe des techniques endovasculaires avancées et très élégantes pour traiter et maintenir le flux sanguin vers ces vaisseaux tout en scellant simultanément l’anévrisme, les détails dépassent la portée de ce chapitre. L’accent est plutôt mis ici sur la réparation chirurgicale ouverte du TAAA. L’opération consiste à exposer l’aorte en accédant à la fois aux cavités thoraciques et abdominales, à mobiliser les organes et les tissus adjacents de l’aorte, à contrôler l’aorte au-dessus et en dessous de l’anévrisme, à contrôler tous les vaisseaux ramifiés provenant de l’anévrisme, à arrêter le flux sanguin à travers le segment anévrismal, puis à remplacer toute l’aorte anévrismale par une greffe de tissu et à rétablir le flux vers les artères ramifiées. Des adjuvants tels que le pontage auriculaire-fémoral sont utilisés pour aider à minimiser et à atténuer les effets de l’ischémie des organes pendant la réparation.
Des études observationnelles et prospectives ont montré que la thérapie endovasculaire conférait un avantage en matière de mortalité périopératoire, bien que la supériorité de la thérapie endovasculaire par rapport à la thérapie chirurgicale reste contestée lorsque l’on considère la mortalité à court terme, en particulier en ce qui concerne la réparation de l’aorte thoracique. 24-31 Les conclusions des essais DREAM, EVAR-1, OVER et ACE, évaluant la prise en charge de l’AAA infrarénal, semblent corroborer les études antérieures identifiant un bénéfice de mortalité à court terme par rapport à la chirurgie ouverte, bien que ces essais ne montrent aucune différence significative dans les résultats à long terme jusqu’à 10 ans. 32-42 Ces données ont aidé les fournisseurs à déterminer le déroulement de l’intervention le plus approprié pour les patients qui entrent dans ces catégories. Les patients plus âgés qui présentent un risque périopératoire sont des candidats plus appropriés pour un traitement endovasculaire, bien que le risque pour les patients plus jeunes, par ailleurs en bonne santé, présentant un risque périopératoire plus faible, soit moins clair et justifie une enquête plus approfondie. 43 à 47
Dans ce cas, on a diagnostiqué chez le patient une TAAA de type I, c’est-à-dire qu’une atteinte aortique s’étendait de l’aorte descendante à l’aorte abdominale suprarénale. Dans le cas spécifique de ce patient, son anévrisme commence juste au-delà de l’origine de l’artère sous-clavière gauche et s’étend à travers l’aorte thoracique pour se terminer au niveau de son segment viscéral. Le plan pour l’opération de ce patient implique l’exposition des aortes thoracique, abdominal et infrarénal proximal, le contrôle des vaisseaux viscéraux, le placement du patient dans un pontage fémoral auriculaire gauche, la mise en place d’un greffon et la fermeture abdominale.
Le patient est placé dans une position de décubitus latéral droit (comme il est d’usage dans la réparation TAAA de type I à III) pour permettre un accès facile à la poitrine et à l’abdomen. Des drains lombaires et des sondes de potentiel évoqué moteur sont également placés pour l’évaluation de la moelle épinière tout au long de la procédure. L’incision primaire est pratiquée le long de la base du cou entre la colonne vertébrale et l’omoplate à un angle oblique, passant sous l’extrémité de l’omoplate et suivant parallèlement aux côtes, se terminant à un espace entre l’ombilic du patient et la symphyse pubienne.
Une attention particulière est portée lors de l’incision primaire pour ne pas pénétrer le fascia avant qu’il ne soit complètement exposé sur toute l’incision. Les petits vaisseaux hémorragiques sont identifiés et électrocautérisés pour prévenir les saignements lorsque l’héparine est administrée plus tard dans la procédure. Après l’exposition du fascia, la division de la musculature superposée, y compris le grand dorsal, le trapèze, le dentelé antérieur et les rhomboïdes, se produit séparément, la création de lambeaux se produisant pour permettre une reconstruction plus facile à la fin de la procédure. Des sutures de marquage sont également placées pour aider à identifier les frontières anatomiques pour la reconstruction musculaire. La sixième côte est identifiée et marquée, car ce sera le point d’entrée dans la cavité thoracique. L’entrée commence par la division des muscles intercostaux, la libération de la côte postérieure du diaphragme et l’ostéotomie de la sixième côte. Des points de marquage sont placés partout pour la référence anatomique.
Une fois le diaphragme exposé, une agrafeuse GIA est utilisée pour diviser le diaphragme. Les adhérences pulmonaires à l’anévrisme thoracique sont ensuite lysées. Le rein gauche a ensuite été identifié et mobilisé. Le diaphragme est encore divisé et le péricarde est exposé. L’artère et la veine rénales gauches ainsi que l’artère mésentérique supérieure sont identifiées en préparation de la dissection de l’aorte. Les branches du tronc cœliaque sont ensuite ligaturées et divisées. L’aorte est suivie vers le haut, en continuant à l’exposer ainsi que ses branches pour la dissection et la ligature avant la canulation à l’anastomose proximale pour le pontage atrio-fémoral.
Des sites de clamp pour l’anastomose proximale sont identifiés au niveau de l’aorte thoracique descendante, et la veine pulmonaire inférieure gauche et le ligament sont mobilisés avant qu’une suture de cordon de bourse ne soit placée pour la veine pulmonaire inférieure gauche avant la canulation proximale. Une incision est pratiquée dans le membre inférieur pour disséquer et placer un cordon de bourse pour l’artère fémorale, le site de pontage anastomotique distal. La mise en place d’une canule à partir de la veine pulmonaire inférieure gauche jusqu’à l’artère fémorale permet la perfusion des membres inférieurs pendant que l’aorte est réparée. Une fois l’exposition appropriée obtenue, l’artère fémorale gauche est dilatée et la veine pulmonaire inférieure gauche et l’artère fémorale gauche sont canulées.
La réparation de l’aorte après canulation commence par le clampage de l’aorte proximale avant l’anastomose du greffon. Au cours de cette phase, nous gérons le débit de la pompe à 500 ml/h pour assurer une perfusion adéquate. Le greffon est ensuite suturé à l’extrémité proximale clampée de l’aorte, et une fois l’anastomose proximale terminée, il est évalué pour détecter les fuites au site de suture. Une fois que l’anastomose proximale est sécurisée, une deuxième pince est placée au niveau de l’aorte thoracique descendante médiane, et l’aorte est divisée longitudinalement, avec ligature de tous les vaisseaux luminaux saignants. Tout au long de la procédure, nous maintenons une pression distale moyenne à 70 mmHg pour assurer une bonne perfusion des organes, en ajustant si nécessaire en fonction de la surveillance peropératoire. Cette technique se poursuit lorsque la pince est déplacée séquentiellement vers le bas vers le segment distal de l’anévrisme aortique, avec une incision longitudinale continue et une ligature des vaisseaux intraluminaux saignants. Le greffon est ensuite mesuré à la longueur appropriée en préparation de l’anastomose distale.
La partie suivante de la chirurgie implique un temps d’ischémie viscérale, une partie sensible au temps de la procédure dans laquelle le segment viscéral est ischémique en raison de la ligature de l’artère cœliaque. Comme pour les étapes précédentes, l’aorte est divisée longitudinalement et transectée sous l’artère rénale droite, et les vaisseaux hémorragiques intraluminaux sont ligaturés. L’aorte est ensuite transectée au site d’implantation, et le greffon est anastomosé au segment distal, avec des serments suturés au site de l’anastomose pour minimiser le risque de fuite une fois que le greffon est complètement suturé et évalué. Une fois évaluées, les pinces distales sont retirées séquentiellement, ce qui permet la perfusion des membres inférieurs et des viscères. Le temps total de clampage pour cette chirurgie était de 21 minutes.
Après l’anastomosation du greffon à la fois proximale et distale, le patient est décanulé au site de la veine pulmonaire inférieure gauche avec la fermeture de la suture du cordon de bourse sur la veine pulmonaire inférieure gauche, suivie d’une décanulation de l’artère fémorale gauche et de la fermeture de l’incision au niveau de l’artère fémorale. L’incision d’accès à l’artère fémorale étant fermée, le greffon aortique est clampé longitudinalement et incisé pour faciliter l’anastomose d’un point de sortie du bras latéral. L’anastomose du bras latéral est évaluée pour détecter les fuites une fois qu’elle est complètement suturée. L’artère cœliaque est ensuite anastomosée d’un bout à l’autre du segment distal du greffon de bras latéral et évaluée pour détecter les fuites.
À ce stade, toutes les structures dévascularisées transitoirement sont revascularisées et le sac d’anévrisme est recousu avec le greffon perméable transportant le sang aortique à l’intérieur. À partir de là, l’hémidiaphragme gauche et la thoracotomie sont réparés et des drains thoraciques sont mis en place. La peau est fermée, concluant ainsi la procédure.
Pour aborder brièvement les soins postopératoires de ces patients, les patients sont maintenus intubés pendant 24 heures jusqu’à ce qu’ils atteignent l’euthermie et soient réanimés de manière adéquate. Après cette période, une attention extrêmement particulière est accordée à l’évaluation neurologique du patient (flexion de la hanche/extension de la jambe), aux signes vitaux (pression artérielle) et à la numération globulaire complète (Hgb), car le risque de lésion peropératoire de la moelle épinière est évalué avec des détails méticuleux. De plus, le drain de LCR en place doit être géré avec soin pour assurer une pression de perfusion artérielle adéquate à la moelle épinière, ce qui correspond normalement à une faible pression du LCR. Le drain de LCR est normalement maintenu en place pendant les deux premiers jours postopératoires, suivis d’un essai de clampage le deuxième ou le troisième jour postopératoire, et (en supposant que l’essai de clampage réussit) le drain est retiré le troisième ou quatrième jour postopératoire.
Outre le décès, la paraplégie secondaire à une mauvaise perfusion de la moelle épinière est un événement indésirable important qui peut survenir après ce type de réparation anévrismale de l’aorte. Crawford et ses collègues ont démontré que le temps de clampage croisé et l’étendue anévrismale sont directement associés à ce risque, et qu’une lésion complète et permanente de la moelle épinière confère une mortalité proche de 100 % cinq ansaprès l’opération . Bien qu’une grande attention ait été accordée à l’artère spinale antérieure (d’Adamkiewicz) en tant que principal déterminant de la perfusion de la moelle épinière, le paradigme a évolué vers un « concept de réseau collatéral » tel que décrit par Backes, Jacobs, Griepp, Wynn et Acher. 49-52 Ces réseaux collatéraux comprennent les anastomoses des artères sous-clavières, segmentaires (intercostales et lombaires) et iliaques internes. Dans ce modèle, tant qu’une perfusion adéquate est maintenue à partir de deux de ces artères, la perturbation de l’une d’entre elles affectera au minimum le risque de lésions ischémiques permanentes. 53 Les taux de paraplégie diffèrent entre la réparation ouverte et la réparation endovasculaire de TAAA, avec des incidences signalées d’environ 8,5 % pour la réparation ouverte et de 1,7 % pour les techniques endovasculaires dans certaines études. D’autres recherches sont encouragées pour confirmer les résultats dans l’ensemble des populations, car l’approche dépend de l’anatomie, des circonstances et de l’expertise. 55,56
L’essor des techniques endovasculaires pour la réparation TAAA a réduit les possibilités de formation pour la réparation chirurgicale ouverte. Avec moins de cas ouverts réalisés, les stagiaires ont une exposition limitée aux compétences complexes requises pour la dissection aortique et la pose de greffons. Cette tendance risque de provoquer une pénurie de chirurgiens compétents en réparation ouverte, en particulier pour les patients inadaptés aux approches endovasculaires. Pour résoudre ce problème, il faut des stratégies de formation alternatives, telles que la simulation haute fidélité et des programmes centralisés dans des centres à fort volume.
Historiquement, la réparation des anévrismes de l’aorte a évolué de Rudolph Matas effectuant une endoanévriscopie pour les lésions artérielles en 1888, à 1951 avec DeBakey et ses collègues tentant l’excision et l’aortorraphie sur des patients atteints d’anévrismes, à la mise en place de programmes de chirurgie aortique active dans des centres médicaux à travers le pays. L’innovation médicale dans le domaine de l’anévrisme de l’aorte a récemment explosé, avec des progrès individuels dans les modalités d’imagerie, les greffes, les médicaments anticoagulants et le pontage cardiopulmonaire contribuant tous à de meilleures approches pour résoudre un problème médical avec une conséquence presque mortelle en cas de rupture. De plus, les approches endovasculaires sont entrées au premier plan des principales considérations lors de la planification des réparations d’anévrisme de l’aorte sans contre-indications. 54 À mesure que notre imagerie, nos médicaments, nos instruments chirurgicaux et d’autres acteurs de la chirurgie de l’aorte continuent d’évoluer, notre capacité à effectuer ces procédures de manière sûre et efficace pour nos patients augmentera également.
Agrafeuse GIA ; greffe prothétique.
Rien à divulguer.
Le patient visé dans cet article vidéo a donné son consentement éclairé pour être filmé et est conscient que des informations et des images seront publiées en ligne.
References
- Tokgoz A, Wang S, Sastry P, et al. Association du collagène, de l’élastine, des glycosaminoglycanes et des macrophages avec la résistance et l’étirement ultimes des matériaux tissulaires dans les anévrismes de l’aorte thoracique humaine : une étude de tension uniaxiale. J Biomech Eng. 2022; 144(10):101001. doi :10.1115/1.4054060.
- Kadoglou NP, Liapis CD. Métalloprotéinases matricielles : contribution à la pathogenèse, au diagnostic, à la surveillance et au traitement des anévrismes de l’aorte abdominale. Curr Med Res Opin., 2004 ; 20(4):419-432. doi :10.1185/030079904125003143.
-
Savoia C, Burger D, Nishigaki N, Montezano A, Touyz RM. Angiotensine II et le phénotype vasculaire dans l’hypertension. Expert Rev Mol Med. 30 mars 2011 ; 13 :e11. doi :10.1017/S1462399411001815.
- Montezano AC, Touyz RM. Stress oxydatif, Noxs et hypertension : preuves expérimentales et controverses cliniques [correction publiée apparaît dans Ann Med. 2012 Dec ; 44(8):854-8]. Ann Med. 2012 ; 44 Suppl 1 :S2-S16. doi :10.3109/07853890.2011.653393.
- Garrido AM, Griendling KK. Signalisation des récepteurs des NADPH oxydases et de l’angiotensine II. Mol Cell Endocrinol. 2009 ; 302(2):148-158. doi :10.1016/j.mce.2008.11.003.
- Saratzis A, Bown MJ. La base génétique de la maladie anévrysmale de l’aorte. Cœur. 2014 ; 100(12):916-922. doi :10.1136/heartjnl-2013-305130.
- Pleumeekers HJ, Hoes AW, van der Does E, et al. Anévrismes de l’aorte abdominale chez les personnes âgées. L’étude de Rotterdam. Am J Epidemiol. 1995 ; 142(12):1291-1299. doi :10.1093/oxfordjournals.aje.a117596.
- Boese AC, Chang L, Yin KJ, Chen YE, Lee JP, Hamblin MH. Différences entre les sexes dans les anévrismes de l’aorte abdominale. Am J Physiol Heart Circ Physiol. 2018 ; 314(6) :H1137 à H1152. doi :10.1152/ajpheart.00519.2017.
- Ghosh A, Pechota A, Coleman D, Upchurch GR Jr, Eliason JL. La sécrétion de MMP2 et MMP9 induite par la fumée de cigarette à partir des cellules vasculaires lisses de l’aorte est médiée par la voie Jak/Stat. Hum Pathol. 2015 ; 46(2):284-294. doi :10.1016/j.humpath.2014.11.003.
-
Wang S, Zhang C, Zhang M, et al. L’activation de la protéine kinase α2 activée par l’AMP par la nicotine provoque la formation d’anévrismes de l’aorte abdominale chez la souris in vivo. Nat Med. 2012 juin ; 18(6):902-10. doi :10.1038/nm.2711.
- Johansson G, Markström U, Swedenborg J. Rupture d’anévrismes de l’aorte thoracique : une étude des taux d’incidence et de mortalité. J Vasc Surg. 1995; 21(6):985-988. doi :10.1016/s0741-5214(95)70227-x.
- Groupe de travail américain sur les services préventifs. Dépistage de l’anévrisme de l’aorte abdominale : déclaration de recommandation du groupe de travail sur les services préventifs des États-Unis. JAMA. 2019 ; 322(22) :2211 à 2218. doi :10.1001/jama.2019.18928.
- Keisler B, Carter C. Anévrisme de l’aorte abdominale. Am Fam Médecin. 2015; 91(8) :538 à 543.
- Hirsch AT, Haskal ZJ, Hertzer NR, et al. ACC/AHA 2005 Directives de pratique pour la prise en charge des patients atteints de maladie artérielle périphérique (membre inférieur, rénal, mésentérique et aortique abdominale) : un rapport collaboratif de l’American Association for Vascular Surgery/Society for Vascular Surgery, de la Society for Cardiovascular Angiography and Interventions, de la Society for Vascular Medicine and Biology, de la Society of Interventional Radiology, et le groupe de travail de l’ACC/AHA sur les lignes directrices de pratique (comité de rédaction chargé d’élaborer des lignes directrices pour la prise en charge des patients atteints de maladie artérielle périphérique) : approuvé par l’American Association of Cardiovascular and Pulmonary Rehabilitation ; Institut national du cœur, des poumons et du sang ; Société des soins infirmiers vasculaires ; Consensus intersociétés transatlantique ; et la Fondation des maladies vasculaires. Diffusion. 2006 ; 113(11) :E463 et E654. doi :10.1161/CIRCULATIONAHA.106.174526.
- Hiratzka LF, Bakris GL, Beckman JA, et al. 2010 ACCF/AHA/AATS/ACR/ASA/SCA/SCAI/SIR/STS/SVM directives pour le diagnostic et la prise en charge des patients atteints de maladie de l’aorte thoracique : un rapport du groupe de travail de l’American College of Cardiology Foundation/American Heart Association sur les directives de pratique, American Association for Thoracic Surgery, American College of Radiology, American Stroke Association, Society of Cardiovascular Anesthesiologists, Society for Cardiovascular Angiography and Interventions, Society of Interventional Radiology, Society of Thoracic Surgeons et Society for Vascular Medicine [la correction publiée paraît dans Circulation. 27 juillet 2010 ; 122(4) :E410]. Diffusion. 2010 ; 121(13) :e266 à e369. doi :10.1161/CIR.0b013e3181d4739e.
- Coady MA, Davies RR, Roberts M, et al. Modèles familiaux d’anévrismes de l’aorte thoracique. Arch Surg. 1999; 134(4):361-367. doi :10.1001/archsurg.134.4.361.
- Albornoz G, Coady MA, Roberts M, et al. Anévrismes et dissections familiaux de l’aorte thoracique - incidence, modes de transmission et modèles phénotypiques. Ann Thorac Surg. 2006; 82(4):1400-1405. doi :10.1016/j.athoracsur.2006.04.098.
- Akkersdijk GJ, van Bockel JH. Rupture de l’anévrisme de l’aorte abdominale : erreur de diagnostic initiale et effet sur le traitement. Eur J Surg. 1998 ; 164(1):29-34. doi :10.1080/110241598750004922.
- Gloviczki P, Pairolero PC, Mucha P Jr, et al. Rupture d’anévrismes de l’aorte abdominale : la réparation ne doit pas être refusée. J Vasc Surg. 1992; 15(5) :851 à 859.
- Meijer CA, Stijnen T, Wasser MN, et al. Doxycycline pour la stabilisation des anévrismes de l’aorte abdominale : un essai randomisé. Ann Intern Med. 2013; 159(12):815-823. doi :10.7326/0003-4819-159-12-201312170-00007.
- Baxter BT, Matsumura J, Curci JA et al. Effet de la doxycycline sur la croissance de l’anévrisme chez les patients atteints de petits anévrismes de l’aorte abdominale infrarénale : un essai clinique randomisé. JAMA. 2020; 323(20):2029-2038. doi :10.1001/jama.2020.5230.
- Baxter BT, Matsumura J, Curci J, et al. Traitement non invasif de l’anévrisme de l’aorte abdominale (N-TA(3)CT) : conception d’un essai clinique randomisé de phase IIb, contrôlé par placebo, en double aveugle de la doxycycline pour la réduction de la croissance de l’anévrisme de l’aorte abdominale. Procès pour outrage à la loi. 2016;48:91-98. doi :10.1016/j.cct.2016.03.008.
- Davies RR, Goldstein LJ, Coady MA, et al. Taux annuels de rupture ou de dissection pour les anévrismes de l’aorte thoracique : prédiction simple basée sur la taille. Ann Thorac Surg. 2002; 73(1):17-28. doi :10.1016/s0003-4975(01)03236-2.
- Walsh SR, Tang TY, Sadat U, et al. Endoprothèse endovasculaire par rapport à la chirurgie ouverte pour la maladie de l’aorte thoracique : revue systématique et méta-analyse des résultats périopératoires. J Vasc Surg. 2008; 47(5):1094-1098. doi :10.1016/j.jvs.2007.09.062.
- Cheng D, Martin J, Shennib H, et al. Réparation endovasculaire de l’aorte par rapport à la réparation chirurgicale ouverte pour la maladie de l’aorte thoracique descendante : une revue systématique et une méta-analyse d’études comparatives. J Am Coll Cardiol. 2010; 55(10):986-1001. doi :10.1016/j.jacc.2009.11.047.
- Abraha I, Romagnoli C, Montedori A, Cirocchi R. Greffe d’endoprothèse thoracique versus chirurgie pour l’anévrisme thoracique. Base de données Cochrane Syst Rev. 2013; (9) :CD006796. Publié le 11 septembre 2013. doi :10.1002/14651858.CD006796.pub3.
- Matsumura JS, Cambria RP, Dake MD, et al. Essai clinique international contrôlé de réparation d’anévrisme endovasculaire thoracique avec le greffon endovasculaire Zenith TX2 : résultats à 1 an. J Vasc Surg. 2008; 47(2):247-257. doi :10.1016/j.jvs.2007.10.032.
- Bavaria JE, Appoo JJ, Makaroun MS, et al. Greffe de stent endovasculaire par rapport à la réparation chirurgicale ouverte d’anévrismes de l’aorte thoracique descendante chez les patients à faible risque : un essai comparatif multicentrique. J Thorac Cardiovasc Surg. 2007; 133(2):369-377. doi :10.1016/j.jtcvs.2006.07.040.
- Svensson LG, Crawford ES, Hess KR, Coselli JS, Safi HJ. Expérience avec 1509 patients subissant des opérations de l’aorte thoraco-abdominale. J Vasc Surg. 1993 ; 17(2) :357 à 370.
- Greenberg RK, Lu Q, Roselli EE, et al. Analyse contemporaine de la réparation d’anévrisme thoracique et thoraco-abdominal descendant : une comparaison des techniques endovasculaires et ouvertes. Circulation. 2008; 118(8):808-817. doi :10.1161/CIRCULATIONAHA.108.769695.
- Jackson BM, Carpenter JP, Fairman RM, et al. Exclusion anatomique de la réparation endovasculaire de l’anévrisme de l’aorte thoracique. J Vasc Surg. 2007; 45(4):662-666. doi :10.1016/j.jvs.2006.12.062.
- Investigateurs de l’essai EVAR du Royaume-Uni, Greenhalgh RM, Brown LC, et al. Réparation endovasculaire ou ouverte de l’anévrisme de l’aorte abdominale. N Engl J Med. 2010; 362(20):1863-1871. doi :10.1056/NEJMoa0909305.
- Bulder RMA, Bastiaannet E, Hamming JF, Lindeman JHN. Méta-analyse de la survie à long terme après une réparation endovasculaire élective ou ouverte d’un anévrisme de l’aorte abdominale. Br J Surg. 2019 ; 106(5):523-533. doi :10.1002/bjs.11123.
- Powell JT, Sweeting MJ, Ulug P, et al. Méta-analyse des données individuelles des patients issues des essais EVAR-1, DREAM, OVER et ACE comparant les résultats de la réparation endovasculaire ou ouverte de l’anévrisme de l’aorte abdominale sur 5 ans [la correction publiée apparaît dans Br J Surg. 2018 août ; 105(9):1222. doi :10.1002/bjs.10928]. Br J Surg. 2017 ; 104(3):166-178. doi :10.1002/bjs.10430.
- Paravastu SC, Jayarajasingam R, Cottam R, Palfreyman SJ, Michaels JA, Thomas SM. Réparation endovasculaire de l’anévrisme de l’aorte abdominale. Base de données Cochrane Syst Rev. 2014; 2014(1) :CD004178. Publié le 23 janvier 2014. doi :10.1002/14651858.CD004178.pub2.
- Stather PW, Sidloff D, Dattani N, Choke E, Bown MJ, Sayers RD. Revue systématique et méta-analyse des résultats précoces et tardifs de la réparation ouverte et endovasculaire de l’anévrisme de l’aorte abdominale. Br J Surg. 2013; 100(7):863-872. doi :10.1002/bjs.9101.
- Lederle FA, Freischlag JA, Kyriakides TC, et al. Comparaison à long terme de la réparation endovasculaire et ouverte de l’anévrisme de l’aorte abdominale. N Engl J Med. 2012; 367(21):1988-1997. doi :10.1056/NEJMoa1207481.
- Participants à l’essai EVAR. Réparation endovasculaire de l’anévrisme par rapport à la réparation ouverte chez les patients atteints d’anévrisme de l’aorte abdominale (essai EVAR 1) : essai contrôlé randomisé. Lancet. 2005 ; 365(9478):2179-2186. doi :10.1016/S0140-6736(05)66627-5.
- De Bruin JL, Baas AF, Buth J, et al. Résultat à long terme de la réparation ouverte ou endovasculaire de l’anévrisme de l’aorte abdominale. N Engl J Med. 2010; 362(20):1881-1889. doi :10.1056/NEJMoa0909499.
- Blankensteijn JD, de Jong SE, Prinssen M, et al. Résultats à deux ans après une réparation conventionnelle ou endovasculaire d’anévrismes de l’aorte abdominale. N Engl J Med. 2005; 352(23):2398-2405. doi :10.1056/NEJMoa051255.
- Brown LC, Thompson SG, Greenhalgh RM, Powell JT ; Participants à l’essai de réparation endovasculaire d’anévrisme. Incidence des événements cardiovasculaires et des décès après réparation ouverte ou endovasculaire de l’anévrisme de l’aorte abdominale dans l’essai randomisé EVAR 1. Br J Surg. 2011 ; 98(7):935-942. doi :10.1002/bjs.7485.
- Becquemin JP, Pillet JC, Lescalie F, et al. Un essai contrôlé randomisé de la réparation endovasculaire de l’anévrisme par rapport à la chirurgie ouverte pour les anévrismes de l’aorte abdominale chez des patients à risque faible à modéré. J Vasc Surg. 2011 ; 53(5) :1167-1173.e1. doi :10.1016/j.jvs.2010.10.124.
- Siracuse JJ, Gill HL, Graham AR, et al. Sécurité comparative de la réparation endovasculaire et chirurgicale ouverte des anévrismes de l’aorte abdominale chez les patients masculins à faible risque. J Vasc Surg. 2014; 60(5):1154-1158. doi :10.1016/j.jvs.2014.05.018.
- Vallabhaneni R, Farber MA, Schneider F, Ricco JB. Débat : les patients jeunes à bon risque devraient-ils être traités par réparation endovasculaire de l’anévrisme de l’aorte abdominale ? J Vasc Surg. 2013 ; 58(6):1709-1715. doi :10.1016/j.jvs.2013.09.017.
- Sandford RM, Choke E, Bown MJ, Sayers RD. Quelle est la meilleure option pour la réparation élective d’un anévrisme de l’aorte abdominale chez un jeune patient en forme ?. Eur J Vasc Endovasc Surg. 2014 ; 47(1):13-18. doi :10.1016/j.ejvs.2013.09.014.
- Lee K, Tang E, Dubois L, Power AH, DeRose G, Forbes TL. La durabilité et la survie sont similaires après une réparation endovasculaire élective et une réparation ouverte des anévrismes de l’aorte abdominale chez les patients plus jeunes. J Vasc Surg. 2015 ; 61(3):636-641. doi :10.1016/j.jvs.2014.10.012.
- Siracuse JJ, Schermerhorn ML, Meltzer AJ, et al. Comparaison des résultats après réparation endovasculaire et ouverte des anévrismes de l’aorte abdominale chez les patients à faible risque. Br J Surg. 2016; 103(8):989-994. doi :10.1002/bjs.10139.
- Crawford ES, Crawford JL, Safi HJ, et al. Anévrismes de l’aorte thoraco-abdominale : facteurs préopératoires et peropératoires déterminant les résultats immédiats et à long terme des opérations chez 605 patients. J Vasc Surg. 1986; 3(3):389-404. doi :10.1067/mva.1986.avs0030389.
- Backes WH, Nijenhuis RJ, Mess WH, Wilmink FA, Schurink GW, Jacobs MJ. Angiographie par résonance magnétique de l’apport sanguin collatéral à la moelle épinière chez les patients atteints d’anévrisme de l’aorte thoracique et thoraco-abdominale. J Vasc Surg. août 2008 ; 48(2) :261 à 271. doi :10.1016/j.jvs.2008.03.015.
- Jacobs MJ, de Mol BA, Elenbaas T, et al. Apport sanguin de la moelle épinière chez les patients atteints d’anévrismes de l’aorte thoraco-abdominale. J Vasc Surg. janvier 2002 ; 35(1) :30 à 37. doi :10.1067/mva.2002.120041.
- Griepp EB, Griepp RB. Le concept de réseau collatéral : minimiser la paraplégie secondaire à la résection d’un anévrisme de l’aorte thoraco-abdominale. Tex Heart Inst J. 2010; 37(6) :672 à 674.
- Wynn MM, Acher CW. Une théorie moderne de l’ischémie/lésion de la moelle épinière en chirurgie aortique thoraco-abdominale et ses implications pour la prévention de la paralysie. J Cardiothorac Vasc Anesth. 2014; 28(4):1088-1099. doi :10.1053/j.jvca.2013.12.015.
- Eagleton MJ, Shah S, Petkosevek D, Mastracci TM, Greenberg RK. La perméabilité des artères hypogastriques et sous-clavières affecte le début et la récupération de l’ischémie de la moelle épinière associée à l’endogreffe aortique. J Vasc Surg. 2014; 59(1):89-94. doi :10.1016/j.jvs.2013.07.007.
- Cooley DA. Un bref historique de la chirurgie de l’anévrisme de l’aorte. Aorte (Stamford). 2013; 1(1):1-3. Publié le 1 juin 2013. doi :10.12945/j.aorta.2013.12.006.
- Wongkornrat W, Yamamoto S, Sekine Y, et al. Prédicteurs de paraplégie avec réparation actuelle de l’anévrisme de l’aorte thoraco-abdominale. Cardiovasc asiatique Thorac Ann. 2015; 23(4):406-411. doi :10.1177/0218492314549563.
- Kotelis D, Geisbüsch P, von Tengg-Kobligk H, Allenberg JR, Böckler D. Paraplegie nach endovaskulärer therapie der thorakalen und thorakoabdominellen Aorta [Paraplégie après réparation endovasculaire de l’aorte thoracique et thoraco-abdominale]. Zentralbl Chir. 2008; 133(4):338-343. doi :10.1055/s-2008-1076903.
- Frederick JR, Woo YJ. Anévrisme de l’aorte thoraco-abdominale. Ann Cardiothorac Surg. 2012; 1(3):277-285. doi :10.3978/j.issn.2225-319X.2012.09.01.
Cite this article
Del Re A, Mohebali J, Patel VI. Réparation de l’anévrisme de l’aorte thoraco-abdominale. J Med Insight. 2024; 2024(109). doi :10.24296/jomi/109.


