Reparación de aneurisma aórtico toracoabdominal
Main Text
Table of Contents
Los aneurismas de aorta toracoabdominal (AAAA) son generalmente asintomáticos y se descubren de forma incidental en las imágenes torácicas o abdominales. Cuando se identifican, el tratamiento suele ser expectante, dependiendo del tamaño del aneurisma y de su tasa de crecimiento. La cirugía está indicada para los aneurismas más grandes y aquellos que se expanden rápidamente para evitar la ruptura catastrófica del aneurisma. Presentamos el caso de una mujer de 70 años con un TAAA, a la que veníamos siguiendo con angiografías por tomografía computarizada seriadas. La decisión de operar se tomó cuando el aneurisma comenzó a revelar un crecimiento en diámetro. Su anatomía no era propicia para el tratamiento endovascular; Por lo tanto, reparamos su aneurisma utilizando un enfoque abierto tradicional.
Enfermedades cardiovasculares; enfermedades vasculares; Aneurisma; aneurisma aórtico; toracoabdominal.
Los aneurismas aórticos son dilataciones focales de la aorta que pueden ocurrir en cualquier punto a lo largo de su longitud desde la raíz, justo encima de la válvula aórtica, hasta la bifurcación en la pelvis. La clasificación es por localización anatómica y se divide en aneurismas torácicos, abdominales o toracoabdominales. Los aneurismas torácicos se dividen a su vez en los que afectan a la aorta radicular y ascendente, los que afectan al arco aórtico y los que afectan a la aorta torácica descendente. Los aneurismas de aorta toracoabdominal (AAAA) se clasifican según la clasificación de Crawford: La extensión I abarca la mayor parte de la aorta torácica descendente, desde la arteria subclavia izquierda hasta la aorta abdominal suprarrenal. La extensión II es la más extensa, ya que afecta a la aorta desde la arteria subclavia izquierda hasta la bifurcación aortoilíaca. La extensión III incluye la aorta torácica distal y se extiende hasta la bifurcación aortoilíaca. La extensión IV se limita a la aorta abdominal por debajo del diafragma. El grupo de Safi introdujo la Extensión V, que involucra la aorta torácica distal, incluyendo los orígenes de las arterias celíaca y mesentérica superior, pero excluyendo las arterias renales (Figura 1). 57
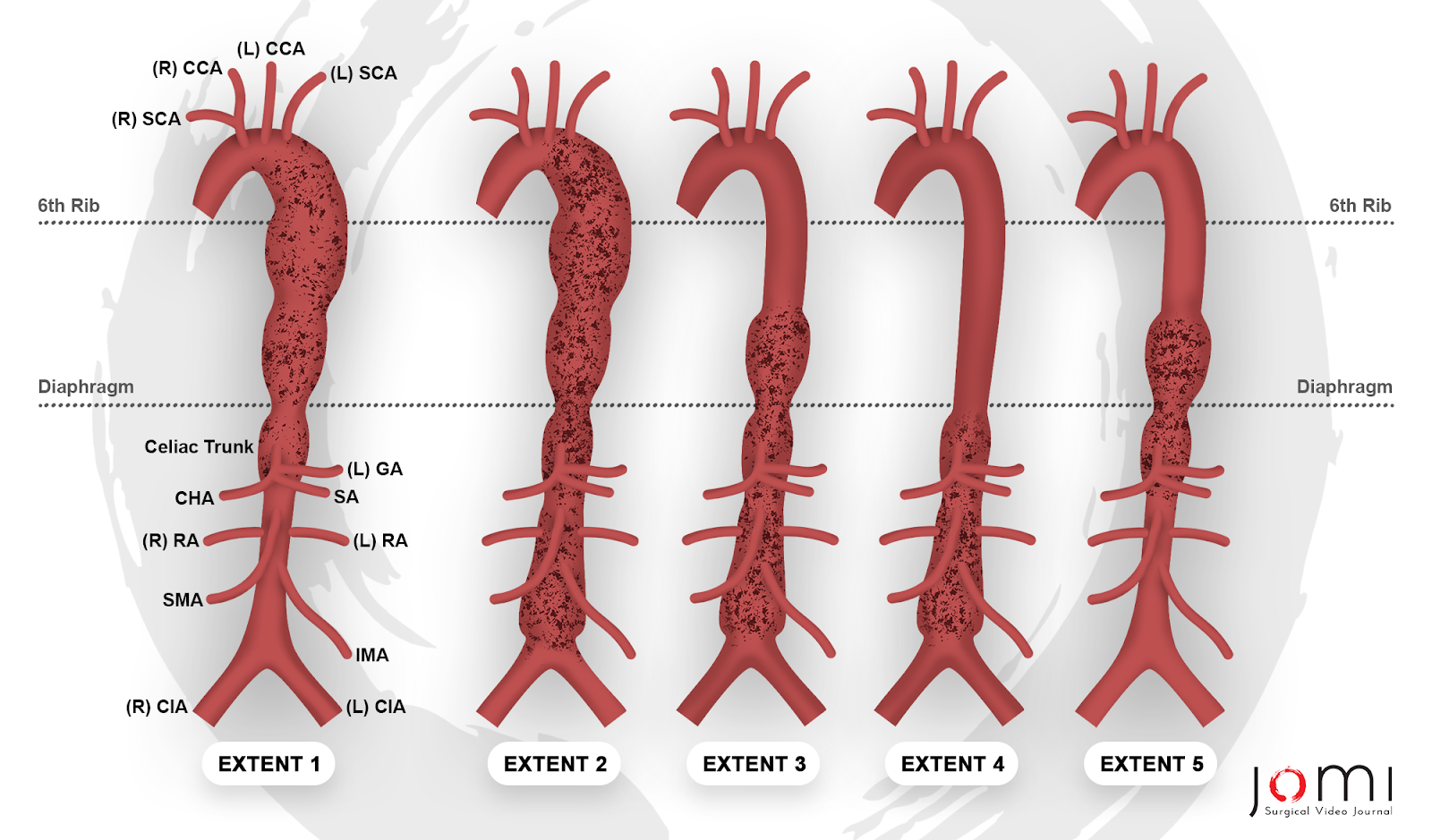
Figura 1. Clasificación de Crawford del aneurisma de aorta toracoabdominal, modificada por el grupo de Safi. Leyenda: (R) SCA - Arteria Subclavia Derecha, (R) CCA - Arteria Carótida Común Derecha, (L) CCA - Arteria Carótida Común Izquierda, (L) SCA - Arteria Subclavia Izquierda, (L) GA - Arteria Gástrica Izquierda, CHA - Arteria Hepática Común, SA - Arteria Esplénica, (R) AR - Arteria Renal Derecha, (L) AR - Arteria Renal Izquierda, AME - Arteria Mesentérica Superior, IMA - Arteria Mesentérica Inferior, (R) CIA - Arteria Ilionar Común Derecha, (L) CIA - Arteria ilíaca común izquierda.
La etiología de la dilatación es típicamente multifactorial y es el resultado de factores hereditarios y ambientales cuya vía común final resulta en una degradación de las fibras de colágeno y elastina y/o inhibición de su correcta síntesis. Estas dos proteínas de la matriz extracelular de la pared aórtica son las principales responsables de su resistencia a la tracción y elasticidad. 1 Además del colágeno y la elastina, se ha encontrado que otros componentes de la matriz extracelular de la pared aórtica (como los glicosaminoglicanos) están disminuidos en pacientes con aneurismas aórticos, lo que se sugiere que se debe a la actividad aberrantemente activa de la metaloproteinasa de la matriz. 2 Otros factores como la angiotensina II, los mineralocorticoides, las especies reactivas de oxígeno y las células clásicamente encontradas en la respuesta inflamatoria sistémica también se han implicado en la formación de aneurismas aórticos. 3,4,5 Las causas secundarias de formación de aneurismas son el traumatismo y la infección, esta última clasificada como aneurismas micóticos. Por último, las mutaciones genéticas hereditarias y espontáneas que codifican los componentes del pozo aórtico mencionados anteriormente pueden dar lugar a la formación de aneurismas asociados a síndromes específicos como el de Ehlers-Danlos tipo IV y el síndrome de Marfan. 6
Los factores de riesgo tradicionalmente asociados con la patogénesis de la degeneración aneurismática aórtica incluyen el sexo masculino, los antecedentes familiares y el tabaquismo. Las diferencias de sexo en la prevalencia de aneurismas aórticos son significativas, con una proporción de 5:1 entre hombres y mujeres de los pacientes afectados, aunque aún no se ha dilucidado un único mecanismo unificador para estas diferencias entre los sexos. 7,8 La patogenia exacta del consumo de cigarrillos en la formación de aneurismas es compleja dada la heterogeneidad de los constituyentes del humo del tabaco, aunque la asociación con el aumento de la expresión de metaloproteinasa de la matriz está bien respaldada en la literatura. 9,10
La reparación del aneurisma aórtico se lleva a cabo para evitar la ruptura, que en la mayoría de los casos es mortal si no se trata con urgencia o urgencia. 11
Como se señaló anteriormente, los aneurismas aórticos suelen ser de naturaleza insidiosa y se presentan de forma asintomática, y el diagnóstico a menudo se realiza de forma incidental en la tomografía computarizada (TC) para otra indicación. Los aneurismas que han crecido hasta convertirse en grandes pueden causar dolor de espalda o pecho, o síntomas secundarios a la compresión de las estructuras circundantes. Algunos pacientes también pueden avalar la sensación de una "masa pulsátil", a nivel del aneurisma. Los estigmas embólicos del trombo mural que se separan de la pared del aneurisma pueden manifestarse como infartos dentro de los órganos abdominales o lesiones purpúricas en las extremidades inferiores, el llamado síndrome del "dedo basura" o "dedo azul". Como se ha comentado, los pacientes con aneurisma pueden tener elementos de su historia que elevan su riesgo de desarrollo de aneurisma, como antecedentes de tabaquismo, antecedentes de hipertensión no controlada o antecedentes de enfermedad cardiovascular aterosclerótica. Si hay complicaciones secundarias del aneurisma, como infección, el paciente puede presentar fiebre subjetiva y otros síntomas sistémicos.
Dos escenarios distintos de examen físico son relevantes: la detección incidental de un aneurisma no roto y el examen en el momento de una ruptura inminente o activa. El primero puede presentarse como una masa particularmente prominente y pulsátil en la región abdominal por encima y ligeramente a la izquierda del ombligo. El habitus corporal del paciente y el tamaño del aneurisma afectarán en gran medida la capacidad de apreciar este hallazgo. Ocasionalmente se pueden ver estigmas embólicos en las extremidades inferiores, particularmente si los pulsos de las extremidades inferiores son palpables a través del nivel del pedal. En los casos de aneurismas micóticos o inflamatorios, pueden presentarse síntomas constitucionales asociados como fiebres y rigores.
A diferencia de sus contrapartes asintomáticas, la ruptura o ruptura inminente se presenta con mayor frecuencia con dolor en cualquier lugar a lo largo de la distribución del aneurisma. La ruptura contenida puede resultar en la compresión de los órganos o estructuras adyacentes, como el uréter, lo que resulta en hidronefrosis. La fistulización en estructuras luminales, como el intestino, provocará una hemorragia gastrointestinal, mientras que la ruptura en las estructuras circundantes, como la vena cava, puede provocar la aparición aguda de insuficiencia cardíaca y un clásico soplo de maquinaria ruidosa en el abdomen. La ruptura contenida en el retroperitoneo puede manifestarse externamente como signos de Grey Turner (equimosis del flanco) o de Cullen (equimosis periumbilical).
La mayoría de los aneurismas se descubren incidentalmente durante otros estudios; sin embargo, en aquellos que nunca se han sometido a este tipo de imágenes, el Grupo de Trabajo de Servicios Preventivos de los Estados Unidos (USPSTF, por sus siglas en inglés) recomienda una ecografía abdominal única en hombres de 65 a 75 años que tengan antecedentes de tabaquismo para la detección de aneurisma de aorta abdominal (AAA) (recomendación B). Estas recomendaciones no son las mismas para las mujeres dentro de la misma categoría de edad y antecedentes de consumo de sustancias (declaración I). 12
Los pacientes identificados con aneurismas aórticos se controlan de acuerdo con el tamaño de la dilatación. De acuerdo con las recomendaciones de la Academia Americana de Médicos de Familia, los pacientes con AAA de 3,0 a 3,9 cm de diámetro deben ser monitoreados mediante ecografía del abdomen cada dos o tres años (recomendación C). Los pacientes con AAA de 4,0 a 5,4 cm de diámetro deben ser seguidos mediante ecografía o TC cada seis a doce meses (recomendación C).13, 14 Los pacientes con diámetros aórticos superiores a 5,5 cm se derivan para reparación quirúrgica electiva. En los aneurismas de aorta torácica (AAT), la vigilancia suele consistir en la repetición de imágenes axiales seis meses después de la detección y el diagnóstico iniciales para evaluar el crecimiento o la estabilidad. El tratamiento y las modalidades específicas de diagnóstico por imágenes para la vigilancia continua de los AAT dependen de la extensión, el tamaño y la tasa de crecimiento. La ecocardiografía y la resonancia magnética también pueden ser opciones. 15 El cribado de TAA es apropiado en pacientes con fuertes antecedentes familiares. 16,17
Debido a las recomendaciones de detección de la USPSTF, la Sociedad de Cirugía Vascular y el Colegio Americano de Radiología, los aneurismas de aorta abdominal pueden detectarse y hacerse un seguimiento adecuado en el lugar donde podrían haber seguido creciendo. Esto permite una mitigación planificada en función de la extensión del tamaño o la tasa de crecimiento del aneurisma mediante el manejo de factores de riesgo o la consulta quirúrgica.
Los pacientes que se encuentran fuera de las categorías de riesgo para los exámenes de detección aún pueden desarrollar aneurismas aórticos y es posible que nunca se les visualicen, donde pueden ser asintomáticos hasta el punto de ruptura. Algunos estudios han sugerido que aproximadamente el 70-80% de los pacientes llevados a la sala de emergencias por aneurismas aórticos rotos no tenían antecedentes conocidos ni conocimiento de un aneurisma aórtico diagnosticado. 18,19
Los aneurismas aórticos asintomáticos que no cumplen con los criterios adecuados de diámetro/expansión para su reparación se tratan mediante la reducción de los factores de riesgo cardiovascular. Esto se logra a través de la terapia antihipertensiva y con estatinas, además del abandono del hábito tabáquico. Otras terapias farmacológicas, como la doxiciclina, están siendo investigadas por sus propiedades anti-MMP, pero en la actualidad no hay datos que sugieran beneficios sustanciales para la mitigación del riesgo de aneurisma fuera de los mencionados anteriormente. 20,21,22
Los aneurismas aórticos en los que el riesgo de rotura supera el riesgo de cirugía se derivan a una consulta quirúrgica para reparar el aneurisma. Aunque se considera profilaxis, la reparación de un aneurisma aórtico de alto riesgo tiene una tasa de supervivencia a 5 años significativamente mejor que la reparación de un aneurisma aórtico roto. 23 Las opciones quirúrgicas para la reparación de aneurismas incluyen abierta, endovascular o un híbrido de las dos. La elección entre las modalidades de procedimiento depende de las características específicas del caso del paciente, como la ubicación a lo largo de la aorta u otras consideraciones anatómicas, además de la extensión del aneurisma. Otras consideraciones más matizadas, como la etiología exacta del aneurisma (degenerativo vs. parte de un síndrome genético) también influyen en la decisión, ya que los pacientes que de otro modo serían buenos candidatos para la terapia endovascular son tratados quirúrgicamente si se cree que la etiología del aneurisma es de naturaleza genética.
Por supuesto, también se tienen en cuenta las comorbilidades médicas del paciente que afectarían su candidatura quirúrgica.
La reparación endovascular consiste en colocar un tubo de tela colapsado tejido a un stent, un injerto de stent, en la aorta desde una o ambas arterias femorales. El injerto de stent se coloca en su posición a través del aneurisma bajo fluoroscopia y luego se despliega para que pueda expandirse y tender un puente desde la aorta normal proximalmente hasta la aorta normal o las arterias ilíacas distalmente. El aneurisma está efectivamente "sellado" de la presión arterial sistémica y el flujo se mantiene a través de la aorta. Sin embargo, los aneurismas que involucran la aorta toracoabdominal son mucho más desafiantes porque los vasos sanguíneos principales que irrigan los órganos abdominales surgen del propio aneurisma. Tradicionalmente, el despliegue del injerto de stent a través de la zona provocaría la interrupción del flujo sanguíneo a estos órganos. Si bien existen técnicas endovasculares avanzadas y muy elegantes para abordar y mantener el flujo sanguíneo a estos vasos y, al mismo tiempo, sellar el aneurisma, los detalles están más allá del alcance de este capítulo. Más bien, la atención se centra aquí en la reparación quirúrgica abierta de la TAAA. La operación consiste en exponer la aorta accediendo a las cavidades torácica y abdominal, movilizar los órganos y tejidos adyacentes fuera de la aorta, controlar la aorta por encima y por debajo del aneurisma, controlar todos los vasos ramificados que surgen del aneurisma, detener el flujo sanguíneo a través del segmento aneurismal y luego reemplazar toda la aorta aneurismática con un injerto de tela y restaurar el flujo a las arterias ramificadas. Los adjuntos, como la derivación auricular-femoral, se utilizan para ayudar a minimizar y mitigar los efectos de la isquemia de órganos durante la reparación.
Se ha demostrado en estudios observacionales y prospectivos que la terapia endovascular confiere un beneficio en la mortalidad perioperatoria, aunque la superioridad de la terapia endovascular frente a la terapia quirúrgica sigue siendo discutida cuando se considera la mortalidad a corto plazo, especialmente en lo que respecta a la reparación de la aorta torácica. 24-31 Las conclusiones de los ensayos DREAM, EVAR-1, OVER y ACE, que evaluaron el tratamiento infrarrenal del AAA, parecen corroborar con estudios previos que identificaron un beneficio de mortalidad a corto plazo en comparación con la cirugía abierta, aunque estos ensayos no muestran diferencias significativas en los resultados a largo plazo hasta 10 años. 32-42 Estos datos han ayudado a los proveedores a identificar el curso de procedimiento más apropiado para los pacientes que encajan en estas categorías. Los pacientes mayores que tienen riesgo perioperatorio son candidatos más apropiados para la terapia endovascular, aunque el riesgo para los pacientes más jóvenes, por lo demás sanos, con menor riesgo perioperatorio es menos claro y amerita más investigación. 43-47
El paciente en este caso fue diagnosticado de un TAAA tipo I, es decir, la afectación aórtica se extendía desde la aorta descendente hasta la aorta abdominal suprarrenal. En el caso concreto de este paciente, el aneurisma comienza justo más allá del origen de la arteria subclavia izquierda y se extiende por la aorta torácica terminando en el segmento visceral. El plan para la cirugía de este paciente implica la exposición de la aorta torácica, abdominal e infrarrenal proximal, el control de los vasos viscerales, la colocación del paciente en la derivación femoral auricular izquierda, la colocación del injerto y el cierre abdominal.
El paciente se coloca en una posición de decúbito lateral derecho (como es habitual en la reparación de TAAA tipo I-III) para permitir un fácil acceso tanto al tórax como al abdomen. También se colocan drenajes espinales y derivaciones de potencial evocado motor para la evaluación de la médula espinal durante todo el procedimiento. La incisión primaria se realiza a lo largo de la base del cuello entre la columna vertebral y la escápula en un ángulo oblicuo, pasando por debajo de la punta de la escápula y siguiendo paralelamente a las costillas, terminando en un espacio entre el ombligo del paciente y la sínfisis del pubis.
Se presta especial atención durante la incisión primaria para no penetrar en la fascia antes de que quede completamente expuesta a lo largo de toda la incisión. Se identifican pequeños vasos sangrantes y se electrocauterizan para prevenir el sangrado cuando se administra heparina más adelante en el procedimiento. Después de la exposición de la fascia, la división de la musculatura superpuesta, incluido el dorsal ancho, el trapecio, el serrato anterior y los romboides, se produce por separado, con la creación de colgajos para permitir una reconstrucción más fácil al final del procedimiento. También se colocan suturas de marcado para ayudar a identificar los bordes anatómicos para la reconstrucción del músculo. Se identifica y marca la sexta costilla, ya que será el punto de entrada a la cavidad torácica. La entrada comienza con la división de los músculos intercostales, la liberación de la costilla posterior del diafragma y la osteotomía de la sexta costilla. Las puntadas de marcado se colocan en todas partes como referencia anatómica.
Una vez que el diafragma está expuesto, se utiliza una grapadora GIA para dividir el diafragma. A continuación, se lisan las adherencias pulmonares al aneurisma torácico. A continuación, se identificó y movilizó el riñón izquierdo. El diafragma se divide aún más y el pericardio queda expuesto. La arteria y vena renal izquierda y la arteria mesentérica superior se identifican en preparación para la disección de la aorta. A continuación, las ramas del tronco celíaco se ligan y dividen. Se realiza un seguimiento de la aorta hacia arriba, exponiéndola y sus ramas para su disección y ligadura antes de la canulación en la anastomosis proximal para el bypass aurículo-femoral.
Los sitios de pinzamiento para la anastomosis proximal se identifican en la aorta torácica descendente, y la vena pulmonar inferior izquierda y el ligamento se movilizan antes de que se coloque una sutura de cuerda para la vena pulmonar inferior izquierda antes de la canulación proximal. Se hace una incisión en la extremidad inferior para diseccionar y colocar un collar para la arteria femoral, el sitio de derivación anastomótica distal. La colocación de una cánula desde la vena pulmonar inferior izquierda hasta la arteria femoral permite la perfusión de las extremidades inferiores mientras se repara la aorta. Una vez que se logra la exposición adecuada, se dilata la arteria femoral izquierda y se canulan tanto la vena pulmonar inferior izquierda como la arteria femoral izquierda.
La reparación aórtica después de la canulación comienza con el pinzamiento de la aorta proximal antes de la anastomosis del injerto. Durante esta fase, gestionamos el caudal de la bomba a 500 mL/h para garantizar una perfusión adecuada. A continuación, el injerto se sutura al extremo proximal pinzado de la aorta y, una vez completada la anastomosis proximal, se evalúa para detectar fugas en el sitio de sutura. Una vez asegurada la anastomosis proximal, se coloca una segunda pinza en la aorta torácica media descendente y se divide longitudinalmente la aorta, con ligadura de los vasos luminales sangrantes. Durante todo el procedimiento, mantenemos la presión distal media a 70 mmHg para asegurar una correcta perfusión del órgano, ajustándola según sea necesario en función de la monitorización intraoperatoria. Esta técnica se continúa a medida que la pinza se mueve secuencialmente hacia abajo hacia el segmento distal del aneurisma aórtico, con incisión longitudinal continua y ligadura de los vasos intraluminales sangrantes. A continuación, se mide el injerto hasta la longitud adecuada en preparación para la anastomosis distal.
La siguiente parte de la cirugía implica el tiempo de isquemia visceral, una parte del procedimiento sensible al tiempo en la que el segmento visceral es isquémico debido a la ligadura de la arteria celíaca. De manera similar a los pasos anteriores, la aorta se divide longitudinalmente y se secciona por debajo de la arteria renal derecha, y se ligan los vasos sangrantes intraluminales. A continuación, se secciona la aorta en el lugar de la implantación y el injerto se anastomosa al segmento distal, con prendas suturadas en el sitio de la anastomosis para minimizar el riesgo de fuga después de que el injerto esté completamente suturado y evaluado. Una vez evaluados, las pinzas distales se retiran secuencialmente, lo que permite la perfusión de las extremidades inferiores y las vísceras. El tiempo total de pinzamiento para esta cirugía fue de 21 minutos.
Después de la anastomosis del injerto tanto proximal como distalmente, el paciente se decanula en el sitio de la vena pulmonar inferior izquierda con el cierre de la sutura en la vena pulmonar inferior izquierda, seguido de la decanulación de la arteria femoral izquierda y el cierre de la incisión en la arteria femoral. A medida que se cierra la incisión para el acceso a la arteria femoral, el injerto aórtico se pinza longitudinalmente y se incide para facilitar la anastomosis de un punto de salida del brazo lateral. La anastomosis del brazo lateral se evalúa en busca de fugas una vez que está completamente suturada. A continuación, se anastomosa la arteria celíaca de extremo a extremo al segmento distal del injerto de brazo lateral y se evalúa en busca de fugas.
En este punto, todas las estructuras desvascularizadas transitoriamente se revascularizan y el saco del aneurisma se vuelve a coser con el injerto persistente que lleva sangre aórtica en su interior. A partir de ahí, se repara el hemidiafragma izquierdo y la toracotomía y se colocan drenajes torácicos. La piel se cierra, concluyendo así el procedimiento.
Para referirnos brevemente a los cuidados postoperatorios de estos pacientes, los pacientes se mantienen intubados durante 24 horas hasta que alcanzan la eutermia y son reanimados adecuadamente. Después de este período, se presta mucha atención a la evaluación neurológica del paciente (flexión de la cadera/extensión de la pierna), los signos vitales (presión arterial) y los recuentos sanguíneos completos (Hgb), ya que el riesgo de lesión de la médula espinal intraoperatoria se evalúa con meticuloso detalle. Además, el drenaje de LCR en su lugar debe manejarse con cuidado para garantizar una presión de perfusión arterial adecuada a la médula espinal, que normalmente corresponde con una presión baja en el LCR. Normalmente, el drenaje de líquido cefalorraquídeo se mantiene en su lugar durante los dos primeros días postoperatorios, seguido de una prueba de pinzamiento en el segundo o tercer día postoperatorio, y (suponiendo que la prueba de pinzamiento sea exitosa) el drenaje se retira al tercer o cuarto día postoperatorio.
Aparte de la muerte, la paraplejia secundaria a una mala perfusión de la médula espinal es un evento adverso significativo que puede ocurrir después de este tipo de reparación de aneurisma aórtico. Crawford y sus colegas demostraron que el tiempo de pinzamiento cruzado y la extensión del aneurisma están directamente asociados con este riesgo, y la lesión completa y permanente de la médula espinal confiere una mortalidad cercana al 100% a los cinco años después de la operación48 Debido a esta morbilidad potencial, se han realizado importantes investigaciones para optimizar la estrategia y proteger la perfusión. Aunque se ha prestado mucha atención a la arteria espinal anterior (de Adamkiewicz) como el principal determinante de la perfusión de la médula espinal, el paradigma ha cambiado hacia un "concepto de red colateral" como lo describen Backes, Jacobs, Griepp, Wynn y Acher. 49-52 Estas redes colaterales incluyen anastomosis de las arterias subclavias, segmentarias (intercostales y lumbares) e ilíacas internas. En este modelo, siempre que se mantenga una perfusión adecuada de dos de estas arterias, la interrupción de una de ellas afectará mínimamente el riesgo de daño isquémico permanente. 53 Las tasas de paraplejia difieren entre la reparación abierta y la endovascular con TAAA, con incidencias reportadas de aproximadamente 8.5% para la reparación abierta y 1.7% para técnicas endovasculares en algunos estudios. Se recomienda realizar más investigaciones para confirmar los resultados en todas las poblaciones, ya que el enfoque depende de la anatomía, las circunstancias y la experiencia. 55,56
El auge de las técnicas endovasculares para la reparación de TAAA ha reducido las oportunidades de formación para la reparación quirúrgica abierta. Con menos casos abiertos realizados, los aprendices tienen una exposición limitada a las habilidades complejas requeridas para la disección aórtica y la colocación del injerto. Esta tendencia corre el riesgo de provocar una escasez de cirujanos competentes en la reparación abierta, especialmente para los pacientes que no son aptos para los abordajes endovasculares. Abordar este problema requiere estrategias de capacitación alternativas, como la simulación de alta fidelidad y programas centralizados en centros de alto volumen.
Históricamente, la reparación de aneurismas aórticos evolucionó desde que Rudolph Matas realizó una endoasmorrafia por lesiones arteriales en 1888, hasta 1951 con DeBakey y sus colegas intentando la escisión y la aortorrafia en pacientes con aneurismas, hasta el establecimiento de programas activos de cirugía aórtica en centros médicos de todo el país. La innovación médica en el ámbito del aneurisma aórtico se ha disparado recientemente, con avances individuales en las modalidades de imagen, los injertos, los medicamentos anticoagulantes y el bypass cardiopulmonar que contribuyen a mejorar los enfoques para resolver un problema médico con una consecuencia casi fatal si se rompe. Además, los abordajes endovasculares han pasado a primer plano por ser los principales a tener en cuenta a la hora de planificar la reparación de aneurismas aórticos sin contraindicaciones. 54 A medida que nuestras imágenes, medicamentos, instrumentos quirúrgicos y otros actores en la cirugía aórtica continúan evolucionando, también lo hará nuestra capacidad para realizar estos procedimientos de manera segura y eficaz para nuestros pacientes.
Grapadora GIA; Injerto protésico.
Nada que revelar.
El paciente al que se refiere este artículo en vídeo ha dado su consentimiento informado para ser filmado y es consciente de que la información y las imágenes se publicarán en línea.
References
- Tokgoz A, Wang S, Sastry P, et al. Asociación de colágeno, elastina, glicosaminoglicanos y macrófagos con la resistencia y el estiramiento del material definitivo del tejido en aneurismas de aorta torácica humana: un estudio de tensión uniaxial. J Biomech Ing. 2022; 144(10):101001. doi:10.1115/1.4054060.
- Kadoglou NP, Liapis CD. Metaloproteinasas de matriz: contribución a la patogenia, diagnóstico, vigilancia y tratamiento de los aneurismas de aorta abdominal. Curr Med Res Opin. 2004; 20(4):419-432. doi:10.1185/030079904125003143.
-
Savoia C, Burger D, Nishigaki N, Montezano A, Touyz RM. La angiotensina II y el fenotipo vascular en la hipertensión. Experto Rev Mol Med. 30 de marzo de 2011; 13:E11. doi:10.1017/S1462399411001815.
- Montezano AC, Touyz RM. Estrés oxidativo, Noxs e hipertensión: evidencia experimental y controversias clínicas [la corrección publicada aparece en Ann Med. 2012 Dic; 44(8):854-8]. Ann Med. 2012; 44 Supl 1:S2-S16. doi:10.3109/07853890.2011.653393.
- Garrido AM, Griendling KK. Señalización de NADPH oxidasas y receptores de angiotensina II. Endocrinol de células molares. 2009; 302(2):148-158. doi:10.1016/j.mce.2008.11.003.
- Saratzis A, Bown MJ. Las bases genéticas de la enfermedad de los aneurismas aórticos. Corazón. 2014; 100(12):916-922. doi:10.1136/heartjnl-2013-305130.
- Pleumeekers HJ, Hoes AW, van der Does E, et al. Aneurismas de la aorta abdominal en adultos mayores. El estudio de Róterdam. Am J Epidemiol. 1995; 142(12):1291-1299. doi:10.1093/oxfordjournals.aje.a117596.
- Boese AC, Chang L, Yin KJ, Chen YE, Lee JP, Hamblin MH. Diferencias de sexo en los aneurismas de aorta abdominal. Am J Physiol Corazón Circ Physiol. 2018; 314(6):H1137-H1152. doi:10.1152/ajpheart.00519.2017.
- Ghosh A, Pechota A, Coleman D, Upchurch GR Jr, Eliason JL. La secreción de MMP2 y MMP9 inducida por el humo del cigarrillo de las células lisas vasculares aórticas está mediada por la vía Jak/Stat. Hum Pathol. 2015; 46(2):284-294. doi:10.1016/j.humpath.2014.11.003.
-
Wang S, Zhang C, Zhang M, et al. La activación de la proteína quinasa α2 activada por AMP por la nicotina instiga la formación de aneurismas de aorta abdominal en ratones in vivo. Nat Med. Junio de 2012; 18(6):902-10. doi:10.1038/nm.2711.
- Johansson G, Markström U, Swedenborg J. Ruptura de aneurismas de aorta torácica: un estudio de las tasas de incidencia y mortalidad. J Vasc Surg. 1995; 21(6):985-988. doi:10.1016/s0741-5214(95)70227-x.
- Grupo de Trabajo de Servicios Preventivos de EE. UU. Detección de aneurisma de aorta abdominal: Declaración de recomendación del Grupo de Trabajo de Servicios Preventivos de EE. UU. JAMA. Año 2019; 322(22):2211–2218. doi:10.1001/jama.2019.18928.
- Keisler B, Carter C. Aneurisma de aorta abdominal. Am Médico de la Fam. 2015; 91(8):538-543.
- Hirsch AT, Haskal ZJ, Hertzer NR, et al. ACC/AHA 2005 Guías de práctica para el tratamiento de pacientes con enfermedad arterial periférica (extremidad inferior, riñón, mesentérica y aorta abdominal): un informe colaborativo de la Asociación Americana de Cirugía Vascular/Sociedad de Cirugía Vascular, Sociedad de Angiografía e Intervenciones Cardiovasculares, Sociedad de Medicina Vascular y Biología, Sociedad de Radiología Intervencionista, y el ACC/AHA Task Force on Practice Guidelines (Comité de Redacción para Desarrollar Directrices para el Manejo de Pacientes con Enfermedad Arterial Periférica): respaldado por la Asociación Americana de Rehabilitación Cardiovascular y Pulmonar; Instituto Nacional del Corazón, los Pulmones y la Sangre; Sociedad de Enfermería Vascular; Consenso Transatlántico Intersociedad; y la Fundación de Enfermedades Vasculares. Circulación. 2006; 113(11):E463-E654. doi:10.1161/CIRCULATIONAHA.106.174526.
- Hiratzka LF, Bakris GL, Beckman JA, et al. 2010 ACCF/AHA/AATS/ACR/ASA/SCA/SCAI/SIR/STS/SVM para el diagnóstico y tratamiento de pacientes con enfermedad aórtica torácica: un informe de la Fundación del Colegio Americano de Cardiología/Grupo de Trabajo de la Asociación Americana del Corazón sobre Directrices de Práctica, Asociación Americana de Cirugía Torácica, Colegio Americano de Radiología, Asociación Americana de Accidentes Cerebrovasculares, Sociedad de Anestesiólogos Cardiovasculares, Sociedad de Angiografía e Intervenciones Cardiovasculares, Sociedad de Radiología Intervencionista, Sociedad de Cirujanos Torácicos y Sociedad de Medicina Vascular [la corrección publicada aparece en Circulation. 27 de julio de 2010; 122(4):E410]. Circulación. 2010; 121(13):E266-E369. doi:10.1161/CIR.0b013e3181d4739e.
- Coady MA, Davies RR, Roberts M, et al. Patrones familiares de aneurismas de aorta torácica. Cirugía de arco. 1999; 134(4):361-367. doi:10.1001/archsurg.134.4.361.
- Albornoz G, Coady MA, Roberts M, et al. Aneurismas y disecciones de la aorta torácica familiar: incidencia, modos de herencia y patrones fenotípicos. Ann Thorac Surg. 2006; 82(4):1400-1405. doi:10.1016/j.athoracsur.2006.04.098.
- Akkersdijk GJ, van Bockel JH. Rotura de aneurisma de aorta abdominal: diagnóstico inicial erróneo y efecto en el tratamiento. Eur J Surg. 1998; 164(1):29-34. doi:10.1080/110241598750004922.
- Gloviczki P, Pairolero PC, Mucha P Jr, et al. Aneurismas de aorta abdominal rotos: no se debe negar la reparación. J Vasc Surg. 1992; 15(5):851-859.
- Meijer CA, Stijnen T, Wasser MN, et al. Doxiciclina para la estabilización de aneurismas de aorta abdominal: un ensayo aleatorizado. Ann Pasante Med. 2013; 159(12):815-823. doi:10.7326/0003-4819-159-12-201312170-00007.
- Baxter BT, Matsumura J, Curci JA, et al. Efecto de la doxiciclina en el crecimiento de aneurismas entre pacientes con aneurismas de aorta abdominal infrarrenal pequeños: un ensayo clínico aleatorizado. JAMA. 2020; 323(20):2029-2038. doi:10.1001/jama.2020.5230.
- Baxter BT, Matsumura J, Curci J, et al. Ensayo clínico de tratamiento no invasivo del aneurisma de aorta abdominal (N-TA(3)CT): diseño de un ensayo clínico aleatorizado doble ciego de fase IIb, controlado con placebo de doxiciclina para la reducción del crecimiento del aneurisma de aorta abdominal pequeño. Juicios de Clin Contemporáneos. 2016;48:91-98. doi:10.1016/j.cct.2016.03.008.
- Davies RR, Goldstein LJ, Coady MA, et al. Tasas anuales de ruptura o disección de aneurismas de aorta torácica: predicción simple basada en el tamaño. Ann Thorac Surg. 2002; 73(1):17-28. doi:10.1016/s0003-4975(01)03236-2.
- Walsh SR, Tang TY, Sadat U, et al. Colocación de stents endovasculares versus cirugía abierta para la enfermedad aórtica torácica: revisión sistemática y metanálisis de los resultados perioperatorios. J Vasc Surg. 2008; 47(5):1094-1098. doi:10.1016/j.jvs.2007.09.062.
- Cheng D, Martin J, Shennib H, et al. Reparación aórtica endovascular versus reparación quirúrgica abierta para la enfermedad aórtica torácica descendente: una revisión sistemática y metanálisis de estudios comparativos. J Am Coll Cardiol. 2010; 55(10):986-1001. doi:10.1016/j.jacc.2009.11.047.
- Abraha I, Romagnoli C, Montedori A, Cirocchi R. Injerto de stent torácico versus cirugía para el aneurisma torácico. Sistema de la Base de Datos Cochrane Rev. 2013; (9):CD006796. Publicado el 11 de septiembre de 2013. doi:10.1002/14651858.CD006796.pub3.
- Matsumura JS, Cambria RP, Dake MD, et al. Ensayo clínico controlado internacional de reparación de aneurismas endovasculares torácicos con el injerto endovascular Zenith TX2: resultados de 1 año. J Vasc Surg. 2008; 47(2):247-257. doi:10.1016/j.jvs.2007.10.032.
- Bavaria JE, Appoo JJ, Makaroun MS, et al. Injerto de stent endovascular versus reparación quirúrgica abierta de aneurismas de aorta torácica descendente en pacientes de bajo riesgo: un ensayo comparativo multicéntrico. J Cirugía Cardiovasca Torácica. 2007; 133(2):369-377. doi:10.1016/j.jtcvs.2006.07.040.
- Svensson LG, Crawford ES, Hess KR, Coselli JS, Safi HJ. Experiencia con 1509 pacientes intervenidos de cirugía de aorta toracoabdominal. J Vasc Surg. 1993; 17(2):357-370.
- Greenberg RK, Lu Q, Roselli EE, et al. Análisis contemporáneo de la reparación de aneurismas torácicos y toracoabdominales descendentes: una comparación de técnicas endovasculares y abiertas. Circulación. 2008; 118(8):808-817. doi:10.1161/CIRCULATIONAHA.108.769695.
- Jackson BM, Carpenter JP, Fairman RM, et al. Exclusión anatómica de la reparación endovascular del aneurisma de la aorta torácica. J Vasc Surg. 2007; 45(4):662-666. doi:10.1016/j.jvs.2006.12.062.
- Investigadores del ensayo EVAR del Reino Unido, Greenhalgh RM, Brown LC, et al. Reparación endovascular versus abierta del aneurisma de aorta abdominal. N Engl J Med. 2010; 362(20):1863-1871. doi:10.1056/NEJMoa0909305.
- Bulder RMA, Bastiaannet E, Hamming JF, Lindeman JHN. Metanálisis de la supervivencia a largo plazo después de la reparación endovascular electiva o abierta del aneurisma de aorta abdominal. Br J Surg. 2019; 106(5):523-533. doi:10.1002/bjs.11123.
- Powell JT, Sweeting MJ, Ulug P, et al. Metanálisis de datos de pacientes individuales de los ensayos EVAR-1, DREAM, OVER y ACE que comparan los resultados de la reparación endovascular o abierta para el aneurisma de aorta abdominal durante 5 años [la corrección publicada aparece en Br J Surg. 2018 Aug; 105(9):1222. doi:10.1002/bjs.10928]. Br J Surg. 2017; 104(3):166-178. doi:10.1002/bjs.10430.
- Paravastu SC, Jayarajasingam R, Cottam R, Palfreyman SJ, Michaels JA, Thomas SM. Reparación endovascular del aneurisma de la aorta abdominal. Sistema de la Base de Datos Cochrane Rev. 2014; 2014(1):CD004178. Publicado el 23 de enero de 2014. doi:10.1002/14651858.CD004178.pub2.
- Stather PW, Sidloff D, Dattani N, Choke E, Bown MJ, Sayers RD. Revisión sistemática y metanálisis de los resultados tempranos y tardíos de la reparación abierta y endovascular del aneurisma de aorta abdominal. Hno. J Surg. 2013; 100(7):863-872. doi:10.1002/bjs.9101.
- Lederle FA, Freischlag JA, Kyriakides TC, et al. Comparación a largo plazo de la reparación endovascular y abierta del aneurisma de aorta abdominal. N Engl J Med. 2012; 367(21):1988-1997. doi:10.1056/NEJMoa1207481.
- Participantes en el ensayo VAR. Reparación de aneurismas endovasculares versus reparación abierta en pacientes con aneurisma de aorta abdominal (ensayo EVAR 1): ensayo controlado aleatorizado. Lancet. 2005; 365(9478):2179-2186. doi:10.1016/S0140-6736(05)66627-5.
- De Bruin JL, Baas AF, Buth J, et al. Resultado a largo plazo de la reparación abierta o endovascular del aneurisma de aorta abdominal. N Engl J Med. 2010; 362(20):1881-1889. doi:10.1056/NEJMoa0909499.
- Blankensteijn JD, de Jong SE, Prinssen M, et al. Resultados a dos años después de la reparación convencional o endovascular de aneurismas de aorta abdominal. N Engl J Med. 2005; 352(23):2398-2405. doi:10.1056/NEJMoa051255.
- Brown LC, Thompson SG, Greenhalgh RM, Powell JT; Participantes en el ensayo de reparación de aneurismas endovasculares. Incidencia de eventos cardiovasculares y muerte después de la reparación abierta o endovascular del aneurisma de aorta abdominal en el ensayo aleatorizado EVAR 1. Br J Surg. 2011; 98(7):935-942. doi:10.1002/bjs.7485.
- Becquemin JP, Pillet JC, Lescalie F, et al. Ensayo controlado aleatorizado de reparación de aneurismas endovasculares versus cirugía abierta para aneurismas de aorta abdominal en pacientes de riesgo bajo a moderado. J Vasc Surg. 2011; 53(5):1167-1173.e1. doi:10.1016/j.jvs.2010.10.124.
- Siracuse JJ, Gill HL, Graham AR, et al. Seguridad comparativa de la reparación quirúrgica endovascular y abierta de aneurismas de aorta abdominal en pacientes masculinos de bajo riesgo. J Vasc Surg. 2014; 60(5):1154-1158. doi:10.1016/j.jvs.2014.05.018.
- Vallabhaneni R, Farber MA, Schneider F, Ricco JB. Debate: si los pacientes jóvenes de buen riesgo deben ser tratados con reparación endovascular de aneurisma de aorta abdominal. J Vasc Surg. 2013; 58(6):1709-1715. doi:10.1016/j.jvs.2013.09.017.
- Sandford RM, Choke E, Bown MJ, Sayers RD. ¿Cuál es la mejor opción para la reparación electiva de un aneurisma de aorta abdominal en un paciente joven en buena forma?. Eur J Vasc Endovasc Surg. 2014; 47(1):13-18. doi:10.1016/j.ejvs.2013.09.014.
- Lee K, Tang E, Dubois L, Power AH, DeRose G, Forbes TL. La durabilidad y la supervivencia son similares después de la reparación endovascular electiva y abierta de los aneurismas de aorta abdominal en pacientes más jóvenes. J Vasc Surg. 2015; 61(3):636-641. doi:10.1016/j.jvs.2014.10.012.
- Siracuse JJ, Schermerhorn ML, Meltzer AJ, et al. Comparación de los resultados después de la reparación endovascular y abierta de aneurismas de aorta abdominal en pacientes de bajo riesgo. Hno. J Surg. 2016; 103(8):989-994. doi:10.1002/bjs.10139.
- Crawford ES, Crawford JL, Safi HJ, et al. Aneurismas aórticos toracoabdominales: factores preoperatorios e intraoperatorios que determinan los resultados inmediatos y a largo plazo de las operaciones en 605 pacientes. J Vasc Surg. 1986; 3(3):389-404. doi:10.1067/mva.1986.avs0030389.
- Backes WH, Nijenhuis RJ, Mess WH, Wilmink FA, Schurink GW, Jacobs MJ. Angiografía por resonancia magnética del riego sanguíneo colateral a la médula espinal en pacientes con aneurisma de aorta torácica y toracoabdominal. J Vasc Surg. agosto de 2008; 48(2):261-271. doi:10.1016/j.jvs.2008.03.015.
- Jacobs MJ, de Mol BA, Elenbaas T, et al. Irrigación de sangre de la médula espinal en pacientes con aneurismas de aorta toracoabdominal. J Vasc Surg. enero de 2002; 35(1):30–37. doi:10.1067/mva.2002.120041.
- Griepp EB, Griepp RB. El concepto de red colateral: minimizar la paraplejia secundaria a la resección del aneurisma de aorta toracoabdominal. Tex Heart Inst J. 2010; 37(6):672-674.
- Wynn MM, Acher CW. Una teoría moderna de la isquemia/lesión de la médula espinal en la cirugía aórtica toracoabdominal y sus implicaciones para la prevención de la parálisis. J Anestes cardiotorácicos vascos. 2014; 28(4):1088-1099. doi:10.1053/j.jvca.2013.12.015.
- Eagleton MJ, Shah S, Petkosevek D, Mastracci TM, Greenberg RK. La permeabilidad de las arterias hipogástricas y subclavias afecta el inicio y la recuperación de la isquemia medular asociada al endoinjerto aórtico. J Vasc Surg. 2014; 59(1):89-94. doi:10.1016/j.jvs.2013.07.007.
- Fiscal de distrito de Cooley. Breve historia de la cirugía de aneurisma aórtico. Aorta (Stamford). 2013; 1(1):1-3. Publicado el 1 de junio de 2013. doi:10.12945/j.aorta.2013.12.006.
- Wongkornrat W, Yamamoto S, Sekine Y, et al. Predictores de paraplejia con reparación actual de aneurisma aórtico toracoabdominal. Cardiovasc Asiático Torácico Ann. 2015; 23(4):406-411. doi:10.1177/0218492314549563.
- Kotelis D, Geisbüsch P, von Tengg-Kobligk H, Allenberg JR, Böckler D. Paraplegie nach endovaskulärer therapie der thorakalen und thorakoabdominellen Aorta [Paraplejia después de la reparación endovascular de la aorta torácica y toracoabdominal]. Zentralbl Chir. 2008; 133(4):338-343. doi:10.1055/s-2008-1076903.
- Frederick JR, Woo YJ. Aneurisma de aorta toracoabdominal. Ann Cirugía cardiotorácica. 2012; 1(3):277-285. doi:10.3978/j.issn.2225-319X.2012.09.01.
Cite this article
Del Re A, Mohebali J, Patel VI. Reparación de aneurisma de aorta toracoabdominal. J Med Insight. 2024; 2024(109). doi:10.24296/jomi/109.


