Reparatur des thorakabalen Aortenaneurysmas
Main Text
Table of Contents
Thorakoabdominale Aortenaneurysmen (TAAAs) sind in der Regel asymptomatisch und werden zufällig in der Thorax- oder Bauchbildgebung entdeckt. Wenn sie identifiziert werden, ist die Behandlung oft erwartungsvoll, abhängig von der Größe des Aneurysmas und seiner Wachstumsrate. Eine Operation ist bei größeren Aneurysmen und solchen, die sich schnell ausdehnen, indiziert, um einen katastrophalen Aneurysmaruptur zu vermeiden. Hier stellen wir den Fall einer 70-jährigen Frau mit einer TAAA vor, die wir mit seriellen computertomographischen Angiographie-Scans verfolgt haben. Die Entscheidung für eine Operation wurde getroffen, als das Aneurysma begann, einen Durchmesserzuwachs zu zeigen. Ihre Anatomie war für eine endovaskuläre Behandlung nicht förderlich; Deshalb haben wir ihr Aneurysma mit einem traditionellen offenen Zugang repariert.
Herz-kreislauf-erkrankungen; Gefäßerkrankungen; Aneurysma; Aortenaneurysma; Thorakoabdominal.
Aortenaneurysmen sind fokale Erweiterungen der Aorta, die an jedem Punkt ihrer Länge von der Wurzel über der Aortenklappe bis hinunter zur Bifurkation im Becken auftreten können. Die Klassifizierung erfolgt nach anatomischer Lokalisation und wird in thorakale, abdominale oder thorakoabdominale Aneurysmen unterteilt. Thorakale Aneurysmen werden weiter unterteilt in solche, die die Wurzel und die aufsteigende Aorta betreffen, solche, die den Aortenbogen betreffen, und solche, die die absteigende thorakale Aorta betreffen. Thorakoabdominale Aortenaneurysmen (TAAAs) werden nach der Crawford-Klassifikation kategorisiert: Extent I umfasst den Großteil der absteigenden thorakalen Aorta, die sich von der linken Schlüsselbeinarterie bis zur suprarenalen Bauchaorta erstreckt. Extent II ist der ausgedehnteste und umfasst die Aorta von der linken Arteria subclavia bis hinunter zur Aortoiliacus-Bifurkation. Ausmaß III umfasst die distale thorakale Aorta und erstreckt sich bis zur Aortoiliakum-Bifurkation. Das Ausmaß IV ist auf die Bauchschlagader unterhalb des Zwerchfells beschränkt. Safis Gruppe führte Extent V ein, das die distale thorakale Aorta umfasst, einschließlich der Ursprünge der Arteria coeliacus und der Arteria mesenterica superior, aber ohne die Nierenarterien (Abbildung 1). Nr. 57
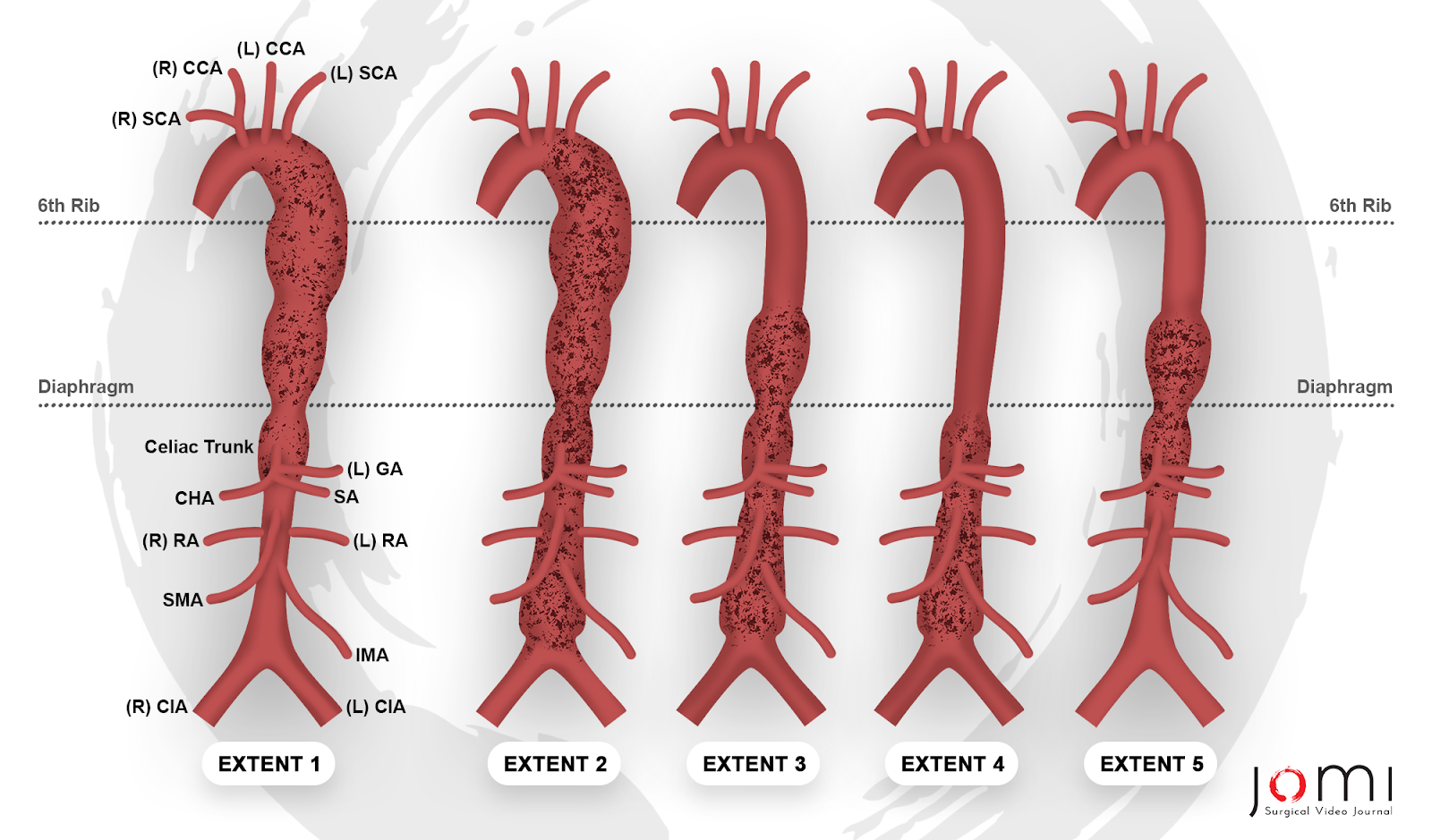
Abbildung 1. Crawford-Klassifikation des thorakabalen Aortenaneurysmas, modifiziert durch die Safi-Gruppe. Legende: (R) SCA - Rechte Arteria subclavia, (R) CCA - rechte Arteria carotis communis, (L) CCA - linke Arteria carotis communis, (L) SCA - Arteria subclavia links, (L) GA - Arteria magrica left (Magenarterie) CHA - Arteria brepatica communis, SA - Arteria breicanica (Milz), (R) RA - rechte Nierenarterie, (l) RA - linke Nierenarterie, SMA - Arteria mesenterica superior (IMA - Arteria mesenterica inferior), (R) CIA - Arteria communis (rechtes Arteria iliac), (L) CIA - linke Arteria iliaca communis.
Die Ätiologie der Dilatation ist in der Regel multifaktoriell und das Ergebnis sowohl erblicher als auch umweltbedingter Faktoren, deren letzter gemeinsamer Weg zu einem Abbau der Kollagen- und Elastinfasern und/oder einer Hemmung ihrer ordnungsgemäßen Synthese führt. Diese beiden extrazellulären Matrixproteine der Aortenwand sind hauptsächlich für deren Zugfestigkeit und Elastizität verantwortlich. 1 Neben Kollagen und Elastin wurden auch andere Bestandteile der extrazellulären Matrix der Aortenwand (wie Glykosaminoglykane) bei Patienten mit Aortenaneurysmen als vermindert festgestellt, was auf eine aberrant aktive Matrix-Metalloproteinase-Aktivität zurückzuführen ist. 2 Andere Faktoren wie Angiotensin II, Mineralokortikoide, reaktive Sauerstoffspezies und Zellen, die klassischerweise in der systemischen Entzündungsreaktion vorkommen, wurden ebenfalls an der Bildung von Aortenaneurysmen beteiligt. 3,4,5 Sekundäre Ursachen für die Bildung von Aneurysmen sind Traumata und Infektionen, wobei letztere als mykotische Aneurysmen klassifiziert werden. Schließlich können vererbte und spontane genetische Mutationen, die für die oben erwähnten Komponenten der Aortenvertiefung kodieren, zur Bildung von Aneurysmen in Verbindung mit spezifischen Syndromen wie Ehlers-Danlos Typ IV und Marfan-Syndrom führen. 6
Zu den Risikofaktoren, die traditionell mit der Pathogenese der Aortenaneurysma-Degeneration in Verbindung gebracht werden, gehören männliches Geschlecht, Familienanamnese und Zigarettenrauchen. Die Geschlechtsunterschiede in der Prävalenz des Aortenaneurysmas sind signifikant, mit einem Verhältnis von 5:1 zwischen Männern und Frauen der betroffenen Patienten, obwohl ein einzelner einheitlicher Mechanismus für diese Geschlechtsunterschiede noch nicht geklärt wurde. 7,8 Die genaue Pathogenese des Zigarettenrauchens auf die Aneurysmabildung ist angesichts der heterogenen Bestandteile des Tabakrauchs komplex, obwohl der Zusammenhang mit einer erhöhten Matrix-Metalloproteinase-Expression in der Literatur gut unterstützt wird. 9,10 kg
Die Reparatur des Aortenaneurysmas wird durchgeführt, um eine Ruptur zu vermeiden, die in den meisten Fällen tödlich verläuft, wenn sie nicht dringend oder notfallmäßig behandelt wird. 11
Wie oben erwähnt, sind Aortenaneurysmen häufig heimtückischer Natur und treten asymptomatisch auf, wobei die Diagnose für eine andere Indikation oft zufällig in der Computertomographie (CT) gestellt wird. Aneurysmen, die groß geworden sind, können Rücken- oder Brustschmerzen oder Symptome verursachen, die auf eine Kompression der umgebenden Strukturen zurückzuführen sind. Einige Patienten können auch das Gefühl einer "pulsierenden Masse" auf Höhe des Aneurysmas befürworten. Embolische Stigmata von muralen Thromben, die sich von der Aneurysmawand lösen, können sich als Infarkte in den Bauchorganen oder purpurische Läsionen in den unteren Extremitäten manifestieren, das sogenannte "Trash-Toe"- oder "Blue-Toe"-Syndrom. Wie bereits erwähnt, können Aneurysmapatienten Elemente in ihrer Vorgeschichte haben, die ihr Risiko für die Entwicklung eines Aneurysmas erhöhen, wie z. B. Rauchen in der Vorgeschichte, unkontrollierter Hypertonie in der Vorgeschichte oder atherosklerotische Herz-Kreislauf-Erkrankungen in der Vorgeschichte. Wenn es sekundäre Komplikationen des Aneurysmas gibt, wie z. B. Infektionen, kann der Patient subjektives Fieber und andere systemische Symptome aufweisen.
Zwei unterschiedliche Szenarien der körperlichen Untersuchung sind relevant: die zufällige Feststellung eines nicht rupturierten Aneurysmas und die Untersuchung zum Zeitpunkt einer drohenden oder aktiven Ruptur. Erstere kann sich als besonders markante und pulsierende Masse im Bauchbereich oberhalb und etwas links vom Nabel präsentieren. Der Körperhabitus und die Größe des Aneurysmas des Patienten wirken sich stark auf die Fähigkeit aus, diesen Befund zu schätzen. Gelegentlich sind embolische Stigmata in den unteren Extremitäten zu sehen, insbesondere wenn die Impulse der unteren Extremitäten durch die Pedalebene tastbar sind. Bei mykotischen oder entzündlichen Aneurysmen können begleitende konstitutionelle Symptome wie Fieber und Rigor vorliegen.
Im Gegensatz zu ihren asymptomatischen Gegenstücken tritt eine Ruptur oder drohende Ruptur am häufigsten mit Schmerzen an jeder Stelle entlang der Verteilung des Aneurysmas auf. Eine eingedämmte Ruptur kann zu einer Kompression benachbarter Organe oder Strukturen, wie z. B. des Harnleiters, führen, was zu Hydronephrose führt. Eine Fistulation in luminale Strukturen wie den Darm führt zu gastrointestinalen Blutungen, während ein Riss in umgebende Strukturen wie die Hohlvene zu einem akuten Auftreten einer Herzinsuffizienz und einem klassischen lauten maschinellen Bruit im Bauch führen kann. Eine eingedämmte Ruptur in das Retroperitoneum kann sich äußerlich als Grey Turner (Flankenekchymose) oder Cullen (periumbilische Ekchymose) manifestieren.
Die meisten Aneurysmen werden zufällig in anderen Studien entdeckt; Bei denjenigen, die noch nie eine solche Bildgebung hatten, empfiehlt die United States Preventive Services Task Force (USPSTF) jedoch einen einmaligen Bauchultraschall bei Männern im Alter von 65 bis 75 Jahren, die in der Vergangenheit geraucht haben, für das Screening eines abdominalen Aortenaneurysmas (AAA) (B-Empfehlung). Diese Empfehlungen sind nicht die gleichen für Frauen in der gleichen Alterskategorie und Substanzkonsumgeschichte (I-Erklärung). 12
Patienten, bei denen Aortenaneurysmen festgestellt wurden, werden entsprechend der Größe der Dilatation nachbeobachtet. Nach den Empfehlungen der American Academy of Family Physicians sollten Patienten mit einem Durchmesser von AAA 3,0 bis 3,9 cm alle zwei bis drei Jahre mittels Ultraschall des Bauchraums überwacht werden (C-Empfehlung). Patienten mit AAAs mit einem Durchmesser von 4,0 bis 5,4 cm sollten alle sechs bis zwölf Monate per Ultraschall oder CT überwacht werden (C-Empfehlung).13, 14 Patienten mit einem Aortendurchmesser von mehr als 5,5 cm werden zur elektiven chirurgischen Reparatur überwiesen. Bei thorakalen Aortenaneurysmen (TAA) erfolgt die Überwachung in der Regel sechs Monate nach der ersten Erkennung und Diagnose in einer wiederholten axialen Bildgebung, um das Wachstum oder die Stabilität zu beurteilen. Das Management und die spezifischen Bildgebungsmodalitäten für die kontinuierliche Überwachung von TAAs hängen vom Ausmaß, der Größe und der Wachstumsrate ab. Echokardiographie und Magnetresonanztomographie können ebenfalls Optionen sein. 15 Ein Screening auf TAA ist bei Patienten mit einer starken Familienanamnese angebracht. 16,17 kg
Aufgrund der Screening-Empfehlungen der USPSTF, der Society for Vascular Surgery und des American College of Radiology können abdominale Aortenaneurysmen erkannt und angemessen nachverfolgt werden, wo sie sonst möglicherweise weiter gewachsen wären. Dies ermöglicht eine geplante Milderung in Abhängigkeit vom Ausmaß der Größe des Aneurysmas oder der Wachstumsrate durch Risikofaktormanagement oder chirurgische Beratung.
Patienten, die außerhalb der Risikokategorien für das Screening liegen, können immer noch Aortenaneurysmen entwickeln und diese möglicherweise nie sichtbar machen, wo sie bis zur Ruptur asymptomatisch sein können. Einige Studien deuten darauf hin, dass schätzungsweise 70-80 % der Patienten, die wegen rupturierter Aortenaneurysmen in die Notaufnahme gebracht wurden, keine bekannte Vorgeschichte oder Kenntnis von einem diagnostizierten Aortenaneurysma hatten. 18,19 kg
Asymptomatische Aortenaneurysmen, die die geeigneten Durchmesser-/Expansionskriterien für die Reparatur nicht erfüllen, werden durch die Reduzierung kardiovaskulärer Risikofaktoren behandelt. Dies wird durch eine blutdrucksenkende und Statintherapie zusätzlich zur Raucherentwöhnung erreicht. Andere pharmakologische Therapien wie Doxycyclin werden auf ihre Anti-MMP-Eigenschaften untersucht, aber derzeit gibt es keine Daten, die auf wesentliche Vorteile für die Risikominderung von Aneurysmen hindeuten, die über die zuvor genannten hinausgehen. 20,21,22 kg
Aortenaneurysmen, bei denen das Risiko einer Ruptur das Risiko einer Operation übersteigt, werden zu einem chirurgischen Beratungsgespräch überwiesen, um das Aneurysma zu reparieren. Obwohl die Reparatur eines Hochrisiko-Aortenaneurysmas als Prophylaxe gilt, hat sie eine signifikant bessere 5-Jahres-Überlebensrate als die Reparatur eines rupturierten Aortenaneurysmas. 23 Chirurgische Optionen für die Aneurysmareparatur umfassen offene, endovaskuläre oder eine Mischung aus beiden. Die Wahl zwischen den Verfahrensmodalitäten ist neben dem Ausmaß des Aneurysmas auch abhängig von den Besonderheiten des Patientenfalles, wie z.B. der Lage entlang der Aorta oder anderen anatomischen Überlegungen. Andere, nuanciertere Überlegungen, wie z. B. die genaue Ätiologie des Aneurysmas (degenerativ vs. Teil eines genetischen Syndroms), fließen ebenfalls in die Entscheidung ein, da Patienten, die sonst gute Kandidaten für eine endovaskuläre Therapie wären, stattdessen chirurgisch behandelt werden, wenn angenommen wird, dass die Ätiologie des Aneurysmas genetisch bedingt ist.
Selbstverständlich werden auch die medizinischen Begleiterkrankungen des Patienten berücksichtigt, die sich auf seine chirurgische Kandidatur auswirken würden.
Bei der endovaskulären Reparatur wird ein kollabierter Gewebeschlauch, der mit einem Stent, einem Stenttransplantat, verbunden ist, von einer oder beiden Oberschenkelarterien in die Aorta eingeführt. Das Stenttransplantat wird unter Durchleuchtung über das Aneurysma in Position gebracht und dann so eingesetzt, dass es sich ausdehnen und distal von der normalen Aorta proximal zur normalen Aorta oder Beckenarterie überbrücken kann. Das Aneurysma wird effektiv vom systemischen Blutdruck "abgedichtet" und der Fluss durch die Aorta aufrechterhalten. Aneurysmen, die die thorakoabdominale Aorta betreffen, sind jedoch eine viel größere Herausforderung, da die großen Blutgefäße, die die Bauchorgane versorgen, aus dem Aneurysma selbst entstehen. Traditionell würde der Einsatz von Stenttransplantaten in diesem Bereich zu einer Störung des Blutflusses zu diesen Organen führen. Obwohl es fortschrittliche und sehr elegante endovaskuläre Techniken gibt, um den Blutfluss zu diesen Gefäßen zu verbessern und aufrechtzuerhalten und gleichzeitig das Aneurysma zu verschließen, gehen die Details über den Rahmen dieses Kapitels hinaus. Vielmehr liegt der Fokus hier auf der offenen chirurgischen Reparatur der TAAA. Die Operation beinhaltet die Freilegung der Aorta durch Zugang sowohl zur Brust- als auch zur Bauchhöhle, die Mobilisierung der angrenzenden Organe und Gewebe von der Aorta, die Kontrolle der Aorta über und unter dem Aneurysma, die Kontrolle aller aus dem Aneurysma entstehenden Astgefäße, die Stilllegung des Blutflusses durch das Aneurysmasegment und dann das Ersetzen der gesamten aneurysmatischen Aorta durch ein Gewebetransplantat und die Wiederherstellung des Flusses zu den Astarterien. Adjunkte wie der atrial-femorale Bypass werden eingesetzt, um die Auswirkungen der Organischämie während der Reparatur zu minimieren und zu mildern.
In Beobachtungs- und prospektiven Studien wurde gezeigt, dass die endovaskuläre Therapie einen perioperativen Mortalitätsvorteil bietet, obwohl die Überlegenheit der endovaskulären Therapie gegenüber der chirurgischen Therapie bei der Betrachtung der kurzfristigen Mortalität, insbesondere in Bezug auf die Reparatur der thorakalen Aorta, umstritten bleibt. 24-31 Die Schlussfolgerungen aus den Studien DREAM, EVAR-1, OVER und ACE, die das infrarenale AAA-Management untersuchten, scheinen sich mit früheren Studien zu bestätigen, die einen kurzfristigen Mortalitätsvorteil im Vergleich zu einer offenen Operation identifizierten, obwohl diese Studien keinen signifikanten Unterschied in den Langzeitergebnissen bis zu 10 Jahren zeigen. 32-42 Diese Daten haben den Anbietern geholfen, den am besten geeigneten Verfahrensverlauf für Patienten zu identifizieren, der in diese Kategorien passt. Ältere Patienten mit perioperativem Risiko sind geeignetere Kandidaten für eine endovaskuläre Therapie, obwohl das Risiko für jüngere, ansonsten gesunde Patienten mit geringerem perioperativem Risiko weniger klar ist und weitere Untersuchungen rechtfertigt. Nr. 43-47
Bei der Patientin wurde in diesem Fall eine Typ I TAAA diagnostiziert, was bedeutet, dass sich die Aortenbeteiligung von der absteigenden Aorta bis zur suprarenalen Bauchschlagader erstreckte. Im speziellen Fall dieses Patienten beginnt das Aneurysma kurz hinter dem Ursprung der linken Schlüsselbeinarterie und erstreckt sich über die thorakale Aorta bis zum viszeralen Segment. Der Plan für die Operation dieses Patienten umfasst die Freilegung der thorakalen, abdominalen und proximalen infrarenalen Aorta, die Kontrolle der viszeralen Gefäße, die Platzierung des Patienten in einen linksatrialen femoralen Bypass, die Platzierung des Transplantats und den Bauchverschluss.
Der Patient wird in eine rechte laterale Dekubitusposition gebracht (wie es bei der TAAA-Reparatur vom Typ I–III üblich ist), um einen einfachen Zugang sowohl zum Brustkorb als auch zum Bauch zu ermöglichen. Spinaldrainagen und motorisch evozierte Potentialableitungen werden ebenfalls zur Beurteilung des Rückenmarks während des gesamten Eingriffs platziert. Der primäre Schnitt wird entlang der Basis des Halses zwischen der Wirbelsäule und dem Schulterblatt in einem schrägen Winkel vorgenommen, verläuft unter der Spitze des Schulterblatts und verläuft parallel zu den Rippen und endet in einem Raum zwischen dem Nabel und der Symphyse des Patienten.
Während des primären Schnitts wird sorgfältig darauf geachtet, dass die Faszie nicht durchdrungen wird, bevor sie über den gesamten Schnitt vollständig freigelegt ist. Kleine blutende Gefäße werden identifiziert und elektrokauterisiert, um Blutungen zu verhindern, wenn Heparin später im Verfahren verabreicht wird. Nach Freilegung der Faszie erfolgt die Teilung der überlagernden Muskulatur, einschließlich des Latissimus dorsi, des Trapezius, des Serratus anterior und der Rauten, getrennt, wobei die Bildung von Lappen erfolgt, um eine einfachere Rekonstruktion am Ende des Eingriffs zu ermöglichen. Markierungsnähte werden ebenfalls gelegt, um die Identifizierung anatomischer Grenzen für die Rekonstruktion von Muskeln zu erleichtern. Die sechste Rippe wird identifiziert und markiert, da dies der Eintrittspunkt in die Brusthöhle sein wird. Der Eintritt beginnt mit der Teilung der Interkostalmuskulatur, der Befreiung der hinteren Rippe vom Zwerchfell und der Osteotomie der sechsten Rippe. Markierungsstiche sind als anatomische Referenz durchgehend platziert.
Sobald das Zwerchfell freigelegt ist, wird ein GIA-Hefter verwendet, um das Zwerchfell zu teilen. Anschließend werden Lungenadhäsionen am thorakalen Aneurysma lysiert. Anschließend wurde die linke Niere identifiziert und mobilisiert. Das Zwerchfell wird weiter geteilt und das Perikard freigelegt. Die linke Nierenarterie und -vene sowie die Arteria mesenterica superior werden in Vorbereitung auf die Dissektion aus der Aorta identifiziert. Äste aus dem Stamm coeliacus werden dann ligiert und geteilt. Die Aorta wird nach oben verfolgt, wobei sie und ihre Äste weiterhin für die Dissektion und Ligatur freigelegt werden, bevor sie an der proximalen Anastomose für den atrio-femoralen Bypass kassiert wird.
An der absteigenden thorakalen Aorta werden Klemmstellen für die proximale Anastomose identifiziert, und die linke untere Lungenvene und das linke Band werden mobilisiert, bevor vor der proximalen Kanülierung eine Beutelnaht für die linke untere Pulmonalvene gelegt wird. In der unteren Extremität wird ein Schnitt gemacht, um eine Geldbeutelschnur für die Oberschenkelarterie, die distale Anastomosen-Bypassstelle, zu präparieren und zu platzieren. Das Platzieren einer Kanüle von der linken unteren Lungenvene zur Oberschenkelarterie ermöglicht die Durchblutung der unteren Extremitäten, während die Aorta repariert wird. Sobald die richtige Exposition erreicht ist, wird die linke Oberschenkelarterie erweitert und sowohl die linke untere Lungenvene als auch die linke Oberschenkelarterie werden kanüliert.
Die Aortenreparatur nach der Kanülierung beginnt mit dem Einklemmen der proximalen Aorta vor der Anastomose des Transplantats. Während dieser Phase steuern wir den Pumpenfluss bei 500 ml/h, um eine ausreichende Perfusion zu gewährleisten. Das Transplantat wird dann mit dem geklemmten proximalen Ende der Aorta vernäht und nach Abschluss der proximalen Anastomose auf Undichtigkeiten an der Nahtstelle untersucht. Sobald die proximale Anastomose gesichert ist, wird eine zweite Klemme an der Mitte der absteigenden thorakalen Aorta platziert und die Aorta in Längsrichtung geteilt, wobei alle blutenden luminalen Gefäße ligatisiert werden. Während des gesamten Eingriffs halten wir den mittleren distalen Druck bei 70 mmHg, um eine ordnungsgemäße Organperfusion zu gewährleisten, und passen ihn bei Bedarf auf der Grundlage der intraoperativen Überwachung an. Diese Technik wird fortgesetzt, indem die Klemme sequentiell nach unten in Richtung des distalen Segments des Aortenaneurysmas bewegt wird, wobei die Längsinzision und Ligatur der blutenden intraluminalen Gefäße fortgesetzt wird. Das Transplantat wird dann in Vorbereitung auf die distale Anastomose auf die entsprechende Länge vermessen.
Der nächste Teil der Operation beinhaltet die viszerale Ischämiezeit, einen zeitkritischen Teil des Eingriffs, bei dem das viszerale Segment aufgrund einer Ligatur der Arteria coeliacus ischämisch ist. Ähnlich wie bei den vorherigen Schritten wird die Aorta in Längsrichtung geteilt und unterhalb der rechten Nierenarterie durchtrennt, und intraluminale Blutungsgefäße werden ligiert. Die Aorta wird dann an der Implantationsstelle durchtrennt, und das Transplantat wird an das distale Segment anastomosiert, wobei die Pfandblätter an der Stelle der Anastomose vernäht werden, um das Risiko einer Leckage nach dem vollständigen Nähen und Beurteilen des Transplantats zu minimieren. Nach der Beurteilung werden die distalen Klemmen nacheinander entfernt, um eine Durchblutung der unteren Extremitäten und Eingeweide zu ermöglichen. Die Gesamtklemmzeit für diese Operation betrug 21 Minuten.
Nachdem das Transplantat sowohl proximal als auch distal anastomosiert wurde, wird der Patient an der Stelle der linken unteren Pulmonalvene dekanüliert, wobei die Beutelnaht an der linken unteren Lungenvene verschlossen wird, gefolgt von der Dekanülierung der linken Oberschenkelarterie und dem Verschluss des Schnitts an der Oberschenkelarterie. Wenn der Schnitt für den Zugang zur Oberschenkelarterie geschlossen wird, wird das Aortentransplantat in Längsrichtung geklemmt und eingeschnitten, um die Anastomose eines Seitenarmaustrittspunktes zu erleichtern. Die Seitenarm-Anastomose wird auf Undichtigkeiten untersucht, sobald sie vollständig vernäht ist. Die Zöliakiearterie wird dann von Ende zu Ende mit dem distalen Segment des Seitenarmtransplantats anastomosiert und auf Undichtigkeiten untersucht.
Zu diesem Zeitpunkt werden alle vorübergehend devaskularisierten Strukturen revaskularisiert und der Aneurysmasack wird wieder mit dem Patenttransplantat zusammengenäht, das das Aortenblut im Inneren transportiert. Von dort aus werden das linke Hemidiaphragma und die Thorakotomie repariert und Thoraxdrainagen gelegt. Die Haut wird verschlossen und der Eingriff ist abgeschlossen.
Um kurz auf die postoperative Versorgung dieser Patienten einzugehen: Die Patienten werden 24 Stunden lang intubiert, bis sie die Euthermie erreichen und angemessen wiederbelebt werden. Nach dieser Zeit wird der neurologischen Beurteilung (Hüftbeugung/Beinstreckung), den Vitalwerten (Blutdruck) und dem vollständigen Blutbild (Hgb) des Patienten äußerst große Aufmerksamkeit geschenkt, da das Risiko einer intraoperativen Rückenmarksverletzung akribisch detailliert beurteilt wird. Darüber hinaus muss die Liquordrainage an Ort und Stelle vorsichtig verwaltet werden, um einen ausreichenden arteriellen Perfusionsdruck zum Rückenmark zu gewährleisten, der normalerweise einem niedrigen Liquordruck entspricht. Die Liquordrainage wird in der Regel in den ersten beiden postoperativen Tagen an Ort und Stelle gehalten, gefolgt von einem Klemmversuch am zweiten oder dritten postoperativen Tag, und (unter der Annahme eines erfolgreichen Klemmversuchs) wird die Drainage am dritten oder vierten postoperativen Tag entfernt.
Neben dem Tod ist die Querschnittslähmung infolge einer schlechten Durchblutung des Rückenmarks ein signifikantes unerwünschtes Ereignis, das nach dieser Art der Aortenaneurysmareparatur auftreten kann. Crawford und Kollegen zeigten, dass die Cross-Clamp-Zeit und das aneurysmatische Ausmaß direkt mit diesem Risiko verbunden sind, und dass eine vollständige, dauerhafte Rückenmarksverletzung fünf Jahre nach der Operation zu einer Mortalität von nahezu 100 %führt.48 Aufgrund dieser potenziellen Morbidität wurden umfangreiche Untersuchungen und Forschungen durchgeführt, um die Strategie zu optimieren und die Perfusion zu schützen. Obwohl der vorderen Spinalarterie (von Adamkiewicz) als Hauptdeterminante der Rückenmarksperfusion viel Aufmerksamkeit geschenkt wurde, hat sich das Paradigma zu einem "kollateralen Netzwerkkonzept" gewandelt, wie es von Backes, Jacobs, Griepp, Wynn und Acher beschrieben wird. 49-52 Zu diesen Kollateralnetzwerken gehören Anastomosen aus den Schlüsselbeinartern, segmentalen (Interkostal- und Lendenarterien) und Arteria iliaca interna. Solange in diesem Modell eine ausreichende Durchblutung von zwei dieser Arterien aufrechterhalten wird, wird die Unterbrechung einer Arterie das Risiko für dauerhafte ischämische Schäden minimal beeinflussen. 53 Die Querschnittslähmungsraten unterscheiden sich zwischen offener und endovaskulärer TAAA-Reparatur, wobei in einigen Studien eine Inzidenz von etwa 8,5 % für die offene Reparatur und 1,7 % für endovaskuläre Techniken berichtet wurde. Weitere Forschung wird empfohlen, um die Ergebnisse in allen Populationen zu bestätigen, da der Ansatz von der Anatomie, den Umständen und der Expertise abhängt. 55,56 kg
Das Aufkommen endovaskulärer Techniken für die TAAA-Reparatur hat die Schulungsmöglichkeiten für die offene chirurgische Reparatur verringert. Da weniger offene Fälle durchgeführt werden, sind die Auszubildenden nur begrenzt mit den komplexen Fähigkeiten konfrontiert, die für die Aortendissektion und die Platzierung von Transplantaten erforderlich sind. Dieser Trend birgt die Gefahr eines Mangels an Chirurgen, die sich mit offener Reparatur auskennen, insbesondere für Patienten, die für endovaskuläre Ansätze ungeeignet sind. Um dieses Problem zu lösen, sind alternative Schulungsstrategien erforderlich, wie z. B. High-Fidelity-Simulationen und zentralisierte Programme in Zentren mit hohem Volumen.
Historisch gesehen entwickelte sich die Reparatur von Aortenaneurysmen von Rudolph Matas, der 1888 eine Endoaneurysmorraphie für arterielle Läsionen durchführte, über 1951, als DeBakey und Kollegen versuchten, Exzision und Aortorrhaphie bei Patienten mit Aneurysmen durchzuführen, bis hin zur Etablierung aktiver Aortenchirurgieprogramme an medizinischen Zentren im ganzen Land. Die medizinische Innovation im Bereich des Aortenaneurysmas ist in letzter Zeit explodiert, wobei einzelne Fortschritte bei Bildgebungsmodalitäten, Transplantaten, gerinnungshemmenden Medikamenten und kardiopulmonalem Bypass zu besseren Ansätzen zur Lösung eines medizinischen Problems beitragen, das im Falle eines Risses fast tödliche Folgen hat. Darüber hinaus sind endovaskuläre Ansätze in den Vordergrund gerückt, um bei der Planung von Aortenaneurysmareparaturen ohne Kontraindikationen zu überdenken. 54 In dem Maße, wie sich unsere Bildgebung, Medikamente, chirurgischen Instrumente und andere Akteure in der Aortenchirurgie weiterentwickeln, wird auch unsere Fähigkeit, diese Eingriffe für unsere Patienten sicher und effektiv durchzuführen, weiter entwickeln.
GIA-Hefter; Prothesen-Transplantat.
Nichts offenzulegen.
Der Patient, auf den sich dieser Videoartikel bezieht, hat seine Einverständniserklärung gegeben, gefilmt zu werden, und ist sich bewusst, dass Informationen und Bilder online veröffentlicht werden.
References
- Tokgoz A, Wang S, Sastry P, et al. Assoziation von Kollagen, Elastin, Glykosaminoglykanen und Makrophagen mit der ultimativen Materialfestigkeit und -dehnung des Gewebes bei menschlichen thorakalen Aortenaneurysmen: eine uniaxiale Spannungsstudie. J Biomech Eng. 2022; 144(10):101001. doi:10.1115/1.4054060.
- Kadoglou NP, Liapis CD. Matrix-Metalloproteinasen: Beitrag zur Pathogenese, Diagnose, Überwachung und Behandlung von Bauchaortenaneurysmen. Curr Med Res Opin. 2004; 20(4):419-432. doi:10.1185/030079904125003143.
-
Savoia C, Burger D, Nishigaki N, Montezano A, Touyz RM. Angiotensin II und der vaskuläre Phänotyp bei Bluthochdruck. Sachverständiger Rev. Mol Med. 30. März 2011; 13:E11. doi:10.1017/S1462399411001815.
- Oxidativer Stress, Noxe und Hypertonie: experimentelle Beweise und klinische Kontroversen [veröffentlichte Korrektur erscheint in Ann Med. 2012 Dec; 44(8):854-8]. Ann Med. 2012; 44 Beilage 1:S2-S16. doi:10.3109/07853890.2011.653393.
- Garrido AM, Griendling KK. NADPH-Oxidasen und Angiotensin-II-Rezeptor-Signalgebung. Molzell-Endocrinol. 2009; 302(2):148-158. doi:10.1016/j.mce.2008.11.003.
- Saratzis A, Bown MJ. Die genetische Grundlage für Aortenaneurysmaterkrankungen. Herz. 2014; 100(12):916-922. doi:10.1136/heartjnl-2013-305130.
- Pleumeekers HJ, Hoes AW, van der Does E, et al. Aneurysmen der Bauchaorta bei älteren Erwachsenen. Die Rotterdamer Studie. Am J Epidemiol. 1995; 142(12):1291-1299. doi:10.1093/oxfordjournals.aje.a117596.
- Boese AC, Chang L, Yin KJ, Chen YE, Lee JP, Hamblin MH. Geschlechtsunterschiede bei Bauchaortenaneurysmen. Am J Physiol Heart Circ Physiol. 2018; 314(6):H1137-H1152. doi:10.1152/ajpheart.00519.2017.
- Ghosh A, Pechota A, Coleman D, Upchurch GR Jr, Eliason JL. Die durch Zigarettenrauch induzierte MMP2- und MMP9-Sekretion aus glatten Zellen der Aortengefäße wird über den Jak/Stat-Signalweg vermittelt. Hum Pathol. 2015; 46(2):284-294. doi:10.1016/j.humpath.2014.11.003.
-
Wang S, Zhang C, Zhang M, et al. Die Aktivierung der AMP-aktivierten Proteinkinase α2 durch Nikotin führt bei Mäusen in vivo zur Bildung von Bauchaortenaneurysmen. Nat Med. Juni 2012; 18(6):902-10. doi:10.1038/nm.2711.
- Johansson G, Markström U, Swedenborg J. Rupturierte thorakale Aortenaneurysmen: eine Studie über Inzidenz- und Mortalitätsraten. J Vasc Surg. 1995; 21(6):985-988. doi:10.1016/s0741-5214(95)70227-x.
- Task Force für Präventivdienste der USA. Screening auf abdominales Aortenaneurysma: Empfehlungserklärung der US Preventive Services Task Force. JAMA. 2019; 322(22):2211–2218. doi:10.1001/jama.2019.18928.
- Keisler B, Carter C. Abdominales Aortenaneurysma. Bin Fam Arzt. 2015; 91(8):538-543.
- Hirsch AT, Haskal ZJ, Hertzer NR, et al. ACC/AHA 2005 Praxisleitlinien für die Behandlung von Patienten mit peripherer arterieller Verschlusskrankheit (untere Extremität, Niere, Mesenterial- und Bauchaorta): ein gemeinsamer Bericht der American Association for Vascular Surgery/Society for Vascular Surgery, Society for Cardiovascular Angiography and Interventions, Society for Vascular Medicine and Biology, Society of Interventional Radiology, und die ACC/AHA Task Force on Practice Guidelines (Writing Committee to Develop Guidelines for the Management of Patients with Peripheral Arterial Disease): unterstützt von der American Association of Cardiovascular and Pulmonary Rehabilitation; Nationales Herz-, Lungen- und Blutinstitut; Gesellschaft für Gefäßpflege; Transatlantischer zwischengesellschaftlicher Konsens; und Stiftung für Gefäßerkrankungen. Auflage. 2006; 113(11):e463-e654. doi:10.1161/CIRCULATIONAHA.106.174526.
- Hiratzka LF, Bakris GL, Beckman JA, et al. 2010 ACCF/AHA/AATS/ACR/ASA/SCA/SCAI/SIR/STS/SVM Richtlinien für die Diagnose und Behandlung von Patienten mit thorakaler Aortenerkrankung: ein Bericht der American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines, American Association for Thoracic Surgery, American College of Radiology, American Stroke Association, Society of Cardiovascular Anesthesiologists, Society for Cardiovascular Angiography and Interventions, Society of Interventional Radiology, Society of Thoracic Surgeons und Society for Vascular Medicine [veröffentlichte Korrektur erscheint in Circulation. 2010 Juli 27; 122(4):e410]. Auflage. 2010; 121(13):e266-e369. doi:10.1161/CIR.0b013e3181d4739e.
- Coady MA, Davies RR, Roberts M, et al. Familiäre Muster von thorakalen Aortenaneurysmen. Arch Surg. 1999; 134(4):361-367. doi:10.1001/archsurg.134.4.361.
- Albornoz G, Coady MA, Roberts M, et al. Familiäre thorakale Aortenaneurysmen und Dissektionen - Inzidenz, Vererbungsarten und phänotypische Muster. Ann Thorac Chirurgie. 2006; 82(4):1400-1405. doi:10.1016/j.athoracsur.2006.04.098.
- Akkersdijk GJ, van Bockel JH. Rupturiertes Bauchaortenaneurysma: anfängliche Fehldiagnose und Auswirkungen auf die Behandlung. Eur J Surg. 1998; 164(1):29-34. doi:10.1080/110241598750004922.
- Gloviczki P, Pairolero PC, Mucha P Jr. et al. Rupturierte Bauchaortenaneurysmen: Die Reparatur sollte nicht geleugnet werden. J Vasc Surg. 1992; 15(5):851-859.
- Meijer CA, Stijnen T, Wasser MN, et al. Doxycyclin zur Stabilisierung von Bauchaortenaneurysmen: eine randomisierte Studie. Ann Praktikantin Med. 2013; 159(12):815-823. doi:10.7326/0003-4819-159-12-201312170-00007.
- Baxter BT, Matsumura J, Curci JA et al. Wirkung von Doxycyclin auf das Aneurysmawachstum bei Patienten mit kleinen infrarenalen abdominalen Aortenaneurysmen: eine randomisierte klinische Studie. JAMA. 2020; 323(20):2029-2038. doi:10.1001/jama.2020.5230.
- Baxter BT, Matsumura J, Curci J, et al. Nicht-invasive Behandlung des abdominalen Aortenaneurysmas Klinische Studie (N-TA(3)CT): Design einer placebokontrollierten, doppelblinden, randomisierten klinischen Phase-IIb-Studie mit Doxycyclin zur Verringerung des Wachstums des kleinen abdominalen Aortenaneurysmas. Betrachten Sie Clin-Prozesse. 2016;48:91-98. doi:10.1016/j.cct.2016.03.008.
- Davies RR, Goldstein LJ, Coady MA, et al. Jährliche Ruptur- oder Dissektionsraten für thorakale Aortenaneurysmen: einfache Vorhersage basierend auf der Größe. Ann Thorac Chirurgie. 2002; 73(1):17-28. doi:10.1016/s0003-4975(01)03236-2.
- Walsh SR, Tang TY, Sadat U, et al. Endovaskuläres Stenting versus offene Chirurgie bei thorakaler Aortenerkrankung: systematische Überprüfung und Metaanalyse der perioperativen Ergebnisse. J Vasc Surg. 2008; 47(5):1094-1098. doi:10.1016/j.jvs.2007.09.062.
- Cheng D, Martin J, Shennib H, et al. Endovaskuläre Aortenreparatur versus offene chirurgische Reparatur bei absteigender thorakaler Aortenerkrankung: eine systematische Überprüfung und Metaanalyse vergleichender Studien. J Am Coll Cardiol. 2010; 55(10):986-1001. doi:10.1016/j.jacc.2009.11.047.
- Abraha I, Romagnoli C, Montedori A, Cirocchi R. Thorakales Stenttransplantat versus Operation bei thorakalem Aneurysma. Cochrane Datenbank Syst Rev. 2013; (9):CD006796. Veröffentlicht 2013 Sep 11. doi:10.1002/14651858.CD006796.pub3.
- Matsumura JS, Cambria RP, Dake MD, et al. Internationale kontrollierte klinische Studie zur Reparatur des thorakalen endovaskulären Aneurysmas mit dem endovaskulären Transplantat Zenith TX2: 1-Jahres-Ergebnisse. J Vasc Surg. 2008; 47(2):247-257. doi:10.1016/j.jvs.2007.10.032.
- Bavaria JE, Appoo JJ, Makaroun MS, et al. Endovaskuläre Stenttransplantation versus offene chirurgische Reparatur von absteigenden thorakalen Aortenaneurysmen bei Patienten mit niedrigem Risiko: eine multizentrische Vergleichsstudie. J Thorax Herz-Kreislauf-Chirurgie 2007; 133(2):369-377. doi:10.1016/j.jtcvs.2006.07.040.
- Svensson LG, Crawford ES, Hess KR, Coselli JS, Safi HJ. Erfahrung mit 1509 Patienten, die sich einer thorakoabdominalen Aortenoperation unterziehen. J Vasc Surg. 1993; 17(2):357-370.
- Greenberg RK, Lu Q, Roselli EE, et al. Zeitgenössische Analyse der Reparatur von absteigenden thorakalen und thorakoabdominalen Aneurysmen: ein Vergleich von endovaskulären und offenen Techniken. Zirkulation. 2008; 118(8):808-817. doi:10.1161/CIRCULATIONAHA.108.769695.
- Jackson BM, Carpenter JP, Fairman RM et al. Anatomischer Ausschluss von der endovaskulären Reparatur des thorakalen Aortenaneurysmas. J Vasc Surg. 2007; 45(4):662-666. doi:10.1016/j.jvs.2006.12.062.
- Prüfärzte der EVAR-Studie des Vereinigten Königreichs, Greenhalgh RM, Brown LC et al. Endovaskuläre versus offene Reparatur des Bauchaortenaneurysmas. N Engl J Med. 2010; 362(20):1863-1871. doi:10.1056/NEJMoa0909305.
- Bulder RMA, Bastiaannet E, Hamming JF, Lindeman JHN. Metaanalyse des Langzeitüberlebens nach elektiver endovaskulärer oder offener Reparatur des Bauchaortenaneurysmas. Br J Surg. 2019; 106(5):523-533. doi:10.1002/bjs.11123.
- Powell JT, Sweeting MJ, Ulug P, et al. Meta-Analyse von Einzelpatientendaten aus EVAR-1-, DREAM-, OVER- und ACE-Studien zum Vergleich der Ergebnisse der endovaskulären oder offenen Reparatur bei abdominalem Aortenaneurysma über 5 Jahre [veröffentlichte Korrektur erscheint in Br J Surg. 2018 Aug; 105(9):1222. doi:10.1002/bjs.10928]. Br J Surg. 2017; 104(3):166-178. doi:10.1002/bjs.10430.
- Paravastu SC, Jayarajasingam R, Cottam R, Palfreyman SJ, Michaels JA, Thomas SM. Endovaskuläre Reparatur des Bauchaortenaneurysmas. Cochrane Datenbank Syst Rev. 2014; 2014(1):CD004178. Veröffentlicht 2014 Jan 23. doi:10.1002/14651858.CD004178.pub2.
- Stather PW, Sidloff D, Dattani N, Choke E, Bown MJ, Sayers RD. Systematische Überprüfung und Metaanalyse der frühen und späten Ergebnisse der offenen und endovaskulären Reparatur des abdominalen Aortenaneurysmas. Br J Surg. 2013; 100(7):863-872. doi:10.1002/bjs.9101.
- Lederle FA, Freischlag JA, Kyriakides TC, et al. Langzeitvergleich der endovaskulären und offenen Reparatur des abdominalen Aortenaneurysmas. N Engl J Med. 2012; 367(21):1988-1997. doi:10.1056/NEJMoa1207481.
- Teilnehmer der EVAR-Studie. Endovaskuläre Aneurysmareparatur versus offene Reparatur bei Patienten mit abdominalem Aortenaneurysma (EVAR-Studie 1): randomisierte kontrollierte Studie. Lanzette, 2005; 365(9478):2179-2186. doi:10.1016/S0140-6736(05)66627-5.
- De Bruin JL, Baas AF, Buth J, et al. Langzeitergebnis der offenen oder endovaskulären Reparatur des abdominalen Aortenaneurysmas. N Engl J Med. 2010; 362(20):1881-1889. doi:10.1056/NEJMoa0909499.
- Blankensteijn JD, de Jong SE, Prinssen M, et al. Zwei-Jahres-Ergebnisse nach konventioneller oder endovaskulärer Reparatur von abdominalen Aortenaneurysmen. N Engl J Med. 2005; 352(23):2398-2405. doi:10.1056/NEJMoa051255.
- Braun LC, Thompson SG, Greenhalgh RM, Powell JT; Teilnehmer der Studie zur endovaskulären Aneurysmareparatur. Inzidenz kardiovaskulärer Ereignisse und Tod nach offener oder endovaskulärer Reparatur eines abdominalen Aortenaneurysmas in der randomisierten EVAR-Studie 1. Br J Surg. 2011; 98(7):935-942. doi:10.1002/bjs.7485.
- Becquemin JP, Pillet JC, Lescalie F, et al. Eine randomisierte kontrollierte Studie zur Reparatur endovaskulärer Aneurysmen im Vergleich zur offenen Operation bei abdominalen Aortenaneurysmen bei Patienten mit niedrigem bis mittlerem Risiko. J Vasc Surg. 2011; 53(5):1167-1173.e1. doi:10.1016/j.jvs.2010.10.124.
- Siracuse JJ, Gill HL, Graham AR et al. Vergleichende Sicherheit der endovaskulären und offenen chirurgischen Reparatur von Bauchaortenaneurysmen bei männlichen Patienten mit niedrigem Risiko. J Vasc Surg. 2014; 60(5):1154-1158. doi:10.1016/j.jvs.2014.05.018.
- Vallabhaneni R, Farber MA, Schneider F, Ricco JB. Debatte: ob junge Patienten mit gutem Risiko mit endovaskulärer Bauchaortenaneurysmareparatur behandelt werden sollten. J Vasc Surg. 2013; 58(6):1709-1715. doi:10.1016/j.jvs.2013.09.017.
- Sandford RM, Choke E, Bown MJ, Sayers RD. Was ist die beste Option für die elektive Reparatur eines Bauchaortenaneurysmas bei einem jungen, fitten Patienten? Eur J Vasc Endovasc Surg. 2014; 47(1):13-18. doi:10.1016/j.ejvs.2013.09.014.
- Lee K, Tang E, Dubois L, Power AH, DeRose G, Forbes TL. Haltbarkeit und Überleben sind nach elektiver endovaskulärer und offener Reparatur von Bauchaortenaneurysmen bei jüngeren Patienten ähnlich. J Vasc Surg. 2015; 61(3):636-641. doi:10.1016/j.jvs.2014.10.012.
- Siracuse JJ, Schermerhorn ML, Meltzer AJ et al. Vergleich der Ergebnisse nach endovaskulärer und offener Reparatur von Bauchaortenaneurysmen bei Patienten mit niedrigem Risiko. Br J Surg. 2016; 103(8):989-994. doi:10.1002/bjs.10139.
- Crawford ES, Crawford JL, Safi HJ et al. Thorakoabdominale Aortenaneurysmen: präoperative und intraoperative Faktoren, die die unmittelbaren und langfristigen Operationsergebnisse bei 605 Patienten bestimmen. J Vasc Surg. 1986; 3(3):389-404. doi:10.1067/mva.1986.avs0030389.
- Backes WH, Nijenhuis RJ, Mess WH, Wilmink FA, Schurink GW, Jacobs MJ. Magnetresonanzangiographie der kollateralen Blutversorgung des Rückenmarks bei Patienten mit thorakalem und thorakoabdominalem Aortenaneurysma. J Vasc Surg. August 2008; 48(2):261–271. doi:10.1016/j.jvs.2008.03.015.
- Jacobs MJ, de Mol BA, Elenbaas T, et al. Blutversorgung des Rückenmarks bei Patienten mit thorakoabdominalen Aortenaneurysmen. J Vasc Surg. Januar 2002; 35(1):30–37. doi:10.1067/mva.2002.120041.
- Griepp EB, Griepp RB. Das kollaterale Netzwerkkonzept: Minimierung der Querschnittslähmung infolge einer thorakoabdominalen Aortenaneurysmaresektion. Tex Herz Inst J. 2010; 37(6):672–674.
- Wynn MM, Acher CW. Eine moderne Theorie der Rückenmarksischämie/-verletzung in der thorakoabdominalen Aortenchirurgie und ihre Implikationen für die Prävention von Lähmungen. J Cardiothorac Vasc Anesth. 2014; 28(4):1088-1099. doi:10.1053/j.jvca.2013.12.015.
- Eagleton MJ, Shah S, Petkosevek D, Mastracci TM, Greenberg RK. Die Durchgängigkeit der hypogastrischen und subclavialen Arterie beeinflusst den Beginn und die Genesung der Rückenmarksischämie im Zusammenhang mit dem Aorten-Endografting. J Vasc Surg. 2014; 59(1):89-94. doi:10.1016/j.jvs.2013.07.007.
- Cooley DA. Eine kurze Geschichte der Aortenaneurysmachirurgie. Aorta (Stamford). 2013; 1(1):1-3. Veröffentlicht 2013 Jun 1. doi:10.12945/j.aorta.2013.12.006.
- Wongkornrat W, Yamamoto S, Sekine Y, et al. Prädiktoren für Querschnittslähmung mit aktueller thorakoabdominaler Aortenaneurysmareparatur. Asiatischer Herz-Kreislauf-Thorax Ann. 2015; 23(4):406-411. doi:10.1177/0218492314549563.
- Kotelis D, Geisbüsch P, von Tengg-Kobligk H, Allenberg JR, Böckler D. Paraplegie nach endovaskulärer therapie der thorakalen und thorakoabdominellen Aorta. Zentralbl Chir. 2008; 133(4):338-343. doi:10.1055/s-2008-1076903.
- Frederick JR, Woo YJ. Thorakoabdominales Aortenaneurysma. Ann Herz-Thorax-Chirurgie. 2012; 1(3):277-285. doi:10.3978/j.issn.2225-319X.2012.09.01.
Cite this article
Del Re A, Mohebali J, Patel VI. Reparatur des thorakabalen Aortenaneurysmas. J Med Insight. 2024; 2024(109). doi:10.24296/jomi/109.


